(完整版)初中化学方程式汇总(打印版),推荐文档
- 格式:pdf
- 大小:177.09 KB
- 文档页数:12

初三化学方程式必背集锦(打印版)1. 化学方程式概述化学方程式是化学反应的数学表达式,它描述了反应物和物之间的定量关系。
在初三化学学习中,掌握化学方程式是理解和应用化学反应的基础。
本集锦将汇总初三化学教材中常见的化学方程式,帮助同学们更好地记忆和应用。
2. 常见化学反应类型(3) 置换反应:一种单质和一种化合物反应另一种单质和另一种化合物的反应。
例如,铁和硫酸铜反应硫酸亚铁和铜:Fe + CuSO4 → FeSO4 + Cu。
(4) 复分解反应:两种化合物相互交换成分,两种新的化合物的反应。
例如,盐酸和氢氧化钠反应氯化钠和水:HCl + NaOH → NaCl+ H2O。
3. 初三化学方程式必背集锦(1) 氢气和氧气反应水:2H2 + O2 → 2H2O。
(2) 水电解氢气和氧气:2H2O → 2H2 + O2。
(3) 铁和硫酸铜反应硫酸亚铁和铜:Fe + CuSO4 → FeSO4 + Cu。
(4) 盐酸和氢氧化钠反应氯化钠和水:HCl + NaOH → NaCl +H2O。
(5) 氢氧化钙和二氧化碳反应碳酸钙和水:C a(OH)2 + CO2 → CaCO3↓ + H2O。
(6) 碳酸钙和盐酸反应氯化钙、水和二氧化碳:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑。
(7) 氢气和氧化铜反应铜和水:H2 + CuO → Cu + H2O。
(8) 氧气和甲烷反应二氧化碳和水:CH4 + 2O2 → CO2 + 2H2O。
(9) 氧气和硫反应二氧化硫:S + O2 → SO2。
(10) 氧气和铁反应四氧化三铁:3Fe + 2O2 → Fe3O4。
初三化学方程式必背集锦(打印版)3. 化学方程式的书写规则(1) 反应物和物之间用箭头“→”表示。
(2) 化学式中的数字表示物质的量,写在化学式的下方,称为化学计量数。
化学计量数表示反应物和物之间的摩尔比例。
(3) 在某些情况下,反应物和物之间可能需要添加状态符号,如固体(s)、液体(l)、气体(g)和溶液(aq)。

初中化学方程式汇总一、物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧: 2Mg + O2点燃 2MgO2. 铁在氧气中燃烧: 3Fe + 2O2点燃 Fe3O43. 铜在空气中受热: 2Cu + O2加热 2CuO4. 铝在空气中燃烧: 4Al + 3O2点燃 2Al2O35. 氢气中空气中燃烧: 2H2 + O2点燃 2H2O6. 红磷在空气中燃烧: 4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧: S + O2点燃 SO28. 碳在氧气中充分燃烧: C + O2点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO + O2点燃 2CO211. 甲烷在空气中燃烧: CH4 + 2O2点燃 CO2 + 2H2O12. 酒精在空气中燃烧: C2H5OH + 3O2点燃 2CO2 + 3H2O二、几个分解反应:13. 水在直流电的作用下分解: 2H2O 通电 2H2↑+ O2 ↑14. 加热碱式碳酸铜: C u2(OH)2CO3加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3Mn O2 2KCl + 3O2 ↑16. 加热高锰酸钾: 2KMnO4加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解: H2CO3 === H2O + CO2↑18. 高温煅烧石灰石: CaCO3高温CaO + CO2↑18-1. 双氧水(过氧化氢)催化分解:2H2O2Mn O22H2O + O2↑三、几个氧化还原反应:19. 氢气还原氧化铜: H2 + CuO加热 Cu + H2O20. 木炭还原氧化铜: C + 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁: 3C + 2Fe2O3高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁: 2C + Fe3O4高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜: CO + CuO 加热Cu + CO224. 一氧化碳还原氧化铁: 3CO + Fe2O3高温2Fe + 3CO225. 一氧化碳还原四氧化三铁: 4CO + Fe3O4高温3Fe + 4CO2四、单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸┈┈┈┈盐 + 氢气(置换反应)26. 锌和稀硫酸 Zn + H2SO4 === ZnSO4 + H2↑27. 铁和稀硫酸 Fe + H2SO4 === FeSO4 + H2↑28. 镁和稀硫酸 Mg + H2SO4 === MgSO4 + H2↑29. 铝和稀硫酸 2Al +3H2SO4 === Al2(SO4)3 +3H2↑30. 锌和稀盐酸 Zn + 2HCl=== ZnCl2 + H2↑31. 铁和稀盐酸 Fe + 2HCl=== FeCl2 + H2↑32. 镁和稀盐酸 Mg+ 2HCl=== MgCl2 + H2↑33. 铝和稀盐酸 2Al + 6HCl === 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液)┈┈┈┈另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应: Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应: Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸┈┈┈┈盐 + 水37. 氧化铁和稀盐酸反应: Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应: CuO + 2HCl === CuCl2 + H2O40. 氧化铜和稀硫酸反应: CuO + H2SO4 === CuSO4 + H2O41. 氧化镁和稀硫酸反应: MgO + H2SO4 === MgSO4 + H2O42. 氧化钙和稀盐酸反应: CaO + 2HCl === CaCl2 + H2O(4)酸性氧化物 +碱┈┈┈┈盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质: Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47. 消石灰吸收二氧化硫: Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱┈┈┈┈盐 + 水48.盐酸和烧碱起反应: HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应: HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应: 2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O54.硫酸和烧碱反应: H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应: H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应: H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应: 3H2SO4+ 2Fe(OH)3=== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应: HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐┈┈┈┈另一种酸 + 另一种盐59.大理石与稀盐酸反应: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl == MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应: Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应: H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(7)碱 + 盐┈┈┈┈另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐┈┈┈┈两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 === AgCl↓ + NaNO3 71.硫酸钠和氯化钡: Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五、其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476. 硫酸铜晶体受热分解,不同温度下分解产物不同。

初中化学方程式汇总一、物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe O3 43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O 点燃2Al O2 23 5. 氢气中空气中燃烧:2H2 + O 2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P O2 57. 硫粉在空气中燃烧:S + O 2 点燃 SO28. 碳在氧气中充分燃烧: C + O 2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO + O 2 点燃2CO11. 甲烷在空气中燃烧: CH 4 + 2O 2点燃CO 2 + 2H 2 O 12.酒精在空气中燃烧:C H OH + 3O 点燃 2CO + 3H 2O2 522二、几个分解反应:13.水在直流电的作用下分解: 2H2 O 通电 2H ↑+ O ↑2214. 加热碱式碳酸铜: C u2(OH)2CO 3加热2CuO + H 2O + CO 2↑15.加热氯酸钾(有少量的二氧化锰): 2KClO 3 Mn O 2 2KCl + 3O 2 ↑16.加热高锰酸钾: 2KMnO加热 K MnO+ MnO + O 4 22 4 2 ↑17.碳酸不稳定而分解:H 2CO 3 === H 2O + CO 2↑18. 高温煅烧石灰石: CaCO3 高温CaO + CO 2↑18-1. 双氧水(过氧化氢)催化分解:Mn2HO O2H O + O ↑2222三、几个氧化还原反应:19. 氢气还原氧化铜: H2+ CuO 加热 Cu + H 2O20. 木炭还原氧化铜: C + 2CuO 高温2Cu + CO 2↑ 21. 焦炭还原氧化铁: 3C + 2Fe2O 3高温4Fe + 3CO 2↑22. 焦炭还原四氧化三铁: 2C + Fe3O 4高温3Fe + 2CO 2↑ 23. 一氧化碳还原氧化铜:CO + CuO加热Cu + CO 224. 一氧化碳还原氧化铁:3CO + Fe 2 O 3 高温2Fe + 3CO 2 25.一氧化碳还原四氧化三铁: 4CO + Fe 3 O 高温 3Fe + 4CO42四、单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 ┈┈┈┈ 盐 +氢气 (置换反应)26. 锌和稀硫酸 Zn + H 2SO 4 === ZnSO 4 + H 2↑ 27. 铁和稀硫酸 Fe + H 2SO 4 === FeSO 4 + H 2↑ 28.镁和稀硫酸 Mg + H 2SO 4 === MgSO 4+ H 2↑ 29.铝和稀硫酸2Al +3H 2SO === Al (SO) 3+3H ↑424230. 锌和稀盐酸Zn + 2HCl=== ZnCl 2 + H 2↑31. 铁和稀盐酸 Fe + 2HCl === FeCl 2 + H 2 ↑ 32.镁和稀盐酸Mg+ 2HCl === MgCl + H ↑2233. 铝和稀盐酸 2Al + 6HCl=== 2AlCl 3 + 3H 2↑(2)金属单质 + 盐(溶液) ┈┈┈┈ 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应: Fe + CuSO 4 === FeSO 4 + Cu 35.锌和硫酸铜溶液反应:Zn + CuSO4=== ZnSO + Cu436. 铜和硝酸汞溶液反应: Cu + Hg(NO 3) 2 === Cu(NO 3 ) 2 + Hg(3)碱性氧化物 + 酸 ┈┈┈┈ 盐 + 水37.氧化铁和稀盐酸反应: Fe O + 6HCl === 2FeCl3+ 3H O2 3238. 氧化铁和稀硫酸反应: Fe 2O 3 + 3H 2SO 4 === Fe 2(SO 4 ) 3 + 3H 2O39. 氧化铜和稀盐酸反应:CuO + 2HCl === CuCl2+ H 2O40. 氧化铜和稀硫酸反应: CuO + H 2SO 4 === CuSO 4 + H 2O41. 氧化镁和稀硫酸反应: MgO + H 2SO 4 === MgSO 4 + H 2O 42.氧化钙和稀盐酸反应:CaO + 2HCl === CaCl2+ H 2O(4)酸性氧化物 + 碱┈┈┈┈盐 + 水43.苛性钠暴露在空气中变质: 2NaOH + CO 2==== Na 2CO 3 + H 2O 44.苛性钠吸收二氧化硫气体: 2NaOH + SO 2==== Na 2SO 3 + H 2O 45.苛性钠吸收三氧化硫气体: 2NaOH + SO 3==== Na 2SO 4 + H 2O46.消石灰放在空气中变质:Ca(OH) 2 + CO 2 ==== CaCO 3 ↓+ H 2O47. 消石灰吸收二氧化硫:Ca(OH)2+ SO 2 ==== CaSO 3 ↓+ H 2O(5)酸 + 碱 ┈┈┈┈ 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H 2O49. 盐酸和氢氧化钾反应: HCl + KOH ==== KCl +H 2O50.盐酸和氢氧化铜反应: 2HCl + Cu(OH) 2 ==== CuCl 2 + 2H 2O 51. 盐酸和氢氧化钙反应: 2HCl + Ca(OH) 2==== CaCl 2 + 2H 2O 52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3==== FeCl 3 + 3H O253. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH) 3 == AlCl 3 + 3H 2O54. 硫酸和烧碱反应:H2 SO + 2NaOH ==== Na SO + 2H 2O42 455. 硫酸和氢氧化钾反应:H2SO + 2KOH ==== K SO + 2H O424256. 硫酸和氢氧化铜反应:H 2SO 4 + Cu(OH) 2 ==== CuSO 4 + 2H 2O 57. 硫酸和氢氧化铁反应:3H SO + 2Fe(OH) === Fe (SO ) + 6HO24 3 2 43258. 硝酸和烧碱反应:HNO+ NaOH ==== NaNO+H O332(6)酸 + 盐 ┈┈┈┈ 另一种酸 + 另一种盐59.大理石与稀盐酸反应: CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑ 60.碳酸钠与稀盐酸反应 : Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑ 61.碳酸镁与稀盐酸反应 : MgCO 3 + 2HCl == MgCl 2+ H O + CO ↑2 262.盐酸和硝酸银溶液反应: HCl + AgNO === AgCl ↓ + HNO3363. 硫酸和碳酸钠反应: Na2CO 3 + H 2SO 4 === Na 2SO 4 + H 2O + CO 2↑64. 硫酸和氯化钡溶液反应: H SO + BaCl2==== BaSO ↓+ 2HCl2 44(7)碱 + 盐 ┈┈┈┈另一种碱 + 另一种盐65.氢氧化钠与硫酸铜: 2NaOH + CuSO 4==== Cu(OH)2↓ + Na 2SO 4 66.氢氧化钠与氯化铁: 3NaOH + FeCl 3 ==== Fe(OH) 3↓ + 3NaCl67.氢氧化钠与氯化镁: 2NaOH + MgCl 2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜: 2NaOH + CuCl 2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠: Ca(OH)2 + Na 2CO 3 === CaCO 3↓+ 2NaOH(8)盐 + 盐 ┈┈┈┈两种新盐70.氯化钠溶液和硝酸银溶液: NaCl + AgNO 3 === AgCl ↓ + NaNO 371.硫酸钠和氯化钡:Na 2SO 4 + BaCl 2 ==== BaSO 4↓ + 2NaCl五、其它反应:72.二氧化碳溶解于水: CO 2 + H 2O === H 2CO 373.生石灰溶于水: CaO + H 2O === Ca(OH)2 74.氧化钠溶于水: Na 2O + H 2O ==== 2NaOH 75.三氧化硫溶于水: SO 3 + H 2O ==== H 2SO 476.硫酸铜晶体受热分解,不同温度下分解产物不同。

初中化学方程式总汇一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2=加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧: S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2=点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2=点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O2↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3=高温= 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO235.一氧化碳的可燃性:2CO + O2 =点燃= 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (4)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。

2Hg+O 22HgO2HgO2Hg+O2↑4P+5O22P2O5C+O2CO2S+O2SO22Mg+O22MgO3Fe+2O2Fe3O42KMnO4K2MnO4+MnO2+O2↑2KClO32KCl+3O2↑2H2O22H2O+O2↑2H2+O22H2O2H2O2H2↑+O2↑2C+O22CO2CO+O22CO2C+2CuO2Cu+CO2↑3C+2Fe2O34Fe+3CO2↑C+CO22COCO2+H2O═H2CO3H2CO3═H2O+CO2↑CO2+Ca(OH)2═CaCO3↓+H2O CaCO3+2HCl═CaCl2+H2O+CO2↑CaCO3CaO+CO2↑2CO+O22CO2CuO+CO Cu+CO2Fe2O3+3CO2Fe+3CO2 CaO+H2O═Ca(OH)2C2H5OH+3O22CO2+3H2O CH4+2O2CO2+H2OZn+H2SO4═ZnSO4+H2↑2Cu+O22CuO4Al+3O2═2Al2O3Fe+H2SO4═FeSO4+H2↑Fe+2HCl═FeCl2+H2↑Zn+H2SO4═ZnSO4+H2↑Zn+2HCl═ZnCl2+H2↑Mg+H2SO4═MgSO4+H2↑Mg+2HCl═MgCl2+H2↑2Al+3H2SO4═Al2(SO4)3+3H2↑2Al+6HCl═2AlCl3+3H2↑Fe+CuSO4═FeSO4+CuCu+2AgNO3═2Ag+Cu(NO3)22Al+3CuSO4═Al2(SO4)3+3CuFe2O3+6HCl═2FeCl3+3H2OFe2O3+3H2SO4═Fe2(SO4)3+3H2O CuO+H2SO4═CuSO4+H2OHCl+NaOH═NaCl+H2OH2SO4+2NaOH═Na2SO4+2H2O2HCl+Ca(OH)2═CaCl2+2H2O3HCl+Al(OH)3═AlCl3+3H2ONa2CO3+2HCl═2NaCl+H2O+CO2↑NaHCO3+HCl═NaCl+H2O+CO2↑AgNO3+HCl═AgCl↓+HNO3BaCl2+H2SO4═BaSO4↓+2HCl△△点燃点燃点燃点燃点燃△△MnO2 MnO2点燃通电点燃点燃高温高温高温高温点燃△高温△点燃点燃Ba(NO 3)2+H 2SO 4═BaSO 4↓+2HNO 3 2NaOH+CO 2═Na 2CO 3+H 2O 2NaOH+SO 2═Na 2SO 3+H 2ONa 2CO 3+Ca(OH)2═CaCO 3↓+2NaOH 2NaOH+CuSO 4═Cu(OH)2↓+Na 2SO 4 Ca(OH)2+CuSO 4═Cu(OH)2↓+CaSO 43NaOH+FeCl 3═Fe(OH)3↓+NaCl Ba(OH)2+CuSO 4═Cu(OH)2↓+BaSO 4↓ Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl AgNO 3+NaCl ═AgCl ↓+NaNO 3 BaCl 2+Na 2SO 4═BaSO 4↓+2NaCl Ba(NO 3)2+Na 2SO 4═BaSO 4↓+2NaNO 3文字表达式:石蜡+氧气 二氧化碳+水汞+氧气氧化汞氧化汞汞+氧气 红磷+氧气五氧化二磷 硫+氧气二氧化硫木炭+氧气二氧化碳 铁+氧气四氧化三铁 镁+氧气氧化镁高锰酸钾 锰酸钾+二氧化锰+氧气 氯酸钾氯化钾+氧气过氧化氢水+氧气氢气+氧气水 水氢气+氧气 铁+硫酸铜硫酸亚铁+铜碳酸钠+稀盐酸氯化钠+水+二氧化碳点燃加热加热点燃二氧化锰加热加热点燃 点燃 点燃点燃通电 点燃。
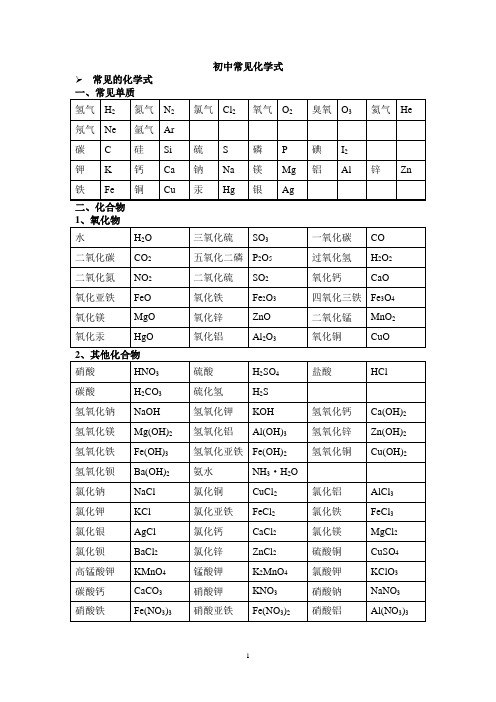
初中常见化学式➢常见的化学式初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2点燃 2CO9、二氧化碳通过灼热碳层:2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K22+O2↑172O 通电 2H2↑+O2↑1823 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4== ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2+CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2+3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233:Ca(OH)2+ CO2==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3+H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2+H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O+CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H22点燃 2H2O6. 红磷在空气中燃烧:2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:2点燃 CO29. 碳在氧气中不充分燃烧:2点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO22H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO215.3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H232O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:34高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe23高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温 3Fe+ 4CO2(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4= FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4= MgSO4+H2↑29. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2=== Cu(NO3)2+Hg(3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4=== Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3+3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4+2H2O57. 硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4=== Na2SO4+H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4+BaCl2==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3=== CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO45H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O 3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水4氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ4MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu223Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H 2SO 4 =MgSO 4 +H 2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H 2SO 4=Al 2(SO4)3+ 3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe 2O 3+3H 2 Δ 2Fe +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译、试管壁有液体 冶炼金属、WO 3 +3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的还原性 MoO 3 +3H 2 ΔMo +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸CuSO 4 +2NaOH=Cu(OH)2↓+ Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 点燃2CO 2 蓝色火焰 煤气燃烧 C+ CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4 +2C 高温3Fe+ 2CO 2↑ 冶炼金属 C+ CO2 高温2COCO 2+ H 223 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文 H 2CO 3 ΔCO 2↑+ H 2O 石蕊红色褪去Ca(OH)2 +CO 2= CaCO 3↓+ H 2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 CaCO 3 +H 2O+ CO 2 = Ca(HCO 3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 Ca(HCO 3)2Δ CaCO 3↓+ H 2O +CO 2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.2NaHCO 3ΔNa 2CO 3+ H 2O +CO 2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 CaCO 3 高温 CaO +CO 2↑ 工业制备二氧化碳和生石灰 CaCO 3 2+ H 2O +CO 2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg+ O 2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 2 点燃 Fe 3O 4 3. 铜在空气中受热:2Cu+ O 2 加热 2CuO 4. 铝在空气中燃烧:4Al +3O2 点燃2Al 2O 3 5. 氢气中空气中燃烧:2H 2 +O 2 点燃 2H 2O 6. :4P +5O 2 点燃 2P 2O 5 7. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:2 点燃 CO 2 9. 碳在氧气中不充分燃烧:2 点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 2 点燃 2CO 211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2↑14.加热高锰酸钾:2KMnO4加热 K242+O2↑(实验室制氧气原理1)15 H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:44+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO282CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3== H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33:Ca(OH)2 +CO2=== CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2+3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4= FeSO4+H2↑46. 镁和稀硫酸Mg +H2SO4= MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4+Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4+Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2== Cu(NO3)2+Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3+6HCl ==2FeCl3+3H2O57. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2+H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3+3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2+H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3+2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4+BaCl2== BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3+H2O70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4+H2O71.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO 2 == CaSO 3↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐 74. 铁和硫酸铜溶液反应:Fe+ CuSO 4 == FeSO 4 +Cu (2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl 一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。
初中化学知识总结(化学方程式) 一、化合反应1、镁在空气中燃烧:2Mg + O 2 ==2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O 2 ====Fe 3O 4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体 注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底. 4、铜在空气中受热:2Cu + O 2 ==== 2CuO 现象:铜丝变黑. 6、铝在空气中燃烧:4Al + 3O 2 ====2Al 2O 3 现象:发出耀眼的白光,放热,有白色固体生成.7、氢气中空气中燃烧:2H 2 + O 2 === 2H 2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾. 8、红(白)磷在空气中燃烧:4P + 5O 2==== 2P 2O 5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧: S + O 2 ===SO 2现象:A 、在纯的氧气中 发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体. B 、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体. 10、碳在氧气中充分燃烧:C + O 2 === CO 2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊 11、碳在氧气中不充分燃烧:2C + O 2 === 2CO12、二氧化碳通过灼热碳层: C + CO 2 ==== 2CO(是吸热的反应) 点燃点燃点燃点燃△点燃点燃点燃 点燃高温13、一氧化碳在氧气中燃烧:2CO + O 2 ==== 2CO 2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊. 14、二氧化碳和水反应(二氧化碳通入紫色石蕊试液): CO 2 + H 2O === H 2CO 3 现象:石蕊试液由紫色变成红色。
注意: 酸性氧化物+水→酸如:SO 2 + H 2O === H 2SO 3 SO 3 + H 2O === H 2SO 415、生石灰溶于水:CaO + H 2O === Ca (OH)2(此反应放出热量) 注意: 碱性氧化物+水→碱氧化钠溶于水:Na 2O + H 2O =2NaOH 氧化钾溶于水:K 2O + H 2O =2KOH氧化钡溶于水:BaO + H 2O ==== Ba (OH )216、钠在氯气中燃烧:2Na + Cl 2===2NaCl17、无水硫酸铜作干燥剂:CuSO 4 + 5H 2O ==== CuSO 4•5H 2O 二、分解反应:17、水在直流电的作用下分2H 2O =====2H 2↑+ O 2 ↑ 现象:(1)电极上有气泡产生.H 2:O 2=2:1 正极产生的气体能使带火星的木条复燃.负极产生的气体能在空气中燃烧,产生淡蓝色火焰18、加热碱式碳酸铜:Cu 2(OH)2CO 3 ===== 2CuO + H 2O + CO 2↑ 现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
初中化学方程式汇总(打印版) 初中化学方程式汇总一、物质与氧气的反应:1.镁在空气中燃烧:2Mg + O2 → 2MgO2.铁在氧气中燃烧:3Fe + 2O2 → Fe3O43.铜在空气中受热:2Cu + O2 → 2CuO4.铝在空气中燃烧:4Al + 3O2 → 2Al2O35.氢气中空气中燃烧:2H2 + O2 → 2H2O6.红磷在空气中燃烧:4P + 5O2 → 2P2O57.硫粉在空气中燃烧:S + O2 → SO28.碳在氧气中充分燃烧:C + O2 → CO29.碳在氧气中不充分燃烧:2C + O2 → 2CO2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 → 2CO211.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O二、几个分解反应:13.水在直流电的作用下分解:2H2O → 2H2↑+ O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3 → 2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KCl O3MnO2 → 2KCl + 3O2↑16.加热高锰酸钾:2KMnO4 → K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 → H2O + CO2↑18.高温煅烧石灰石:CaCO3 → 高温CaO + CO2↑18-1.双氧水(过氧化氢)催化分解:2H2O2MnO2 →2H2O + O2↑三、几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO → Cu + H2O20.木炭还原氧化铜:C + 2CuO → 2Cu + CO2↑21.焦炭还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C + Fe3O4 → 3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO + CuO → Cu + CO2↑24.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl。
化学方程式: 一.氧气的性质 ⒈制取氧气:⑴过氧化氢溶液中添加入二氧化锰:2H 2O 22H 2O+O 2↑⑵氯酸钾制氧气:2KClO 32KCl+3O 2↑⑶加热高锰酸钾:2KMnO 4MnO 2+K 2MnO 4+O 2↑⒉单质与氧气的反应(化合反应): ⑴氢气在空气中燃烧:2H 2+O 22H 2O 淡蓝色火焰、放热、罩干冷的烧杯有水雾(2)硫在空气中燃烧:S+O 2SO 2 淡蓝色火焰、放热、有刺激性气味。
(氧气中为蓝紫色)(3)磷在空气中燃烧:4P+5O 22P 2O 5 红磷燃烧、发光放热、黄色火焰、大量白烟 (4)铁在氧气中燃烧:3Fe+2O 2Fe 3O 4 剧烈燃烧 火星四射、放出大量热、生成黑色固体(5)铜在空气中受热:2Cu+O 22CuO 红色固体变成黑色 (6)铝耐腐蚀的原因:4Al+3O 22Al 2O 3⒊化合物与氧气反应:⑴一氧化碳在空气中燃烧:2CO+O 22CO 2⑵甲烷在空气中燃烧:CH 4+2O 2CO 2+2H 2O⑶酒精在空气中燃烧:C 2H 5OH+3O 22CO 2+3H 2O二.自然界中的水⑴水在直流电的作用下分解:2H 2O 2H 2↑+O 2↑⑵制取氢气:Zn+H 2SO 4ZnSO 4+H 2↑或Zn+2HClZnCl 2+H 2↑(无稀硫酸才用)⑶生石灰与水反应:CaO+H 2O Ca(OH)2三.质量守恒定律(1)铁与硫酸铜溶液反应:Fe+CuSO 4Cu+FeSO 4 有亮红色固体生成,溶液由蓝色变为浅绿色(2)用氢气还原氧化铜:H 2+CuOCu+H 2O△电解点燃点燃点燃△ 点燃 点燃点燃点燃△ △ MnO 2MnO 2四.碳和碳的氧化物 ⒈碳的化学性质:⑴碳在空气充分中燃烧:C+O 2CO 2⑵碳在空气不充分中燃烧:2C+O 22CO⑶木炭还原氧化铜:C+2CuO2Cu+CO 2↑⑷焦炭还原氧化铁:3C+2Fe 2O 32Fe+3CO 2↑⑸焦炭还原四氧化三铁:2C+Fe 3O 43Fe+2CO 2↑2.二氧化碳的制取和性质:⑴大理石(或石灰石)与稀盐酸反应(实验室制取二氧化碳):CaCO 3+2HCl CaCl 2+H 2O+CO 2↑⑵正常雨水呈酸性原因:H 2O+CO 2H 2CO 3⑶高温煅烧石灰石(工业制取二氧化碳):CaCO 3CO 2↑+CaO(4)澄清石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2+CO 2CaCO 3↓+H 2O (5)氢氧化钠与二氧化碳的反应(去除二氧化碳):2NaOH+CO 2Na 2CO 3+H 2O⒋一氧化碳的性质:⑴一氧化碳在空气中燃烧:2CO+O 22CO 2⑵一氧化碳还原氧化铜:CO+CuOCu+CO 2 ⑶一氧化碳还原氧化铁:3CO+Fe 2O 3Fe+3CO 2⑷一氧化碳还原四氧化三铁:4CO+Fe 3O 43Fe+4CO 2五.燃料及其运用⑴碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ ⑵碳酸氢钠受热易分解(干粉灭火器的原理):2NaHCO 3Na 2CO 3+H 2O+CO 2↑六.金属⒈金属与氧气的反应: ⒉酸+金属盐+氢气(置换反应):△高温高温△ 点燃高温高温高温高温点燃点燃⑴锌与稀硫酸反应:Zn+H 2SO 4ZnSO 4+H 2↑⑵铁与稀硫酸反应:Fe+H 2SO 4FeSO 4+H 2↑ 有气泡产生,溶液由无色变为浅绿色(3)铝与稀硫酸反应:2Al+3H 2SO 4Al 2(SO 4)3+3H 2↑⒊金属+盐新盐+新金属:⑴铁与硫酸铜溶液反应:Fe+CuSO 4FeSO 4+Cu ⑵锌与硫酸铜溶液反应:Zn+CuSO 4ZnSO 4+Cu ⑶铜与硝酸银溶液反应:Cu+2AgNO 3Cu(NO 3)2+2Ag⒋铁的炼制: ⑴高炉上层:3CO+Fe 2O 32Fe+3CO 2}⑵高炉中层:CO 2+C 2CO (产生CO ,提供还原剂) ⑶高炉下层:C+O 2CO 2 (放热,提供热量)七.酸、碱、盐⒈酸的化学性质: ⑴酸+金属盐+氢气(见上)⑵酸+金属氧化物盐+水:②氧化铁与稀硫酸反应:Fe 2O 3+3H 2SO 4Fe 2(SO 4)3+3H 2O (红棕色固体消失,溶液由无色变为黄色)③氧化铜与稀盐酸反应:CuO+2HCl CuCl 2+H 2O⑶酸+碱盐+水(中和反应):①盐酸与烧碱反应:HCl+NaOHNaCl+H 2O③氢氧化铝与盐酸反应(治疗胃酸过多):3HCl+Al(OH)3AlCl 3+3H 2O⑷酸+盐新酸+新盐:②碳酸钠与稀盐酸反应:Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ ③碳酸氢钠与稀盐酸反应:NaHCO 3+HClNaCl+H 2O+CO 2↑ ④硫酸与氢氧化钡溶液反应:H 2SO 4+BaCl 2BaSO 4↓+2HCl⒉碱的化学性质:点燃 高温高温⑴碱+非金属氧化物盐+水:①氢氧化钠溶液暴露在空气中变质:2NaOH+CO2Na2CO3+H2O②氢氧化钠溶液吸收二氧化硫气体:2NaOH+SO2+Na2SO3+H20③氢氧化钠溶液吸收三氧化硫气体:2NaOH+SO3Na2SO4+H2O④氢氧化钙暴露在空气中变质:Ca(OH)2+CO2CaCO3↓+H2O⑤消石灰吸收二氧化硫:Ca(OH)2+SO2CaCO3↓+H2O⑵碱+酸盐+水(见上)⑶碱+盐新碱+新盐:①纯碱制烧碱:Ca(OH)2+Na2CO32NaOH+CaCO3↓②氢氧化钙与硫酸铜反应(制取波尔多液):Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓⒊盐的化学性质:⑴盐+金属新金属+新盐(见上):①铁与硝酸汞反应:Fe+Hg(NO3)2Fe(N O3)2+Hg⑵盐+酸新酸+新盐(见上):①硝酸银溶液与盐酸反应:AgNO3+HCl AgCl↓+HNO3⑶盐+碱新碱+新盐:①硫酸铜溶液与盐酸反应:CuSO4+2NaOH Cu(OH)2↓+Na2SO4②氯化铁溶液与氢氧化钠溶液反应:FeCl3+3NaOH Fe(O H)3↓+3NaCl⑤氢氧化钠溶液与氯化铵溶液反应:NaOH+NH43↑+H2O⑷盐+盐新盐+新盐:①氯化钠与硝酸银反应:NaCl+AgNO3AgCl↓+NaNO3②硫酸钠与氯化钡反应:Na2SO4+BaCl2BaSO4↓+2NaCl八、化学与生活:⑴葡萄糖在酶的作用下缓慢氧化:C6H12O6+6O26CO2+6H2O酶。
初三化学方程式必背集锦(名师总结精华,事半功倍效果)(绝对精品文档,价值很高,值得下载打印背诵)一、化合反应1.镁在空气中燃烧:2Mg + O22MgO2.铁在氧气中燃烧:3Fe + 2O2Fe3O4 3.铝在空气中燃烧:4Al + 3O22Al2O34.氢气在空气中燃烧:2H2 + O22H2O 5.红磷在空气中燃烧:4P + 5O22P2O56.硫粉在空气中燃烧:S + O2SO27.碳在氧气中充分燃烧:C + O2CO28.碳在氧气中不充分燃烧:2C + O22CO9.汞与氧气加热:2Hg + O22HgO10.铜在空气中加热:2Cu + O22CuO 11.二氧化碳通过炽热炭层:C + CO22CO12.生石灰溶于水:CaO + H2O Ca(OH)2 13.一氧化碳在氧气中燃烧:2CO + O22CO214.二氧化碳和水反应:CO2 + H2O H2CO3 15.二氧化硫溶于水:SO2 + H2O H2SO3 16.三氧化硫溶于水:SO3 + H2O H2SO4二、分解反应1.实验室用双氧水制氧气:2H2O22H2O + O2↑2.加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑3.加热氯酸钾和二氧化锰:2KClO32KCl + 3O2↑4.水在直流电的作用下分解:2H2O2H2↑+O2↑5.氧化汞强热:2HgO2Hg + O2↑6.碳酸不稳定而分解:H2CO3H2O + CO2↑7.高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑8.碳酸氢钙分解:Ca(HCO3)2CaCO3↓+ CO2↑+ H2O9. 碱式碳酸铜(铜绿主要成分):Cu2(OH)2CO32CuO + CO2↑+ H2O三、置换反应1.镁和稀盐酸:Mg + 2HCl MgCl2 + H2↑2.镁和稀硫酸:Mg + H2SO4MgSO4+ H2↑3.铝和稀盐酸:2Al + 6HCl2AlCl3 + 3H2↑4.铝和稀硫酸:2Al + 3H2SO4Al2(SO4)3 + 3H2↑5.锌和稀盐酸:Zn + 2HCl ZnCl2+ H2↑6.锌和稀硫酸:Zn + H2SO4ZnSO4 + H2↑7.铁和稀盐酸:Fe + 2HCl FeCl2+ H2↑8.铁和稀硫酸:Fe + H2SO4FeSO4 + H2↑9.铁和硫酸铜溶液:Fe + CuSO4FeSO4+Cu10.铁和氯化铜溶液:Fe + CuCl2FeCl2 + Cu 11.铝和硫酸铜溶液:2Al + 3CuSO4Al2(SO4)3 + 3Cu12.锌和硫酸铜溶液:Zn + CuSO4ZnSO4 + Cu 13.铜和硝酸银溶液:Cu + 2AgNO3Cu(NO3)2 + 2Ag 14.铁和硝酸银溶液:Fe + 2AgNO3Fe(NO3)2 + 2Ag 15.锌和硝酸银溶液:Zn + 2AgNO3Zn(NO3)2 + 2Ag 16.铝和硝酸银溶液:Al + 3AgNO3Al(NO3)3 + 3Ag 17.氢气还原氧化铜:H2 + CuO Cu + H2O 18.水煤气制法:C + H2O高温CO + H219.木炭还原氧化铜:C + 2CuO高温2Cu + CO2↑20.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe+3CO2↑21.焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe+2CO2↑22.烤蓝:3Fe + 4H2O高温Fe3O4 + 4H2四、复分解反应1.碱性氧化物(金属氧化物)+ 酸→盐 + 水(1)氧化铁和稀盐酸:Fe2O3 + 6HCl2FeCl3 + 3H2O(2)氧化铁和稀硫酸:Fe2O3 + 3H2SO4Fe2(SO4)3 + 3H2O(3)氧化铝和稀盐酸:Al2O3 + 6HCl2AlCl3 + 3H2O(4)氧化铝和稀硫酸:Al2O3 + 3H2SO4Al2(SO4)3 + 3H2O(5)氧化铜和稀盐酸:CuO + 2HCl CuCl2 + H2O(6)氧化铜和稀硫酸:CuO + H2SO4CuSO4 + H2O(7)氧化镁和稀盐酸:MgO + 2HCl MgCl2 + H2O(8)氧化镁和稀硫酸:MgO + H2SO4MgSO4 + H2O(9)氧化钙和稀盐酸:CaO + 2HCl CaCl2 + H2O(10)氧化钙和稀硫酸:CaO + H2SO4CaSO4 + H2O(11)氧化亚铁和稀盐酸:FeO + 2HCl FeCl2 + H2O(12)氧化亚铁和稀硫酸:FeO + H2SO4FeSO4 + H2O2.酸 + 碱→盐 + 水(1)稀盐酸和烧碱:HCl + NaOH NaCl + H2O(2)稀硫酸和烧碱:H2SO4 + 2NaOH Na2SO4 + 2H2O(3)稀盐酸和氢氧化钾:HCl + KOH KCl + H2O(4)稀硫酸和氢氧化钾:H2SO4 + 2KOH K2SO4 + 2H2O(5)稀盐酸和氢氧化铜:2HCl + Cu(OH)2CuCl2 + 2H2O(6)稀硫酸和氢氧化铜:H2SO4 + Cu(OH)2 CuSO4 + 2H2O(7)稀盐酸和氢氧化铁:3HCl + Fe(OH)3FeCl3 + 3H2O(8)稀硫酸和氢氧化铁:3H2SO4 + 2Fe(OH)3Fe2(SO4)3 + 6H2O(9)稀盐酸和氢氧化亚铁:2HCl + Fe(OH)2FeCl2 + 2H2O(10)稀硫酸和氢氧化亚铁:H2SO4 + Fe(OH)2FeSO4 + 2H2O(11)稀盐酸和氢氧化钙:2HCl + Ca(OH)2CaCl2 + 2H2O(12)稀硫酸和氢氧化钙:H2SO4 + Ca(OH)2CaSO4 + 2H2O(13)稀盐酸和氢氧化钙:2HCl + Ba(OH)2BaCl2 + 2H2O(14)稀硫酸和氢氧化钙:H2SO4 + Ba(OH)2BaSO4↓ + 2H2O(15)氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3AlCl3 + 3H2O(16)稀硫酸和氢氧化铝:3H2SO4 + 2Al(OH)3Al2(SO4)3 + 6H2O2.酸 + 盐→另一种酸 + 另一种盐(1)稀盐酸与大理石:CaCO3 + 2HCl CaCl2 + CO2↑+ H2O(2)稀盐酸与碳酸钠(纯碱): Na2CO3 + 2HCl2NaCl+ CO2↑+ H2O(3)稀硫酸与碳酸钠(纯碱): Na2CO3 + H2SO4Na2SO4 + CO2↑+ H2O(4)稀盐酸与碳酸氢钠(小苏打):NaHCO3 + HCl NaCl+ CO2↑ + H2O(5)稀硫酸与碳酸氢钠(小苏打): 2NaHCO3 + H2SO4Na2SO4+ 2CO2↑+ 2H2O (6)稀硫酸和碳酸钡:BaCO3 + H2SO4BaSO4 + CO2↑+ H2O(7)稀盐酸和硝酸银溶液:HCl + AgNO3Ag Cl↓ + HNO3(8)稀硫酸和氯化钡溶液:H2SO4 + BaCl2BaSO4↓ + 2HCl4.(可溶性)碱 +(可溶性)盐→另一种碱 + 另一种盐(1)氢氧化钠溶液与硫酸铜溶液:2NaOH + CuSO4Cu(OH)2↓ + Na2SO4(2)氢氧化钠溶液与氯化铜溶液:2NaOH + CuCl2Cu(OH)2↓ + 2NaCl(3)氢氧化钠溶液与氯化铁溶液:3NaOH + FeCl3Fe(OH)3↓ + 3NaCl(4)氢氧化钠溶液与氯化亚铁溶液:2NaOH + FeCl2Fe(OH)2↓+ 2NaCl(5)氢氧化钠溶液与氯化镁溶液:2NaOH + MgCl2Mg(OH)2↓ + 2NaCl(6)氢氧化钙溶液与碳酸钠溶液:Ca(OH)2 + Na2CO3CaCO3↓ + 2NaOH(7)氢氧化钡溶液与碳酸钠溶液:Ba(OH)2 + Na2CO3BaCO3↓ + 2NaOH(8)氢氧化钡溶液与硫酸钠溶液:Ba(OH)2 + Na2SO4BaSO4↓ + 2NaOH(9)氢氧化钙溶液与氯化铵溶液:Ca(OH)2 + 2NH4Cl CaCl2 + 2NH3↑ + 2H2O5.(可溶性)盐 +(可溶性)盐→新盐 + 新盐(1)氯化钠溶液和硝酸银溶液:NaCl + AgNO3Ag Cl↓ + NaNO3(2)硫酸钠溶液和氯化钡溶液:Na2SO4 + BaCl2BaSO4↓ + 2NaCl(3)碳酸钠溶液和氯化钡溶液:Na2CO3 + BaCl2BaCO3↓ + 2NaCl(4)碳酸钠溶液和氯化钙溶液:Na2C O3 + CaCl2CaCO3↓ + 2NaCl(5)碳酸钠溶液和硝酸钡溶液:Na2CO3 + Ba(NO3)2BaCO3↓ + 2NaNO3(6)碳酸钠溶液和硝酸钙溶液:Na2CO3 + Ca(NO3)2CaCO3↓ + 2NaNO3(7)碳酸钾溶液和氯化钡溶液:K2CO3 + BaCl2BaCO3↓ + 2KCl(8)碳酸钾溶液和氯化钙溶液:K2CO3 + CaCl2CaCO3↓ + 2KCl(9)碳酸钾溶液和硝酸钡溶液:K2CO3 + Ba(NO3)2BaCO3↓ + 2KNO3(10)碳酸钾溶液和硝酸钙溶液:K2CO3 + Ca(NO3)2CaCO3↓ + 2KNO3四、其他反应1.甲烷燃烧:CH4 + 2O2CO2 + 2H2O 2.酒精燃烧:C2H5OH + 3O22CO2 + 3H2O 3.一氧化碳还原氧化铜:CO + CuO Cu + CO24.一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO2 5.一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO26.二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2CaCO3↓+ H2O7.苛性钠(氢氧化钠)暴露在空气中变质(除去二氧化碳):2NaOH + CO2Na2CO3 + H2O8.烧碱吸收二氧化硫气体:2NaOH + SO2Na2SO3 + H2O9.火碱吸收三氧化硫气体:2NaOH + SO3Na2SO4 + H2O10.消石灰(熟石灰)吸收二氧化硫:Ca(OH)2 + SO2CaSO3↓ + H2O11.氢氧化钙固体与氯化铵固体共热制氨气:Ca(OH)2 + 2NH4Cl CaCl2 + 2NH3↑ + 2H2O12.6CO2 + 6H2O 酶==C6H12O6 + 6O213.汽车尾气排放(处理)2CO+2NO 催化剂======N2+2CO22017年重庆中考化学推断题知识储备。