乳腺癌术前新辅助治疗
- 格式:ppt
- 大小:4.01 MB
- 文档页数:47

乳腺癌新辅助治疗的疗效评估乳腺癌是一种常见的女性恶性肿瘤,其治疗方法多样化,其中新辅助治疗是近年来引起广泛关注的一种治疗手段。
新辅助治疗是在手术前或手术后给予患者其他治疗,目的是缩小肿瘤的体积,提升手术效果及生存率。
本文将对乳腺癌新辅助治疗的疗效评估进行探讨。
一、乳腺癌新辅助治疗的基本原理乳腺癌新辅助治疗的基本原理是在进行手术治疗之前或之后,通过给予患者各种治疗手段,如化疗、内分泌治疗、放疗等,来缩小肿瘤的体积,减轻手术难度,提高治疗效果。
新辅助治疗的目的是通过全面治疗,减少转移风险,提高患者的生存率。
二、乳腺癌新辅助治疗的类型乳腺癌新辅助治疗的类型主要分为化疗、内分泌治疗和放疗三种。
1. 化疗:化疗是通过使用抗肿瘤药物来杀灭肿瘤细胞或抑制其生长和扩散。
化疗可以在手术前或手术后进行,常用的化疗药物包括环磷酰胺、阿霉素等。
化疗的优点是可以全身治疗,对于整个肿瘤有较好的杀伤效果。
2. 内分泌治疗:内分泌治疗是通过使用药物干预患者的内分泌系统,抑制肿瘤生长。
乳腺癌中约有70%的患者对激素具有依赖性,内分泌治疗是通过干扰激素对肿瘤的作用来达到治疗目的。
常用的内分泌治疗药物有雌激素受体调节剂和雄激素受体拮抗剂等。
3. 放疗:放疗是通过使用高能射线来杀死肿瘤细胞或抑制其生长和扩散。
放疗在乳腺癌的综合治疗中起到重要的作用,可以杀死手术后残留的肿瘤细胞,并提高治疗效果。
三、乳腺癌新辅助治疗的疗效评估指标对于乳腺癌新辅助治疗的疗效评估,主要使用的指标有病理学完全缓解(pCR,pathologic complete response)率和生存率。
pCR是指接受新辅助治疗后,手术切除标本中没有残留肿瘤细胞的情况,通常与患者的预后相关,pCR率越高,预后越好。
生存率则是评估患者的存活情况,包括无病生存期(DFS,disease-free survival)和总体生存期(OS,overall survival)。
四、乳腺癌新辅助治疗的临床应用乳腺癌新辅助治疗的临床应用主要针对一些具有较大肿瘤体积、晚期或高危因素的患者。

乳腺癌新辅助化疗耐药性研究进展1. 乳腺癌新辅助化疗简介乳腺癌是全球女性最常见的恶性肿瘤之一,新辅助化疗作为乳腺癌综合治疗的重要组成部分,已经在临床实践中取得了显著的疗效。
新辅助化疗是指在手术之前对乳腺癌患者进行的系统性化疗,旨在缩小肿瘤体积、降低病理分期、评估治疗效果以及指导手术方案的选择。
新辅助化疗的主要目的是通过药物的作用,使癌细胞的生长和扩散受到抑制,从而提高手术切除的成功率和减少复发风险。
随着乳腺癌研究的不断深入,新辅助化疗的药物选择和治疗策略也在不断优化。
常用的新辅助化疗药物包括蒽环类、紫杉醇类、多柔比星类、环磷酰胺等。
这些药物可以通过不同的作用机制,如阻断DNA合成、干扰微管功能、诱导细胞凋亡等,抑制癌细胞的生长和扩散。
针对新辅助化疗耐药性的研究也取得了重要进展,耐药性是指肿瘤细胞在接受化疗药物作用后,出现对药物的抵抗现象,导致化疗疗效降低甚至失效。
新辅助化疗耐药性的产生可能与多种因素有关,如基因突变、信号通路异常、表皮生长因子受体(EGFR)变异等。
研究乳腺癌新辅助化疗耐药性的机制和靶点对于提高治疗效果具有重要意义。
针对新辅助化疗耐药性的研究主要集中在以下几个方面:一是寻找新的耐药靶点,如开发针对耐药性肿瘤的新药物;二是研究耐药性肿瘤的基因表达谱,以便为个体化治疗提供依据;三是探索联合用药策略,以提高化疗药物的疗效和降低耐药性的发生率;四是研究免疫治疗在乳腺癌新辅助化疗耐药性中的作用,以期为患者带来更多的治疗选择。
1.1 定义和作用乳腺癌新辅助化疗耐药性研究进展主要关注在乳腺癌治疗过程中,针对新辅助化疗药物的耐药性进行研究。
新辅助化疗是指在手术切除肿瘤之前,使用药物对肿瘤进行治疗,以缩小肿瘤体积、减轻手术难度、提高手术切除率以及评估患者预后等目的。
耐药性是指肿瘤细胞对化疗药物的抗药性,即化疗药物无法有效杀灭或抑制肿瘤细胞生长的能力。
乳腺癌新辅助化疗耐药性的研究对于提高治疗效果、延长患者生存期具有重要意义。

【摘要】乳腺癌新辅助化疗是在乳腺癌术前进行化学药物治疗,能够缩小肿瘤范围、提升手术保乳率、延长患者生存时间、提高患者生活质量,近些来得到广泛研究。
乳腺癌新辅助化疗常用方案有:蒽环类联合紫杉类,环磷酰胺联合化疗(CMF、CAF、CEF、AC),曲妥珠单抗单用或联用蒽环、紫杉类,重组人血管内皮抑素联合紫杉醇、表阿霉素。
不同方案的作用机制、不良反应及注意事项都不同,对于不同的乳腺癌患者,应根据自身基本情况,选择其适合的新辅助化疗方案及疗程。
如对于HER—2阳性的患者,在传统方案的基础上同时联用曲妥珠单抗会取得更为显著的疗效.乳腺癌患者新辅助化疗的药物方案有对传统化疗方案的借鉴,也有自身的创新。
【关键词】乳腺癌新辅助化疗蒽环类紫杉类环磷酰胺曲妥珠单抗重组人血管内皮抑素【Abstract】Neoadjuvant chemotherapy, the chemical drug treatment that is used before breast-conserving surgery,which can reduce the scope of the tumor, improve the success rate of the operation,prolong the survival time of the patients,enhance the quality of life has been extensively studied. The common scheme include: anthracycline with paclitaxel, CMF、CAF、CEF、AC, trastuzumab used independently or with anthracycline and paclitaxel, rh—Endostatin with paclitaxel and epirubicin。

乳腺癌的新辅助治疗方案与效果分析乳腺癌是女性最常见的恶性肿瘤之一,而新辅助治疗方案已经成为乳腺癌治疗中重要的一环。
新辅助治疗指在手术前进行化疗、内分泌治疗或靶向治疗,旨在缩小肿瘤体积、改善手术情况以及提高生存率。
本文将对乳腺癌的新辅助治疗方案进行介绍,并分析其效果。
一、化疗新辅助治疗方案化疗是一种广泛应用于乳腺癌治疗的方法,通过使用化学药物杀灭或抑制癌细胞的增殖,从而达到治疗的目的。
在新辅助治疗中,化疗被用于在手术前减小肿瘤尺寸,提高手术切除的可行性。
同时,化疗还能够清除肿瘤细胞,在手术后减低复发的风险。
化疗的方案根据乳腺癌的分子亚型和病理特征来制定,常用的化疗药物包括顺铂、环磷酰胺、氟尿嘧啶等。
同时,靶向治疗也被结合到化疗中,如使用HER2阳性乳腺癌患者的曲妥珠单抗。
这种新的辅助治疗方案在治疗乳腺癌中取得了显著的效果。
二、内分泌治疗新辅助治疗方案内分泌治疗是一种适用于激素受体阳性乳腺癌的新辅助治疗方案。
乳腺癌中,约70%的病例属于激素受体阳性,这意味着肿瘤细胞对雌激素或孕激素具有依赖性。
内分泌治疗通过抑制或阻断雌激素或孕激素对癌细胞的刺激,达到治疗的目的。
内分泌治疗常使用的药物包括七氟酮、环丙烯酸铂等。
这些药物通过阻断雌激素受体的作用,抑制肿瘤细胞的增殖和生存,从而达到治疗效果。
三、靶向治疗新辅助治疗方案靶向治疗是一种针对乳腺癌细胞的特定靶点进行的治疗方法。
目前,HER2阳性乳腺癌已经成为乳腺癌治疗中的一个关键亚型。
HER2是乳腺癌细胞表面的一种受体,过表达HER2受体的乳腺癌患者在预后上通常具有较差的情况。
针对HER2阳性乳腺癌,目前已经开发出一系列靶向药物,如曲妥珠单抗。
这些药物能够选择性地作用于HER2受体,抑制乳腺癌细胞的生长和扩散。
靶向治疗在新辅助治疗中的应用,为乳腺癌患者提供了更加准确、有效的治疗策略。
四、新辅助治疗方案的效果分析乳腺癌的新辅助治疗方案在临床实践中展现出了积极的效果。

应用术前新辅助化疗成功治疗局部晚期乳腺癌1例患者,女,44岁,因左侧乳腺肿物三年,伴破溃二月于2010年3月22日入院。
该患于三年前无意中发现左侧乳腺内有一肿物,大小如花生米,无不适,未在意。
近一年来肿物渐增大。
二月前肿物破溃,伴疼痛,于2010年1月27日在我院行病理检查,示:左侧乳腺浸润性导管癌伴出血坏死。
未行治疗。
今为求治来我院,门诊以“左侧乳腺癌破溃合并感染”收入院。
病来无胸痛咳嗽,消瘦,体重减轻15kg,乏力。
饮食正常,二便正常。
既往健康。
查体:左侧乳腺皮肤红肿,呈桔皮样变,无酒窝征,于外上象限可见一菜花状肿物,直径12.0cm,突出皮肤,高3.0cm,表面有污秽样焦痂状物覆盖,有浑浊液体渗出,味恶臭,触之出血。
左侧乳腺腺体质硬,压痛(+),活动度差,与胸壁无粘连。
左侧乳头无内陷,无溢液。
右侧乳腺未见异常。
左侧腋窝可触及数枚肿大淋巴结,互相粘连,活动度好,最大者为2.0cmX1.5cm,质硬,压痛(—)。
右侧腋窝未触及肿大淋巴结。
辅助检查:血细胞分析:WBC:11.0×109/L,RBC:4.55×1012/L,HGB:126g/L,PLT:394×109/L;尿液分析:葡萄糖:3+;血糖:15.31mmol/L;乳腺超声:左侧乳腺未见正常腺体回声,可见实质不均质团块,内可见无回声暗区,边界不清,无明显包膜,内可见血流信号,左侧腋窝可见数枚实质不均质淋巴结,最大者为1.8cm×1.3cm,肝脏未见异常。
胸部X光片:未见异常。
病理报告:左侧乳腺浸润性导管癌,伴出血坏死。
入院诊断:1、左侧乳腺浸润性导管癌破溃合并感染(Ⅲ期:T4b N2a M o);2、糖尿病。
入院后首先癌肿破溃处以3%过氧化氢液冲洗并湿敷,清除坏死组织,1次/日,联合应用抗生素,控制感染;其次嘱其糖尿病饮食,应用胰岛素降低血糖;第三,按CTF方案行术前新辅助化疗,具体为:CTX(环磷酰胺)500mg/m2,THP-ADM(吡柔比星)40mg/m2,5-Fu(5-氟尿嘧啶)500mg/m2,CTX、5-Fu在第1、2、3、4周、THP-ADM在第1、3周给药。

乳腺癌的新辅助治疗方法与疗效评价乳腺癌是一种常见的恶性肿瘤,常见于女性。
为了提高乳腺癌的治疗效果和生存率,研究人员一直在努力寻找新的辅助治疗方法。
本文将重点介绍乳腺癌的新辅助治疗方法,并对其疗效进行评价。
一、乳腺癌的新辅助治疗方法1. 靶向药物治疗靶向药物是一种能够针对癌细胞特定的分子靶点进行治疗的药物。
在乳腺癌的辅助治疗中,靶向药物被广泛应用。
其中,最常用的是人表皮生长因子受体2(HER2)靶向药物,如曲妥珠单抗(trastuzumab)。
这类药物通过抑制HER2信号通路,阻断乳腺癌细胞的生长和传播,从而提高治疗效果。
2. 化疗药物联合治疗化疗药物联合治疗是指将多种化疗药物同时应用,以增加疗效和降低药物耐药性。
如通过将多西他赛(docetaxel)和顺铂(cisplatin)等药物联合使用,可以改善乳腺癌患者的预后。
此外,新辅助化疗的方案可以根据乳腺癌的分子亚型来进行个体化调整,进一步提高治疗效果。
3. 免疫治疗免疫治疗是通过刺激患者自身免疫系统来对抗肿瘤。
在乳腺癌的新辅助治疗中,免疫检查点抑制剂,如PD-1抑制剂和CTLA-4抑制剂被广泛研究和使用。
这些药物能够激活患者的免疫系统,增强对癌细胞的识别和杀伤能力,从而达到治疗乳腺癌的目的。
二、辅助治疗方法的疗效评价1. 病理学疗效评价病理学疗效评价是通过对手术切除标本进行组织学检查,评估治疗前后乳腺癌病灶的大小和病灶内细胞学的变化。
常用的评估标准有Miller-Payne分级、Chevallier分类以及Pierce分类等。
这些评估指标可以客观反映辅助治疗的疗效,指导后续的治疗策略。
2. 影像学疗效评价影像学疗效评价是通过影像学方法(如CT、MRI等)检查肿瘤的缩小程度、边界清晰度等来评估治疗的效果。
常用的评估标准有RECIST准则、WHO准则等。
这些评估指标可以直观地反映辅助治疗的疗效,帮助医生调整治疗方案。
3. 生存率评价生存率评价是通过观察患者的生存情况来评估治疗的效果。

乳腺癌患者的术前辅助治疗策略随着科技的不断发展和医学知识的积累,乳腺癌的治疗手段也得到了极大的改进。
其中,术前辅助治疗策略在乳腺癌患者中得到越来越广泛的应用。
本文将对乳腺癌患者术前辅助治疗的策略进行探讨,包括化学治疗、内分泌治疗、靶向治疗等方面。
一. 化学治疗化学治疗是针对肿瘤细胞进行药物攻击,并通过干扰或阻断其生长及扩散来达到抑制肿瘤发展的目的。
在术前辅助治疗中,化学治疗可有效缩小肿瘤体积、控制局部复发和远处转移风险,并提高手术切除率。
1. 新辅助雌激素受体(ER)阳性乳腺癌对于ER阳性乳腺癌患者,内分泌治疗通常是首选。
但在某些情况下,如肿瘤特别大或存在淋巴结转移,化学治疗可能成为首选。
常用的化疗方案包括AC(阿霉素和环磷酰胺)或TAC(象阿霉素、环磷酰胺和多西他赛)等。
2. 新辅助HER2阳性乳腺癌HER2阳性乳腺癌是一种通过高表达HER2基因而导致增殖信号通路过度激活的亚型。
针对这类患者,靶向治疗是必不可少的一部分。
常用的方案包括Trastuzumab、Pertuzumab与化学药物联合应用,可以显著提高患者术前治疗后的预后效果。
二. 内分泌治疗内分泌治疗主要针对ER和/或PR阳性的乳腺癌,通过抑制雌激素对肿瘤细胞的刺激,从而减少肿瘤细胞增殖并改善预后。
内分泌治疗适用于既往未接受手术或接受了手术但存在高复发风险的患者。
1. 根据绝经状态的不同,分为:- 前绝经期患者:对他莫昔芬(Tamoxifen)或阿那曲唑(Anastrozole)等靛染剂进行治疗;- 末次月经小于5年的后绝经期患者: 推荐使用Aromatase Inhibitors (AI),如阿那曲唑、依姆若明等;- 末次月经大于5年的后绝经期患者: 对他莫昔芬进行治疗。
2. 内分泌治疗之外新一代雌激素受体调节剂德格列吡啶(Fulvestrant)及CDK4/6抑制剂帕罗西克(Palbociclib)也作为合理选择。
三. 靶向治疗靶向治疗是指通过特异性药物对癌细胞生长和转移中关键信号通路进行干预,实现精准攻击肿瘤。

乳腺癌新辅助化疗进展林伟乳腺癌是女性最常见的恶性肿瘤之一,它是一种全身性疾病,部分乳腺癌在病变的早期即可能发生远处转移,因此仅予局部手术治疗的乳腺癌患者的远期生存率较低。
现今通过采用术前新辅助化疗使乳腺癌手术的适应证越来越宽,全身性治疗的手段越来越被重视。
1 新辅助化疗的定义新辅助化疗是指对非转移性的肿瘤在应用局部治疗前进行系统性的辅助性的细胞毒性药物治疗,亦称术前化疗、诱导化疗。
2 新辅助化疗的意义据美国乳腺与肠道外科辅助治疗研究组(NSABP)、意大利 Milan 及法国等许多随机试验报道[1—5],新辅助化疗的适应证为:(1) 局部晚期乳腺癌(ⅡB、ⅢA、ⅢB和ⅢC 期)和炎性乳腺癌;(2) 可手术乳腺癌,患者有保乳意愿但不适合保乳手术者。
其在临床上有一定的应用价值和意义。
2。
1 缩小肿瘤大小,降低临床分期1990 年,Bonadonna 等[6]首先进行了相关报道,作者搜集了肿瘤直径> 3 cm 的 165 例可手术乳腺癌患者,将其随机分为 5 组,分别给予 CMF* 3(环磷酰胺600 mg·m- 2、甲氨蝶呤 40 mg·m- 2及 5-氟尿嘧啶600 mg·m- 2)、CMF* 4、FAC* 3(5-氟尿嘧啶600 mg·m- 2、阿霉素 60 mg·m- 2及环磷酰胺 600 mg·m- 2)、FAC* 4、FEC* 3(5—氟尿嘧啶 600 mg·m - 2、表柔比星60 mg·m- 2及环磷酰胺 600 mg·m- 2)方案的新辅助化疗,结果有 97。
5% 的患者化疗后肿瘤缩小,其中81%的肿瘤直径< 3 cm,可接受保乳治疗.Gianni等[7]对手术前的化疗药物的选择也有一系列研究,作者总结了1 355 例可手术乳腺癌患者,将其随机分为3组:A 组,术前化疗方案为 CMF 序贯 A(阿霉素 75 mg·m- 2);B 组,术前化疗方案为 CMF 序贯 AC (阿霉素60 mg·m- 2和紫杉醇 200 mg·m- 2);C 组,术后给予CMF 序贯 AC 方案化疗.结果显示(随访 76 个月),B组无复发生存率明显高于 A 组,B 组与 C 组的无复发生存率比较差异无统计学意义,A 组和 B 组保乳率明显高于 C 组(P <0. 001)。

2021版CSCO乳腺癌指南:HER2+早期乳腺癌新辅助治疗更新要点解读(全文)2021版CSCO乳腺癌指南关于HER2+早期乳腺癌术前新辅助治疗的更新聚焦于三方面:新辅助治疗适应证、新辅助治疗Ⅰ级推荐、新辅助治疗后辅助治疗选择。
新辅助治疗适应证:将临床分期与分子分型相结合作为依据2021版CSCO指南仍然强调,术前新辅助治疗的适应证应结合肿瘤分子分型、临床分期及患者意愿个体化确定。
这一理念也是CSCO于2018年率先在国内提出的,即对于HER2+乳腺癌的患者,若肿瘤≥2 cm(T>2)或有淋巴结转移(N≥1),推荐给予新辅助治疗。
图1 2021版CSCO指南关于术前新辅助治疗的适应证对于美国国家综合癌症网络(NCCN)指南,2018版仍然仅依据临床分期确定新辅助治疗适应证;2020版和2021版则指出,对于HER2+、三阴性乳腺癌,若T≥2或N≥1,推荐给予新辅助治疗。
可见,CSCO指南提出的分子分型与临床分期相结合的理念比NCCN指南早了2年。
图2 2018版和2020版NCCN指南推荐然而,2021版美国临床肿瘤学会(ASCO)指南指出,对于T1a和T1b的患者,不应常规给予新辅助治疗。
这意味着T1c的患者可予新辅助治疗。
鉴于“对T1c患者予新辅助治疗”这一理念尚未经过临床研究和实践验证,CSCO乳腺癌指南仍采用目前认为的最先进、最可行选择标准,即对于HER2+、T≥2或N≥1的患者给予新辅助治疗。
图3 2021版CSCO指南推荐新辅助治疗Ⅰ级推荐:TCbHP和THP2021版CSCO乳腺癌指南指出,对于HER2+乳腺癌新辅助治疗策略,TCbHP和THP为Ⅰ级推荐,而大家常用的AC-THP为Ⅱ级推荐;对于HER2+乳腺癌辅助治疗,Ⅰ级推荐AC-THP和TCbHP(T:紫杉类;A:蒽环类;C:环磷酰胺;Cb:卡铂:H:曲妥珠单抗;P:帕妥珠单抗)。
图4 2021版CSCO乳腺癌指南推荐对于NCCN指南,2020版对HER2+乳腺癌新辅助/辅助治疗方案推荐了8种方案;然而,2021版更加强调去蒽环化,推荐首选TCHP,而次选AC-THP,但仍是对新辅助和辅助治疗给予统一推荐。

乳腺癌新辅助化疗的理解与遵循原则新辅助化疗,又称术前化疗、诱导化疗、初始化疗等,是指在手术前给予全身的化疗药物治疗。
新辅助化疗并不是一种新的治疗方法,而是指在全身治疗的时间点上与辅助化疗不同[1]。
乳腺癌的新辅助化疗始于20世纪70年代。
随着辅助化疗在乳腺癌治疗中地位的确立,新辅助化疗就开始用于不可手术的局部晚期乳腺癌,通过化疗缩小肿瘤,从而使不可手术的患者获得手术治疗的机会,大大提高了这些患者的生活质量,新辅助化疗在这部分患者中的应用获得了广泛的认同[2]。
之后新辅助化疗在临床试验中也被证实可使肿瘤缩小从而达到保乳目的。
我院从80年代开始在不可手术的局部晚期乳腺癌中应用新辅助化疗,取得了很好的疗效。
在不可手术的局部晚期乳腺癌以及提高保乳率方面的成功,再加上有动物试验报道似乎新辅助化疗有更好的全身治疗作用,于是,逐渐有人提出是否可以将新辅助化疗的适应证进一步扩大到可手术的早期乳腺癌[1]?为了在循证医学水平证实这个问题,从80年代中期开始,陆续进行了一系列的前瞻性随机对照研究,其中规模最大的试验为NSABPB-18和B-27试验[4]。
NSABPB-18试验的研究目标有3个:①多柔比星+环磷酰胺(do某orubicin+cyclophophamide,AC)术前新辅助化疗与术后辅助化疗相比,能否提高患者的无病生存率[3]随访8.5年的研究结果:新辅助化疗方案在AC的基础上加用T能使患者的pCR[4]率从13%提高到26%,但并不能改善患者的DFS和OS对11项临床试验共3946对于新辅助化疗的优点和缺点目前还有很多争议,国际上已经基本达成共识的优点主要是能缩小肿瘤便于手术,提高不可手术局部晚期乳腺癌的切除率,增加部分肿瘤体积较大患者的保乳成功率;缺点则包括延长体内带瘤时间,无效者延误了手术时机,取材有限而造成的诊断误差,预后较好的肿瘤可能造成过度治疗,而且影响预后判断和方案的选择。
新辅助化疗是乳腺癌治疗领域研究的热点和焦点,每次会议只要涉及新辅助化疗,都能引起激烈的讨论。
TAC与TEC方案新辅助化疗治疗乳腺癌的疗效对比观察与评估乳腺癌是女性中最常见的恶性肿瘤之一,也是导致女性死亡的主要原因之一。
为了提高乳腺癌患者的治疗效果,不断有新的治疗方案被提出和应用。
本文将重点对TAC与TEC两种新辅助化疗方案进行疗效对比观察和评估。
TAC方案是指在乳腺癌手术前进行的新辅助化疗,其包括了多西他赛(Taxotere)、阿霉素(Adriamycin)和环磷酰胺(Cyclophosphamide)三种药物的组合应用。
这三种药物具有不同的作用机制,能够针对不同的乳腺癌亚型展现出良好的治疗效果。
TAC方案的辅助化疗时间一般为4-6个疗程,每个疗程间隔3周,有助于在手术前控制肿瘤的生长,减小手术操作难度,提高整体治疗效果。
TEC方案也是一种新辅助化疗方案,其包括了多西他赛(Taxotere)、表阿霉素(Epirubicin)和环磷酰胺(Cyclophosphamide)三种药物的组合应用。
与TAC方案相比,TEC方案将阿霉素替代为表阿霉素,而表阿霉素具有更低的心脏毒性,因此在一定程度上减少了患者的副作用风险。
为了对比TAC与TEC方案的疗效,我们进行了一项对比观察与评估的研究。
研究选取了100名确诊为乳腺癌的患者,其中50名接受了TAC方案的治疗,另外50名接受了TEC方案的治疗。
两组患者的基本临床特征相似,包括年龄、病程、肿瘤大小等因素。
观察和评估的结果显示,经过TAC方案治疗的患者中,有40名(80%)患者的肿瘤缩小或消失,术前辅助治疗的效果明显。
而经过TEC方案治疗的患者中,有35名(70%)患者的肿瘤缩小或消失。
两组患者在疗效方面差距不明显。
值得一提的是,在观察期间,TAC方案组的患者出现了更多的副作用,如恶心、呕吐、脱发等,而TEC方案组的患者在副作用上相对少一些。
这可能与阿霉素对心脏的毒性有关。
因此,在选择治疗方案时,医生需要综合考虑患者的具体情况和耐受性,以及治疗的效果。
乳腺癌新辅助化疗方案引言乳腺癌是女性最常见的恶性肿瘤之一,临床上有不同分期的乳腺癌患者需要接受辅助化疗,以提高手术切除的效果和预后。
随着医学科技的进步和不断的临床研究,乳腺癌新辅助化疗方案不断涌现,为患者提供更好的治疗选择。
本文将介绍一种新的乳腺癌辅助化疗方案,并探讨其疗效和临床应用。
新辅助化疗简介辅助化疗,也称为新辅助化疗,是指在乳腺癌手术前,将化疗药物应用于患者体内,以缩小肿瘤体积、减少淋巴结转移、提高手术切除的效果和预后。
新辅助化疗可以使原本不能行手术切除的乳腺癌患者,通过药物治疗后,达到了手术条件,提高了肿瘤的切除率。
此外,新辅助化疗还可以评估肿瘤对药物的敏感性,指导后续药物治疗的选择。
乳腺癌新辅助化疗方案的特点乳腺癌新辅助化疗方案有以下几个突出的特点:综合治疗策略新辅助化疗方案将化疗和手术相结合,以综合治疗策略管理乳腺癌患者。
通过在手术前使用化疗药物,可以缩小肿瘤体积,控制肿瘤的扩散,从而提高手术切除的效果。
个体化治疗根据患者的具体情况和病理特点,乳腺癌新辅助化疗方案可以进行个体化治疗。
通过分析患者的基因表达谱、分子标志物等,可以选择最适合患者的化疗药物和治疗方案,提高疗效和治疗成功率。
多药联合治疗乳腺癌新辅助化疗方案通常采用多药联合治疗,以增强疗效。
常用的化疗药物包括阿霉素、环磷酰胺、多柔比星等。
通过不同药物的联合使用,可以减少肿瘤对单一药物的耐药性,提高化疗的效果。
化疗与靶向治疗的结合近年来,乳腺癌新辅助化疗方案中出现了化疗与靶向治疗的结合。
靶向治疗是指通过特异性靶向作用于乳腺癌细胞上的分子靶点,抑制癌细胞的增殖和转移。
与传统化疗相比,靶向治疗更加精准,对癌细胞具有更好的选择性。
将化疗和靶向治疗结合应用于乳腺癌新辅助化疗方案中,可以提高疗效,减少副作用。
乳腺癌新辅助化疗方案的疗效和临床应用乳腺癌新辅助化疗方案的疗效和临床应用已得到广泛的研究和应用。
以下将介绍一种较常用的乳腺癌新辅助化疗方案及其疗效和临床应用。
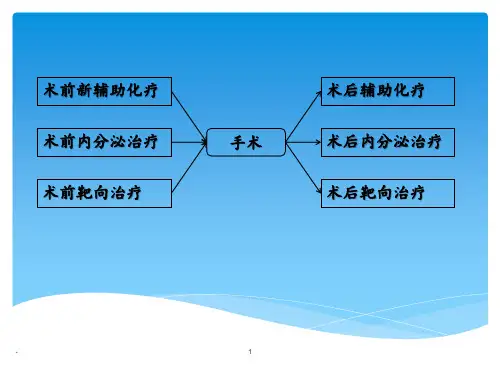
乳腺癌新辅助治疗是局部晚期乳腺癌综合治疗的重要手段之一,包括化疗和内分泌治疗。
PET能够通过早期观察肿瘤代谢变化预测新辅助治疗疗效,有望指导个体化治疗决策的制定。
本文将综述PET多参数在乳腺癌新辅助治疗疗效预测中的应用现状,并结合影像组学和PET特异性分子影像探针等介绍其研究进展。
新辅助治疗(neoadjuvant therapy,NAT)是指术前进行的全身系统性治疗,包括新辅助内分泌治疗(neoadjuvant endocrine therapy,NET)和新辅助化疗(neoadjuvant chemotherapy,NAC),目前已被广泛应用于治疗局部晚期乳腺癌(T3N1-N3M0)和炎性乳腺癌(T4dN0-N3M0)。
NAT可降低临床分期、提高保乳成功率以及早期获得体内相关药敏信息。
对乳腺癌的NAT进行早期疗效评估,尤其是病理完全缓解(pathological complete response,pCR)的判断,将有助于乳腺癌个体化治疗决策的制定。
181.乳腺癌不同分子亚型的18F-FDG的摄取程度:乳腺癌可分为3 种分子亚型:Luminal 型、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阳性和三阴性乳腺癌(triple-negative breast cancer, TNBC)。
研究证实,不同亚型乳腺癌间18F-FDG摄取存在较大差异,TNBC 摄取程度最高,最大标准化摄取值(maximal standardized uptake value,SUV max)为13.9,而Luminal 型仅为8.2。
研究证实,雌激素受体(estrogen receptor,ER)阳性乳腺癌SUV(5.5)较ER阴性低(7.6),TNBC(9.2)较非TNBC具有更高的SUV(5.8)。
2.SUV评估指标:SUV是反映肿瘤代谢情况的半定量指标,包括SUV max、平均SUV (SUV mean)和最大标准峰值(SUV peak)、瘦体重(非脂肪体重)校正SUV(SUL max)、体表面积标准化后SUV(SUVBSA)等。
乳腺癌新辅助化疗的共识与争议背景乳腺癌是一种常见的女性恶性肿瘤,其发生率不断增加。
新辅助化疗是指在手术之前,通过化疗药物控制肿瘤的大小,以便更好的进行手术治疗。
新辅助化疗能够有效控制肿瘤的大小,使得手术更加容易进行,并且能够评估治疗的效果。
共识1.新辅助化疗可以减少手术难度。
通过使用新辅助化疗,可以有效地控制肿瘤的大小,使得手术更加容易进行。
这有助于减轻手术的难度,降低手术风险,减少切口大小,减少切除面积,减少心理压力等。
一些较大的肿瘤或者较小的乳房,经常需要进行切除或者切下,这可能会给患者带来外部美观上的影响和身体上的不适。
使用新辅助化疗来缩小肿瘤大小,可以减轻这些影响,并且保留适当的组织和器官,缩小女性乳房和乳腺的患病率。
2.女性乳腺癌疾病的性质决定了新辅助化疗的必要性。
新辅助化疗是针对乳腺癌这样一种高度恶性的肿瘤,推动化疗药物渗透到肿瘤细胞内部,破坏肿瘤内部的结构和功能,从而达到控制肿瘤大小和治疗乳腺癌的目的。
根据乳腺癌疾病的性质,病人可能会因各种原因而忽略实体瘤,也可能会在发现肿瘤后迅速增长而无法进行操作而患癌。
如果采取新辅助化疗的手段,可以很好地控制肿瘤大小,预防手术时的一些不可预测的危险。
3.新辅助化疗的副作用可以通过合理的药物方案得到控制。
新辅助化疗的副作用包括恶心、呕吐、脱发、血小板的减少以及感染的风险等。
但是通过合理的药物方案,可以将副作用降到最低限度。
现在的治疗药物逐渐趋于高效、低毒性,患者的耐药性上升,药物选择也变得越来越多样化。
因此,新辅助化疗的副作用并没有成为一个绝对的难点,并且可以通过合理的药物方案得到控制。
争议1.新辅助化疗的效果还有一定的不确定性。
虽然新辅助化疗可以有效控制肿瘤的大小,但是其效果的确切程度还有一定的不确定性。
在一些情况下,一些药物可能会失去作用,导致肿瘤在化疗结束后重新生长。
此外,有些患者对化疗药物会出现耐药性,使得化疗的效果减弱。
2.新辅助化疗会增加治疗的时间和费用。