6-分子筛层析
- 格式:ppt
- 大小:2.38 MB
- 文档页数:26


第1篇一、实验目的1. 熟悉凝胶层析法分离蛋白质的基本原理。
2. 掌握凝胶层析法分离蛋白质的实验操作。
3. 通过实验,了解不同蛋白质分子量的分离情况。
二、实验原理凝胶层析法,又称分子筛层析法,是一种利用凝胶作为固定相,根据分子大小分离混合物中不同分子量的蛋白质的方法。
凝胶是一种多孔物质,分子大小不同的蛋白质在凝胶中流动速度不同,从而实现分离。
小分子蛋白质能够进入凝胶内部,流动速度较慢,而大分子蛋白质则不能进入凝胶内部,流动速度较快。
三、实验材料与仪器1. 实验材料:- 蛋白质样品(如牛血清白蛋白、鸡蛋清、大豆蛋白等)- 凝胶柱(如Sephadex G-100)- 洗脱液(如磷酸盐缓冲液)- 标记笔2. 实验仪器:- 凝胶层析柱- 离心机- 吸管- 烧杯- 移液器- 水浴锅四、实验步骤1. 蛋白质样品制备:将蛋白质样品溶解于磷酸盐缓冲液中,调节pH值至7.4,使蛋白质充分溶解。
2. 凝胶柱制备:将Sephadex G-100凝胶放入凝胶层析柱中,用磷酸盐缓冲液充分洗涤凝胶,去除杂质。
3. 加样:将制备好的蛋白质样品沿凝胶柱上端缓慢加入,注意避免气泡产生。
4. 洗脱:将磷酸盐缓冲液加入凝胶层析柱中,使洗脱液缓慢流过凝胶柱,收集洗脱液。
5. 检测:取部分洗脱液,用SDS-PAGE法检测蛋白质的分子量。
6. 结果分析:根据SDS-PAGE检测结果,分析不同蛋白质的分子量及分离效果。
五、实验结果与分析1. 实验现象:在凝胶层析过程中,不同蛋白质分子量在凝胶柱中流动速度不同,从而实现分离。
分子量较大的蛋白质先流出凝胶柱,分子量较小的蛋白质后流出凝胶柱。
2. 结果分析:(1)牛血清白蛋白:分子量为66.5kDa,通过凝胶层析后,在洗脱液中的出现时间为3.5小时。
(2)鸡蛋清:分子量为58.0kDa,通过凝胶层析后,在洗脱液中的出现时间为4.5小时。
(3)大豆蛋白:分子量为15.0kDa,通过凝胶层析后,在洗脱液中的出现时间为6.0小时。

实验十一凝胶层析法测定蛋白质分子量实验目的:了解凝胶层析的原理及其操作,分离血红蛋白和胰蛋白酶(或蓝葡聚糖2000)。
实验原理:凝胶层析也成凝胶过滤法,排阻层析、分子筛层析或渗透层析等是20世纪60年代发展起来的一种简便有效的生物化学分离分析方法。
这种方法的基本原理是用一般的柱层析方法使相对分子质量不同的溶质通过具有分子筛性质的固定相(凝胶),从而使物质分离。
用作凝胶的材料有多种,如交联葡聚糖、琼脂糖、聚丙烯酰胺凝胶、聚苯乙烯和多孔玻璃珠等。
以交联葡聚糖分离物质和测定相对分子量为例说明凝胶层析法的基本原理和应用。
交联葡聚糖(Sephadex)是由细菌葡聚糖(以右旋葡萄糖为残基的多糖)用交联剂环氧氯丙烷交联形成的有三维空间的网状结构物。
控制葡聚糖和交联剂的配比及反应条件就可决定其交联度的大小(交联度大,“网眼”就小),从而得到各种规格的交联葡聚糖,即不同型号的凝胶。
“G”表示交联度,G越小,交联度越大,吸水量也就越小,见表3-3(P.41.)。
G值越小,颗粒比较硬,G值越大,颗粒相比较软些(可以以手感触)。
G值也对应凝胶的工作范围。
凝胶层析广泛地应用于分离、提纯、浓缩生物大分子及脱盐、去热源等,而测定蛋白质的分子量也是它的重要应用之一。
凝胶是一种具有立体网状结构且呈多孔的不溶性珠状颗粒物质。
用它来分离物质,主要是根据多孔凝胶对不同半径的蛋白质分子(近于球形)具有不同的排阻效应实现的。
亦即它是根据分子大小这一物理性质进行分离纯化的。
对于某种型号的凝胶,一些大分子不能进入凝胶颗粒内部而完全被排阻在外,洗脱时,此类物质沿着颗粒间隙下移,最先流出层析柱(板书:图3-14,3-15A)。
而一些小分子不被排阻,可自由扩散,渗透进入凝胶内部的筛孔,尔后又被流出的洗脱液带走。
分子越小,进入凝胶内部越深,在凝胶颗粒的网孔内滞留的时间越长,结果是小分子的蛋白质洗脱速度较慢,即洗脱体积较大,最后流出柱外。
不同一些中等大小的分子介于大分子与小分子之间,只能进入一部分凝胶较大的孔隙,亦即部分排阻,因此这些分子从柱中流出的顺序也介于大、小分子之间。

9种层析分离纯化方法详解层析法是利用不同物质理化性质的差异而建立起来的技术。
所有的层析系统都由两个相组成:一是固定相,它或者是固体物质或者是固定于固体物质上的成分;另一是流动相,即可以流动的物质,如水和各种溶媒。
当待分离的混合物随溶媒(流动相)通过固定相时,由于各组份的理化性质存在差异,与两相发生相互作用(吸附、溶解、结合等)的能力不同,在两相中的分配(含量对比)不同,而且随溶媒向前移动,各组份不断地在两相中进行再分配。
与固定相相互作用力越弱的组份,随流动相移动时受到的阻滞作用小,向前移动的速度快。
反之,与固定相相互作用越强的组份,向前移动速度越慢。
分部收集流出液,可得到样品中所含的各单一组份,从而达到将各组份分离的目的。
按层析原理可将层析分为以下9种:1、亲和层析利用待分离物质和它的特异性配体间具有特异的亲和力,从而达到分离的目的。
将可亲和的一对分子中的一方以共价键形式与不溶性载体相连作为固定相吸附剂,当含混合组分的样品通过此固定相时,只有和固定相分子有特异亲和力的物质,才能被固定相吸附结合,性无关组分随流动相流出。
改变流动相组分,可将结合的亲和物洗脱下来。
亲和层析中所用的载体称为基质,与基质共价连接的化合物称配基。
具有专一亲和力的生物分子对主要有:抗原与抗体,DNA与互补DNA或RNA,酶与底物、激素与受体、维生素与特异结合蛋白、糖蛋白与植物凝集素等。
亲和层析可用于纯化生物大分子、稀释液的浓缩、不稳定蛋白质的贮藏、分离核酸等。
亲和层析纯化的分离原理特点:亲和层析具有高选择性、高纯度、快速、浓缩等特点,在重组蛋白的分离中多作为第一步的粗纯,实现对绝大部分杂质蛋白的去除。
2、离子交换层析采用具有离子交换性能的物质作固定相,利用它与流动相中的离子能进行可逆交换的性质来分离离子型化合物的方法。
主要用于分离氨基酸、多肽及蛋白质,也可用于分离核酸、核苷酸及其他带电荷的生物分子。
不同蛋白质的等电点(pI,isoelectric point)特性,使在不同pH缓冲液条件下所带正/负净电荷不同,选择不同的离子交换柱实现分离。

常用的层析分析方法在分离分析特别是蛋白质分离分析中,层析是相当重要、且相当常见的一种技术,其原理较为复杂,对人员的要求相对较高,这里只能做一个相对简单的介绍。
一、吸附层析1、吸附柱层析吸附柱层析是以固体吸附剂为固定相,以有机溶剂或缓冲液为流动相构成柱的一种层析方法。
2、薄层层析薄层层析是以涂布于玻板或涤纶片等载体上的基质为固定相,以液体为流动相的一种层析方法。
这种层析方法是把吸附剂等物质涂布于载体上形成薄层,然后按纸层析操作进行展层。
3、聚酰胺薄膜层析聚酰胺对极性物质的吸附作用是由于它能和被分离物之间形成氢键。
这种氢键的强弱就决定了被分离物与聚酰胺薄膜之间吸附能力的大小。
层析时,展层剂与被分离物在聚酰胺膜表面竞争形成氢键。
因此选择适当的展层剂使分离在聚酰胺膜表面发生吸附、解吸附、再吸附、再解吸附的连续过程,就能导致分离物质达到分离目的。
二、离子交换层析离子交换层析是在以离子交换剂为固定相,液体为流动相的系统中进行的。
离子交换剂是由基质、电荷基团和反离子构成的。
离子交换剂与水溶液中离子或离子化合物的反应主要以离子交换方式进行,或借助离子交换剂上电荷基团对溶液中离子或离子化合物的吸附作用进行。
`三、凝胶过滤凝胶过滤又叫分子筛层析,其原因是凝胶具有网状结构,小分子物质能进入其内部,而大分子物质却被排除在外部。
当一混合溶液通过凝胶过滤层析柱时,溶液中的物质就按不同分子量筛分开了。
四、亲和层析亲和层析的原理与众所周知的抗原一抗体、激素一受体和酶一底物等特异性反应的机理相类似,每对反应物之间都有一定的亲和力。
正如在酶与底物的反应中,特异的废物(S')才能和一定的酶(E)结合,产生复合物(E-S')一样。
在亲和层析中是特异的配体才能和一定的生命大分子之间具有亲和力,并产生复合物。
而亲和层析与酶一底物反应不同的是,前者进行反应时,配体(类似底物)是固相存在;后者进行反应时,底物呈液相存在。
实质上亲和层析是把具有识别能力的配体L(对酶的配体可以是类似底物、抑制剂或辅基等)以共价键的方式固化到含有活化基团的基质M(如活化琼脂糖等)上,制成亲和吸附剂M-L,或者叫做固相载体。
实验三分子筛凝胶层析一、实验目的1.掌握葡聚糖凝胶的特性及凝胶层析的原理;2.学习葡聚糖凝胶层析的基本操作技术。
二、实验原理凝胶是由胶体溶液凝结而成的固体,它们的内部有很细微的多孔网状结构。
目前关于凝胶层析的原理有许多假设和理论,普遍接受的是分子筛效应。
凝胶颗粒在合适的溶剂中浸泡,充分吸液膨胀,然后装入层析柱内,加入欲分离的混合物后,再以同一溶剂洗脱。
在洗脱过程中,大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,而小分子可以进入凝胶颗粒内部的多孔网状结构,流速缓慢,以至最后流出柱外,从而使样品中分子大小不同的物质得到分离。
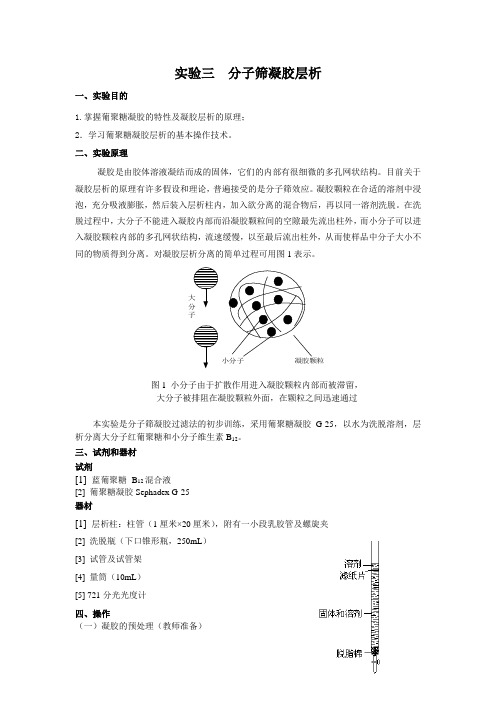
对凝胶层析分离的简单过程可用图1表示。
子图1 小分子由于扩散作用进入凝胶颗粒内部而被滞留,大分子被排阻在凝胶颗粒外面,在颗粒之间迅速通过本实验是分子筛凝胶过滤法的初步训练,采用葡聚糖凝胶G-25,以水为洗脱溶剂,层析分离大分子红葡聚糖和小分子维生素B12。
三、试剂和器材试剂[1] 蓝葡聚糖- B12混合液[2] 葡聚糖凝胶Sephadex G-25器材[1] 层析柱:柱管(1厘米×20厘米),附有一小段乳胶管及螺旋夹[2] 洗脱瓶(下口锥形瓶,250mL)[3] 试管及试管架[4] 量筒(10mL)[5] 721分光光度计四、操作(一)凝胶的预处理(教师准备)为使样品通过凝胶时具有良好的流速并能很好的分离,应对凝胶进行预处理。
(1)凝胶必须于使用前在过量的溶剂中充分地膨胀。
(2)用倾泻法除去混杂的细小颗粒,重复3-4次。
在膨胀时间内,应避免剧烈搅拌,以防止破坏交链结构。
(二)柱的选择为了防止分离受管壁效应影响,一般应选用内径大于2.5厘米的柱。
为了便于组织拆卸,下口可取一个适当削磨过的橡皮塞倒插入管底,这种装法亦可避免层析柱的死区而有利分离。
橡皮塞上还覆盖一层尼龙绸或脱脂棉,以防止葡聚糖颗粒流出。
(三)装柱装柱是凝胶层析中最重要的一步操作,实验时必须将凝胶床装得十分均匀。
一、实验目的本实验旨在通过凝胶层析技术,对混合物中的不同分子量物质进行分离和纯化。
具体目标包括:1. 掌握凝胶层析的原理和操作步骤。
2. 学习如何根据分子量差异对蛋白质等生物大分子进行分离。
3. 观察和分析实验结果,验证凝胶层析技术的有效性和可行性。
二、实验原理凝胶层析(Gel Filtration)又称分子筛层析,是一种基于分子量差异进行物质分离的方法。
该技术利用凝胶作为固定相,凝胶具有多孔结构,分子量不同的物质在凝胶中的移动速度不同,从而实现分离。
实验中常用的凝胶材料包括葡聚糖凝胶(Sephadex)和琼脂糖凝胶(Sepharose)。
凝胶颗粒的大小可通过调节葡聚糖和交联剂的比例来控制。
交联度越大,网孔结构越紧密;交联度越小,网孔结构就越疏松。
因此,不同型号的凝胶具有不同的分子量分级范围。
实验过程中,将待分离物质加入凝胶柱中,在溶剂的作用下,各组分因分子量差异在凝胶柱中以不同的速度移动。
分子量大的物质在凝胶柱中的移动速度较慢,先流出柱子;而分子量小的物质则可以进入凝胶颗粒的网孔内,移动速度较快,后流出柱子。
三、实验材料与仪器1. 实验材料:- 待分离的混合物- 葡聚糖凝胶(Sephadex G-100)- 洗脱液(例如磷酸盐缓冲液)- 标准蛋白质溶液(例如牛血清白蛋白、肌红蛋白等)- 紫外分光光度计- 凝胶层析柱- 量筒- 移液器- 离心机2. 实验仪器:- 凝胶层析柱- 紫外分光光度计- 移液器- 量筒- 离心机四、实验步骤1. 准备凝胶柱:将葡聚糖凝胶(Sephadex G-100)用洗脱液充分溶胀,装入凝胶层析柱中。
2. 准备样品:将待分离的混合物用洗脱液稀释,调整蛋白质浓度至适当水平。
3. 加样:将样品加入凝胶柱中,待样品完全进入凝胶柱后,用洗脱液冲洗柱子,直至流出液为无色。
4. 收集洗脱液:用紫外分光光度计检测洗脱液中的蛋白质浓度,收集不同分子量范围的蛋白质组分。
5. 分析结果:将收集到的蛋白质组分进行SDS-PAGE电泳或Western blot分析,观察蛋白质的分子量和纯度。
凝聚:指在投加的化学物质(铝、铁的盐类或石灰等)作用下,胶体脱稳并使粒子相互聚集成1mm 大小块状凝聚体的过程。
PPT电泳:荷电的胶体粒子在电场中的移动。
PPT或者:荷电溶质(电解质)或粒子在电场作用下发生定向泳动的现象P362膜分离的概念:利用膜的选择性(孔径大小),以膜的两侧存在的能量差作为推动力,由于溶液中各组分透过膜的迁移率不同而实现分离的一种技术。
PPT 或者:利用具有一定选择性透过特性的过滤介质进行物质的分离纯化。
P56离子交换: 在吸附剂与溶液间发生离子交换,即吸附剂吸附离子后,它同时要放出等当量的离子于溶液中。
PPT过滤:是在外力作用下,利用过滤介质使悬浮液中的液体通过,而固体颗粒被截留在介质上,从而实现固液分离的一种单元操作。
PPT或者:利用薄片形多孔性介质(如滤布)截留固液悬浮液中的固体粒子,进行固液分离的方法。
P20沉降:离心分离是基于固体颗粒和周围液体密度存在差异,在离心场中使不同密度的固体颗粒加速沉降的分离过程,当静置悬浮液时,密度较大的固体颗粒在重力作用下逐渐下沉,这一过程称为沉降。
PPT重结晶:是利用杂质和结晶物质在不同溶剂和不同温度下的溶解度不同,将晶体用合适的溶剂再次结晶,以获得高纯度的晶体的操作。
PPT晶体:形成新相(固体)需要一定的表面自由能。
因此,溶液浓度达到饱和溶解度时,晶体尚不能析出,只有当溶质浓度超过饱和溶解度后,才可能有晶体析出。
溶液达到过饱和状态是结晶的前提;过饱和度是结晶的推动力。
PPT初级分离:指从菌体发酵液、细胞培养液、胞内抽提液(细胞破碎液)及其他各种生物原料初步提取目标产物,使目标产物得到浓缩和初步分离的下游加工过程。
P35双水相系统:某些亲水性高分子聚合物的水溶液超过一定浓度后可形成两相,并且在两相中水分均占很大比例,即形成双水相系统。
P116双结点线:双结点线以下的区域为均相区,以上的区域为两相区。
P117反胶团:表面活性剂在有机溶剂中形成的胶团。