工程热力学知识点汇总
- 格式:doc
- 大小:3.35 MB
- 文档页数:28

S dEW m ++⎪⎭⎫δδ111.BT w m =22式中22wm —分子平移运动的动能,其中m 是一个分子的质量,w 是分子平移运动的均方根速度; B —比例常数;T —气体的热力学温度。
2.t T +=273压 力 :1.nBT w m n p 322322==式中P —单位面积上的绝对压力;n —分子浓度,即单位容积内含有气体的分子数VNn =,其中N 为容积V 包含的气体分子总数。
2.fFp =F —整个容器壁受到的力,单位为牛(N );f —容器壁的总面积(m 2)。
3.g p B p +=(P >B )H B p -=(P <B )式中 B —当地大气压力P g —高于当地大气压力时的相对压力,称表压力;H —低于当地大气压力时的相对压力,称为真空值。
比容: 1.mV v = m 3/kg式中 V —工质的容积m —工质的质量2.1=v ρ 式中 ρ—工质的密度kg/m3v —工质的比容m 3/kg热力循环:⎰⎰=w q δδ多变过程:凡过程方程为=n pv 常数的过程,称为多变过程。
定容过程:定量工质容积保持不变时的热力过程称为定容过程。
定压过程:定量工质压力保持不变时的热力过程称为定压过程。
定温过程:定量工质温度保持不变时的热力过程称为定温过程。
单级活塞式压气机工作原理:吸气过程、压缩过程、排气过程,活塞每往返一次,完成以上三个过程。
活塞式压气机的容积效率:活塞式压气机的有效容积和活塞排量之比,称为容积效率。
活塞式压气机的余隙:为了安置进、排气阀以及避免活塞与汽缸端盖间的碰撞,在汽缸端盖与活塞行程终点间留有一定的余隙,称为余隙容积,简称余隙。
最佳增压比:使多级压缩中间冷却压气机耗功最小时,各级的增压比称为最佳增压比。
压气机的效率:在相同的初态及增压比条件下,可逆压缩过程中压气机所消耗的功与实际不可逆压缩过程中压气机所消耗的功之比,称为压气机的效率。
热机循环:若循环的结果是工质将外界的热能在一定条件下连续不断地转变为机械能,则此循环称为热机循环。

工热知识点总结一、理论基础1. 热力学基础热力学是研究热现象和能量转化规律的科学,其研究对象包括热力学系统的状态、过程和相互作用等。
热力学定律包括热力学第一、二、三定律,它们分别描述了能量守恒、熵增加和温度不可降的规律。
2. 热传导热传导是指物质内部热能的传递,根据导热介质的不同,可分为导热、导电、导磁等传导方式。
热传导的计算公式为热传导方程,其中包括热传导系数、温度梯度和距离梯度等。
在实际工程中,热传导的计算可以通过有限元分析、数值模拟等方法得到。
3. 对流传热对流传热是指通过流体的流动使热能传递的过程,可以是强迫对流或自然对流。
对流传热的传热系数和换热器的设计是工热领域的重要内容。
4. 热辐射热辐射是指物体由于温度差而发出或吸收的电磁波,热辐射的计算需要考虑辐射率、温度、表面发射率等参数。
热辐射通常可以通过辐射传热方程来描述,实际工程中可以应用黑体辐射、灰体辐射等模型进行计算。
二、热力学系统1. 封闭系统封闭系统是指不与外界交换物质,但与外界进行能量交换的系统。
热力学系统通常可以根据其与外界的物质交换情况分为封闭系统、开放系统和孤立系统。
2. 开放系统开放系统是指既与外界进行能量交换,又与外界进行物质交换的系统。
例如,蒸汽锅炉和汽轮机系统就是开放系统。
3. 孤立系统孤立系统是指既不与外界交换物质,也不与外界进行能量交换的系统。
孤立系统是理论假设中的一个重要模型,可以用于研究理想化的热力学系统。
三、热力学循环1. 卡诺循环卡诺循环是理想化的热力学循环模型,其效率最高,可用于分析和比较各种热力学循环系统的性能。
卡诺循环包括等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程,可以用来分析热机和热泵的性能。
2. 布雷顿循环布雷顿循环是一种热力学循环,广泛应用于蒸汽轮机、汽轮机和制冷机等系统。
布雷顿循环包括等压加热、等压膨胀、等压冷却和等压压缩四个过程,可以用来分析蒸汽发电系统和空气压缩系统的性能。
3. 斯特林循环斯特林循环是一种理想化的热力学循环模型,包括等温定压加热、绝热膨胀、等温定压冷却和绝热压缩四个过程。

工程热力学知识点总结一、热力学基本概念1.1 系统和环境1.2 状态量和过程量1.3 定态和非定态过程1.4 热平衡和热力学温度二、热力学第一定律2.1 能量守恒原理2.2 内能和焓2.3 热机效率和制冷系数三、热力学第二定律3.1 熵的概念与意义3.2 熵增原理与熵减原理3.3 卡诺循环及其效率四、物质的状态方程及其应用4.1 物态方程的概念与分类4.2 伯努利方程及其应用4.3 范德华方程及其应用五、相变热力学基础知识5.1 相变的基本概念5.2 相变过程中的物态方程5.3 相变焓和相变熵六、理想气体状态方程及其应用6.1 理想气体状态方程6.2 绝热过程中理想气体的温度压强关系6.3 恒容过程中理想气体内能变化七、混合气体热力学基础知识7.1 混合气体的概念7.2 混合气体的状态方程7.3 理想混合气体的热力学性质八、化学反应热力学基础知识8.1 化学反应的基本概念8.2 化学反应焓变和熵变8.3 反应平衡条件及其判定九、传热基础知识9.1 传热方式及其特点9.2 热传导方程及其解法9.3 对流传热及其换热系数十、工程热力学分析方法10.1 理想循环分析方法10.2 实际循环分析方法10.3 燃料空气循环分析方法十一、工程热力学实际应用11.1 能量转换装置的工作原理与性能分析11.2 能量转换装置的优化设计与运行控制11.3 工业过程中能量利用与节能技术总结:本文介绍了工程热力学知识点,包括了基本概念、第一定律和第二定律、物质状态方程及其应用、相变热力学基础知识、理想气体状态方程及其应用、混合气体热力学基础知识、化学反应热力学基础知识、传热基础知识、工程热力学分析方法和工程热力学实际应用。
这些知识点是工程热力学的核心内容,对于掌握能源转换与利用技术以及节能减排具有重要意义。

工程热力学复习知识点一、知识点基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。
1. 基本概念掌握和理解:热力学系统(包括热力系,边界,工质的概念。
热力系的分类:开口系,闭口系,孤立系统)。
掌握和理解:状态及平衡状态,实现平衡状态的充要条件。
状态参数及其特性。
制冷循环和热泵循环的概念区别。
理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。
2. 热力学第一定律掌握和理解:热力学第一定律的实质。
理解并会应用基本公式计算:热力学第一定律的基本表达式。
闭口系能量方程。
热力学第一定律应用于开口热力系的一般表达式。
稳态稳流的能量方程。
理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。
3. 热力学第二定律掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。
掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文表述等)。
卡诺循环和卡诺定理。
掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。
理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。
热力系的熵方程(闭口系熵方程,开口系熵方程)。
温-熵图的分析及应用。
理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。
4. 理想气体的热力性质熟悉和了解:理想气体模型。
理解并掌握:理想气体状态方程及通用气体常数。
理想气体的比热。
理解并会计算:理想气体的内能、焓、熵及其计算。
理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。
5. 实际气体及蒸气的热力性质及流动问题理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。
例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。
蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。
理解并掌握:绝热节流的现象及特点6. 蒸汽动力循环理解计算:蒸气动力装置流程、朗肯循环热力计算及其效率分析。

工程热力学知识点总结工程热力学知识点总结1. 热力学基本概念热力学是研究能量转化和能量传递规律的学科,它关注系统的宏观性质和变化。
热力学的基本概念包括系统、界面、过程、平衡状态、状态方程等。
2. 热力学第一定律热力学第一定律是能量守恒的表述,它表示能量的增量等于传热和做功的总和。
数学表达式为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示热的传递,W表示外界对系统做功。
3. 热力学第二定律热力学第二定律描述了自然界中存在的一种过程的不可逆性,即熵增原理。
它指出孤立系统的熵总是增加或保持不变,不会减少。
熵增原理对热能转化和能量传递的方向提供了限制。
4. 热力学循环热力学循环是一系列热力学过程组成的闭合路径,通过这个路径,系统经历一系列状态变化,最终回到初始状态。
常见的热力学循环有卡诺循环、斯特林循环等。
5. 热力学性质热力学性质是用来描述物质宏观状态的物理量,常用的热力学性质包括温度、压力、内能、焓、熵等。
它们与热力学过程和相变有着密切的关系。
6. 热力学方程热力学方程是用来描述物质宏观状态的数学关系。
常见的热力学方程有状态方程(如理想气体状态方程)、焓的变化方程、熵的变化方程等。
这些方程对于分析和计算热力学过程非常重要。
7. 理想气体理想气体是热力学中一种理想的气体模型。
在理想气体状态方程中,气体的压力、体积和温度之间满足理想气体方程。
理想气体模型对于理解和研究气体性质和行为非常有用。
8. 发动机热力学循环发动机热力学循环是指内燃机和外燃机中进行热能转换的一系列过程。
常见的发动机热力学循环有奥托循环、迪塞尔循环等。
通过研究发动机热力学循环,可以优化发动机的效率和性能。
9. 相变热力学相变热力学研究物质由一种相态转变为另一种相态的过程。
相变热力学包括液体-气体相变、固体-液体相变、固体-气体相变等。
了解相变热力学对于理解物质的性质和行为具有重要意义。
总结:工程热力学是研究能量转化和能量传递规律的学科,它关注系统的宏观性质和变化。

工程热力学知识点电子版
1.热力学基本概念:包括热力学系统、态函数、过程、平衡等基本概念。
2.热力学定律:包括热平衡第一定律(能量守恒),热平衡第二定律(熵增原理)以及热平衡第三定律(绝对零度定律)。
3.理想气体的热力学性质:包括状态方程、卡诺循环、理想气体的内能、焓、熵等性质,以及理想气体的不可逆过程等。
4.热功学:包括热力学势、热力学基本方程、热力学关系、开放系统
的热力学分析等。
5.蒸汽循环与汽轮机:包括蒸汽循环的基本原理、热力学效率、汽轮
机的工作原理和热力学分析等。
6.冷热交换过程:包括传热方式、传热定律、传热设备的热力学设计等。
7.蒸发和冷凝:包括蒸发和冷凝的热力学原理、热传导、传质机制等。
8.混合物与溶液的热力学性质:包括理想混合物的热力学分析、溶解度、等温吸收和等温蒸馏等。
9.平衡态的热力学:包括平衡态判定、化学反应的平衡和平衡常数等。
10.非平衡态的热力学:包括非平衡态的基本概念、非平衡态热力学
平衡准则等。
11.热力学循环与工作系统:包括往复式热机循环(如柴油循环、克
氏循环等)、蒸汽循环的分析、制冷循环等。
以上仅列举了一些工程热力学的基本知识点,具体内容还包括一些相关的热力学计算方法和应用,如热力学分析软件的应用、能源转化系统的分析等。

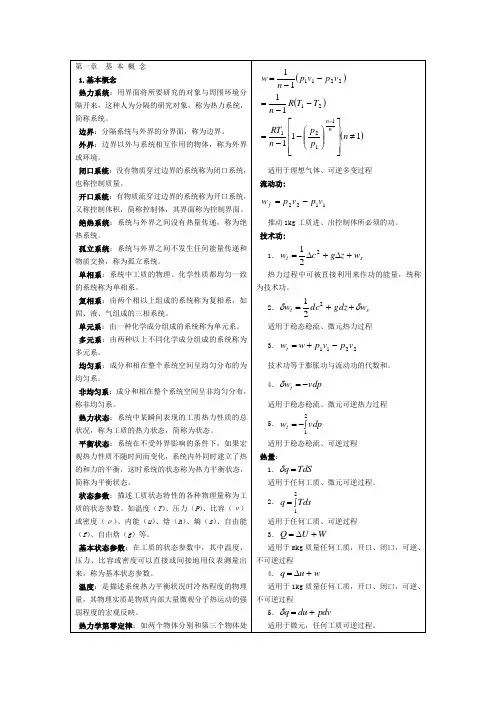
第一章基本概念1. 基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(u )或密度(p )、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。

工程热力学知识点1.热力学系统:热力学系统是指研究对象的一部分,可以是一个物体、一堆物体或者由物质组成的一部分空间。
根据与外界的能量交换情况,热力学系统可分为开放系统、封闭系统和孤立系统。
2.热力学性质:热力学性质指描述热力学系统状态的物理量,包括温度、压力、体积、能量等。
温度是衡量系统热平衡程度的物理量,通常用摄氏度或开尔文度量;压力是物质单位面积上的力,常用帕斯卡表示。
3.热平衡和热平衡态:当一个系统与外界无能量和物质交换,且系统各个部分之间没有内部驱动力时,系统处于热平衡态。
在热平衡态下,系统各点的温度相等。
4.热力学过程:热力学过程是指研究对象从一个状态到另一个状态的转变。
常见的热力学过程有等温过程、绝热过程、等容过程和等压过程。
5.理想气体状态方程:理想气体状态方程描述了理想气体的状态。
根据理想气体状态方程,PV=nRT,其中P为气体压力,V为气体体积,n为气体物质的摩尔数,R为气体常数,T为气体的绝对温度。
6.热力学第一定律:热力学第一定律也称能量守恒定律,它表明能量在系统中的转换是不会消失的,只会从一种形式转化为另一种形式。
7.热力学第二定律:热力学第二定律是关于热能转化的限制性规律,它确立了自然界中热能转化的方向,即热量只能从高温物体传向低温物体。
8.热力学循环:热力学循环是指一系列经历各种热力学过程的系统,最终回到初始状态。
常见的热力学循环有卡诺循环、布雷顿循环等。
9.温度计和热工计量:温度计是测量温度的仪器,根据热胀冷缩原理,例如温度计中的水银柱上浮下沉来表示温度的高低。
热工计量是测量热力学过程中能量转换的仪器,例如蒸汽流量计和压力计等。
10.热力学循环的效率:热力学循环的效率是指从热量到机械能转化的效率,表示为循环获得的净功与输入的热量之比。
根据卡诺定理,所有工作于相同温度范围内的可逆循环具有相同的效率,而实际循环的效率往往低于理论值。
综上所述,这些是工程热力学的一些重要知识点,热力学是研究能量转化和利用的基础,对于工程学科的学习和应用具有重要意义。

第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。

工程热力学知识点1.热力学系统热力学系统是指被研究的物体或装置,可以根据其与周围环境的热交换和物质交换情况划分为开放系统、封闭系统和孤立系统。
2.状态方程和状态变化状态方程描述了热力学系统的状态,可以通过物质的温度、压力和体积等物理量进行定义。
状态变化是热力学系统从一个状态到另一个状态的过程,可以通过热力学过程描述。
3.热力学过程热力学过程是热力学系统从一个状态到另一个状态的变化过程。
常见的热力学过程包括等温过程、绝热过程、等容过程和等压过程。
热力学过程可以通过热力学循环描述,常见的热力学循环包括卡诺循环和斯特林循环等。
4.热力学定律热力学定律是热力学系统行为的基本规律。
包括热力学第一定律(能量守恒定律)、热力学第二定律(熵增加定律)和热力学第三定律(绝对零度定律)。
5.热力学性质热力学性质是描述热力学系统的特性的物理量。
常见的热力学性质包括温度、压力、体积、内能、焓等。
这些性质对于研究热力学过程和热力学系统的行为具有重要意义。
6.理想气体状态方程理想气体状态方程是描述理想气体状态的基本关系。
根据理想气体状态方程,可以推导出玻意耳-马略特定律和查理定律等关系。
理想气体状态方程对于研究气体的性质和行为具有重要意义。
7.熵和热力学效率熵是一个描述系统无序程度的物理量,也是热力学第二定律的核心概念。
热力学效率是衡量能量转化的有效性的指标,它可以通过熵增加原理计算和分析。
8.热力学循环和工质流程热力学循环是一系列热力学过程的组合,通常用来描述热力学系统的能量转化过程。
工质流程是热力学系统中流动的工质的循环或非循环过程。
以上是工程热力学的一些重要知识点。
工程热力学的应用广泛,包括能源转化设备、制冷空调设备、热力发电系统等。
通过对热力学系统特性、能量转移和能量转化的研究,可以优化工程设备和能源利用效率,提高系统的性能和可靠性。
工程热力学复习知识点一、知识点基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。
1. 基本概念掌握和理解:热力学系统(包括热力系,边界,工质的概念。
热力系的分类:开口系,闭口系,孤立系统)。
掌握和理解:状态及平衡状态,实现平衡状态的充要条件。
状态参数及其特性。
制冷循环和热泵循环的概念区别。
理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。
2. 热力学第一定律掌握和理解:热力学第一定律的实质。
理解并会应用基本公式计算:热力学第一定律的基本表达式。
闭口系能量方程。
热力学第一定律应用于开口热力系的一般表达式。
稳态稳流的能量方程。
理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。
3. 热力学第二定律掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。
掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文表述等)。
卡诺循环和卡诺定理。
掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。
理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。
热力系的熵方程(闭口系熵方程,开口系熵方程)。
温-熵图的分析及应用。
理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。
4. 理想气体的热力性质熟悉和了解:理想气体模型。
理解并掌握:理想气体状态方程及通用气体常数。
理想气体的比热。
理解并会计算:理想气体的内能、焓、熵及其计算。
理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。
5. 实际气体及蒸气的热力性质及流动问题理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。
例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。
蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。
理解并掌握:绝热节流的现象及特点6. 蒸汽动力循环理解计算:蒸气动力装置流程、朗肯循环热力计算及其效率分析。
工程热力学知识点笔记总结第一章热力学基本概念1.1 热力学的基本概念热力学是研究能量与物质的转化关系的科学,它关注热与功的转化、能量的传递和系统的状态变化。
热力学中最基本的概念包括系统、热力学量、状态量、过程、功和热等。
1.2 热力学量热力学量是描述系统的性质和状态的物理量,包括内能、焓、熵、自由能等。
内能是系统的总能量,焓是系统在恒压条件下的能量,熵是系统的无序程度,自由能是系统进行非体积恒定的过程中能够做功的能量。
1.3 热力学第一定律热力学第一定律是能量守恒的表达形式,在闭合定容系统中,系统的内能变化等于系统所接受的热量减去系统所做的功。
1.4 热力学第二定律热力学第二定律是描述系统不可逆性的定律,它包括开尔文表述和克劳修斯表述。
开尔文表述指出不可能将热量完全转化为功而不引起其他变化,克劳修斯表述指出热量自然只能从高温物体传递到低温物体。
根据第二定律,引入了熵增大原理和卡诺循环。
1.5 热力学第三定律热力学第三定律是指当温度趋于绝对零度时,系统的熵趋于零。
这一定律揭示了绝对零度对热力学过程的重要意义。
第二章热力学系统2.1 定态与非定态定态系统是指系统的性质在长时间内不发生变化,非定态系统是指系统的性质在长时间内发生变化。
2.2 开放系统与闭合系统开放系统是指与外界交换物质和能量的系统,闭合系统是指与外界不交换物质但可以交换能量的系统。
2.3 热力学平衡热力学平衡是指系统内各部分之间的温度、压力、化学势等性质达到一致的状态。
系统处于热力学平衡时,不会产生宏观的变化。
第三章热力学过程3.1 等温过程在等温过程中,系统的温度保持不变,内能的变化全部转化为热量输给外界。
3.2 绝热过程在绝热过程中,系统不与外界交换热量,内能的变化全部转化为对外界所做的功。
3.3 等容过程在等容过程中,系统的体积保持不变,内能的变化全部转化为热量。
3.4 等压过程在等压过程中,系统的压强保持不变,内能的变化转化为对外界所做的功和系统所吸收的热量。
工程热力学基础知识介绍一、基本概念工质:工作介质的简称。
工质的状态参数有六个:1)压力2)温度3)比容:指单位工质所具有的容积。
用γ表示。
γ=V/m (单位:mз/kg)气体比容的倒数为气体的密度。
4)内能:指气体的内位能与内动能之和,用u表示。
5)焓:是一个表示能量的状态参数,用h表示。
它由内能和推动功组成,即h=u+pv6) 熵:是一个导出的状态参数,它表示能量的传递方向。
用s表示。
二、热力学两大定律热力学第一定律:热可以变为功,功也可以变为热。
一定量的热消失时,必产生与之数量相当的功;消耗一定量的功时,也必出现相应数量的热。
热力学第二定律:热量不可能自发的,无条件的从低温物体传到高温物体。
三、热力过程热力过程指工质由一种状态变化为另一种状态所经过的途径。
常见的热力过程有:定容过程、定压过程、定温过程、绝热过程。
理想气体状态方程:PV=nRT1)定容过程:V=定值, P1/P2=T1/T2定容过程中,工质不输出膨胀功,加给工质的热量未转化为机械能,全部用于增加工质的热力学能,因而工质温度升高。
2)定压过程:P=定值,V1/V2=T1/T2定压过程中,工质流过换热器等设备时,不对外做技术功,这时工质吸收热量转化的机械能全部用来维持工质的流动。
3)定温过程:T=定值,P1V1=P2V2定温过程中,由于热力学能不变,所以在定温膨胀时吸收的热量,全部转化未膨胀功。
4)绝热过程:ΔQ=0绝热过程中,工质所作的技术功等于焓降,与外界无能量交换,过程功只来自工质本身的能量转换。
四、热力循环一个热力系统经过一系列的热力变化,最后又回到原来完全相同的状态称为热力循环。
余热电站的热力循环即为简单的朗肯循环。
0→1:水在锅炉内预热,汽化并过热,变为过热蒸汽,是一个定压吸热过程。
1→2:过热蒸汽进入汽轮机膨胀做功,放热,是一个绝热膨胀过程。
2→3:乏汽进入凝汽器,凝结成水,是一个定压冷凝过程。
3→4:凝结水经给水泵提压后进入锅炉,是一个绝热压缩过程。
工程热力学知识点总结一、基本概念1. 热力学系统热力学系统是指研究对象的范围,可以是一个物体、一个系统或者多个系统的组合。
根据系统与外界的物质交换和能量交换情况,将系统分为封闭系统、开放系统和孤立系统。
2. 热力学状态热力学状态是指系统的一种特定状态,由系统的几个宏观性质确定。
常用的状态参数有温度、压力、体积和能量等。
3. 热力学过程热力学过程是系统在一定条件下的状态变化。
常见的热力学过程有等温过程、绝热过程、等压过程和等容过程等。
4. 热力学平衡系统的平衡是指系统内各部分之间不存在宏观的能量或物质的不均匀性。
在平衡状态下,系统内各部分之间的宏观性质是不发生变化的。
5. 热力学势函数热力学势函数是描述系统平衡状态的函数,常见的有内能、焓、自由能和吉布斯自由能等。
二、热力学定律1. 热力学第一定律热力学第一定律是能量守恒定律的热力学表述。
它可以表述为:系统的内能变化等于系统对外界所做的功与系统吸收的热的代数之和。
2. 热力学第二定律热力学第二定律是热力学中一个非常重要的定律,它对能量转化的方向和效率进行了限制。
根据热力学第二定律,系统内部永远不会自发地将热量从低温物体传递到高温物体,这就是热机不能做功的原因。
3. 卡诺定理卡诺定理是热力学第二定律的一种推论,它指出在两个恒温热源之间进行热机循环时,效率最高的情况是卡诺循环。
4. 热力学第三定律热力学第三定律规定了在温度接近绝对零度时热容为零,即系统的熵在绝对零度时为常数。
三、热力学循环1. 卡诺循环卡诺循环是一种理想的热机循环,它采用绝热和等温两个可逆过程。
卡诺循环的效率是所有热机循环中最高的。
2. 斯特林循环斯特林循环是一种理想的外燃循环,它采用绝热和等温两个可逆过程。
斯特林循环比卡诺循环的效率低一些,但是实际上,在制冷机中应用得比较广泛。
3. 布雷顿循环布雷顿循环是一种理想的内燃循环,它采用等容和等压两个可逆过程。
布雷顿循环是内燃机的工作循环,应用比较广泛。
第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
工程热力学知识点总结工程热力学是一门研究能量转换规律以及热能有效利用的学科,它在能源、动力、化工等领域有着广泛的应用。
以下是对工程热力学一些重要知识点的总结。
一、基本概念1、热力系统热力系统是指人为选取的一定范围内的物质作为研究对象。
根据系统与外界的物质和能量交换情况,可分为闭口系统(与外界无物质交换)、开口系统(与外界有物质交换)和绝热系统(与外界无热量交换)等。
2、状态参数描述热力系统状态的物理量称为状态参数,如压力、温度、比体积等。
状态参数的特点是只取决于系统的状态,而与达到该状态的路径无关。
3、热力过程热力系统从一个状态变化到另一个状态所经历的途径称为热力过程。
常见的热力过程有定容过程、定压过程、定温过程和绝热过程等。
4、热力循环系统经历一系列热力过程后又回到初始状态,所形成的封闭过程称为热力循环。
二、热力学第一定律热力学第一定律是能量守恒与转换定律在热力学中的应用,其表达式为:输入系统的能量输出系统的能量=系统储存能量的变化。
对于闭口系统,热力学第一定律可表示为:$Q =\Delta U + W$,其中$Q$ 为系统吸收的热量,$\Delta U$ 为系统内能的变化,$W$ 为系统对外所做的功。
对于开口系统,热力学第一定律的表达式较为复杂,需要考虑进、出口的能量流动。
三、热力学第二定律热力学第二定律指出了热过程的方向性和不可逆性。
常见的表述有克劳修斯表述和开尔文表述。
克劳修斯表述:热量不可能自发地从低温物体传向高温物体。
开尔文表述:不可能从单一热源取热使之完全变为有用功而不产生其他影响。
热力学第二定律的实质是揭示了自然界中一切自发过程都是不可逆的。
四、理想气体的性质理想气体是一种假设的气体模型,其分子之间没有相互作用力,分子本身不占有体积。
理想气体的状态方程为$pV = nRT$,其中$p$ 为压力,$V$ 为体积,$n$ 为物质的量,$R$ 为气体常数,$T$ 为温度。
理想气体的内能和焓仅与温度有关,与压力和体积无关。
工程热力学复习知识点一、知识点基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。
1. 基本概念掌握和理解:热力学系统(包括热力系,边界,工质的概念。
热力系的分类:开口系,闭口系,孤立系统)。
掌握和理解:状态及平衡状态,实现平衡状态的充要条件。
状态参数及其特性。
制冷循环和热泵循环的概念区别。
理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。
2. 热力学第一定律掌握和理解:热力学第一定律的实质。
理解并会应用基本公式计算:热力学第一定律的基本表达式。
闭口系能量方程。
热力学第一定律应用于开口热力系的一般表达式。
稳态稳流的能量方程。
理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。
3. 热力学第二定律掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。
掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文表述等)。
卡诺循环和卡诺定理。
掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。
理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。
热力系的熵方程(闭口系熵方程,开口系熵方程)。
温-熵图的分析及应用。
理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。
4. 理想气体的热力性质熟悉和了解:理想气体模型。
理解并掌握:理想气体状态方程及通用气体常数。
理想气体的比热。
理解并会计算:理想气体的内能、焓、熵及其计算。
理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。
5. 实际气体及蒸气的热力性质及流动问题理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。
例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。
蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。
理解并掌握:绝热节流的现象及特点6. 蒸汽动力循环理解计算:蒸气动力装置流程、朗肯循环热力计算及其效率分析。
能够在T-S图上表示出过程,提高蒸汽动力装置循环热效率的各种途径(包括改变初蒸汽参数和降低背压、再热和回热循环)。
7、制冷与热泵循环理解、掌握并会计算:空气压缩制冷循环,蒸汽压缩制冷循环的热力计算及制冷系数分析。
能够在T-S图上表示出过程,提高制冷系数和热泵系数的途径,分析热泵循环和制冷循环的区别和联系。
二、典型题解概念题:1、过热蒸汽的温度是否一定很高?未饱和水的温度是否一定很低?答:过热蒸汽、未饱和水是这样定义的,当蒸汽的温度高于其压力对应的饱和温度时称作过热蒸汽,其压力下t > ts ;当温度低于其压力对应的饱和温度t < ts 时,则工质的相态一定是液态,则称其为未饱和水。
因此,过热蒸汽不一定温度很高,未饱和水未必温度很低,它们都是相对于其环境压力所对应的饱和温度而言的状态。
2、在h-s图上,能否标出下列水和蒸汽的状态点?(1)焓为h1的未饱和水;(2)焓为h2的饱和水;(3)参数为p1、t1的湿蒸汽;(4)压力为p的干蒸汽;(5)水、汽性质相同的状态。
3、填空4、判断下列过程中那些是可逆的;不可逆的;可以是可逆的。
并扼要说明不可逆原因。
(1)对刚性容器内的水加热,使其在恒温下蒸发。
(2)对刚性容器内的水作功,使其在恒温下蒸发。
(3)对刚性容器中的空气缓慢加热,使其从50℃升温到100℃解:(1)可以是可逆过程,也可以是不可逆过程,取决于热源温度与温是否相等。
水若两者不等,则存在外部的传热不可逆因素,便是不可逆过程。
(2)对刚性容器的水作功,只可能是搅拌功,伴有摩擦扰动,因而有内不可逆因素,是不可逆过程。
(3)可以是可逆的,也可以是不可逆的,取决于热源温度与空气温度是否随时相等或保持无限小的温差。
5、绝热容器内有一定气体,外界通过容器内的叶轮向气体加入w kJ 的功。
若气体视为理想气体,试分析气体内能的内能,焓,温度,熵如何变化?答:根据热力学第一定律,外界所做的功全部转化成为内能的增量,因而内能,焓,温度均增加;该过程不可逆,熵也增加。
6、对与有活塞的封闭系统,下列说法是否正确?1) 气体吸热后一定膨胀,内能一定增加。
答:根据热力学第一定律,气体吸热可能使内能增加,也可能对外做功,或者两者同时进行;关键是吸热量能否完全转变为功,由于气体的定温膨胀过程可使得吸收的热量完全转化为功,内能不增加,所以说法错误。
2)气体膨胀时一定对外做功。
答:一般情况下,气体膨胀时候要对外做功,但当气体向真空中膨胀时候,由于外力为零,所以功也为零。
3)气体对外做功,内能一定减少。
答:根据热力学第一定律,在定温条件下,气体可以吸收热量并全部转化为功,从而保持内能不变。
7、焓的物理意义是什么?答:焓的定义式:焓=内能+流动功 H=U+pV焓的物理意义:1. 对流动工质(开口系统)工质流动时与外界传递与其热力状态有关的总能量。
2. 对不流动工质(闭口系统)仍然存在但仅是一个复合的状态参数。
8、熵的物理含义?答:定义:熵 可逆过程 物理意义:熵的变化反应可逆过程热交换的方向和大小。
系统可逆的从外界吸热,系统熵增加;系统可逆的向外界放热,系统熵减少;可逆绝热过程,系统熵不变。
9、判断下列说法对吗?系统吸热,其熵一定增大;系统放热,其熵一定减小。
答:熵变=熵流+熵产,所以,前半句对,后半句错误。
10、孤立系熵增原理是什么?怎么应用?答:孤立系统熵增原理:孤立系统内所进行的一切实际过程(不可逆过程)都朝着使系统熵增加的方向进行;在极限情况下(可逆过程),系统的熵维持不变;任何使系统熵减小的过程是不肯能。
即过程进行到某一阶段,再不能使熵增大了,也就是系统的熵值达到了最大值,就是过程进行的限度。
等号适用于可逆过程,大于号适用于不可逆过程。
表明孤立系统的熵变化只取决于系统内各过程的不可逆程度。
注意:如果涉及环境温度,由于环境是一个很大的热源,无论它吸收或者放出多少热量,都认为环境温度是不变的。
11、讨论使热由低温热源传向高温热源的过程能否实现?≥=+=g g f iso dS dS dS dS )(T Q dS δ=12、下列说法正确的在括号内划“√”,不正确划“×”。
(×)定质量系统一定是闭口系统。
(×)闭口系统不作膨胀功的过程必是等容过程。
(√)理想气体任何过程的内能变量总以Δu=∫12 c v dT进行计算。
(√) dh= c p dT只适用于理想气体、任何过程。
(×)闭口系统发生放热过程,系统的熵必减少。
(×)知道了温度和压力两个参数值,就可以确定水蒸气的状态。
(×)一切可逆机的热效率均相等。
(×)熵增可用来度量过程的不可逆性,所以熵增加的过程必是不可逆过程,(√)某理想气体经历了一个内能不变的热力过程,则该过程中工质的焓变也为零。
(×)容器中气体的压力没有变化,则安装在容器上的压力表读数也不变。
(×)水蒸气的定温过程中,能满足 q = w的关系式。
(√)在临界点上,饱和液体的焓一定等于干饱和蒸汽的焓。
(×)只要存在不可逆性就有熵产,故工质完成一个不可逆热力循环,其熵变必大于零。
(√)理想气体在 T − s 图上,其定温线就是定焓线。
(×)绝热过程必为定熵过程。
(×)公式 q = Δu + w 仅适用于闭口热力系统。
(√)闭口绝热系统的熵不可能减少。
(×)一切不可逆热机的热效率总比可逆热机的小。
(√)在一刚性容器中,理想气体绝热自由膨胀后,其温度不变。
(×)在简单朗肯循环的基础上采用再热的方法一定能提高循环热效率。
(×)制冷系数永远大于1,而制热系数可以大于1也可以小于1。
(×)供热量一定,用电炉取暖与用热泵式空调取暖耗电量一样多。
(×)从饱和液体状态汽化成饱和蒸汽状态,因为汽化过程温度未变,所以焓的变化量。
(×)若容器中气体的绝对压力保持不变,压力表上的读数就不会改变。
(×)湿饱和蒸汽的焓等于饱和水的焓加上干度乘以汽化过程中饱和水变成干饱蒸汽所吸收的热量。
(×)理想气体经历一可逆定温过程,由于温度不变,则工质不可能与外界交换热量。
13、在绝热良好的房间内,有一台设备完好的冰箱在工作,在炎热的夏天打开冰箱,人会感到凉爽,问室内温度是否会越来越低?请用热力学原理加以解释。
答:一开始,人会感到凉爽,这是由于房间内空气中的内能传递到冰箱内,而此时冰箱输入功率转化的热小于空气进入冰箱的内热能,故空气温度降低,人感到凉爽。
随着时间的进行,冰箱输入功率转化的热越来越多地进入房间空气中,空气的温度逐步回升。
这样,房间内的温度不会越来越低。
14、选择题Pdv时则此过程是( A )(1)、一热力学过程,其w= ,A. 不可逆过程.B.任意过程.C.可逆过程.D.定压过程.(2)、对于某理想气体,当温度变化时(C p-C v)是( B )的.A.变化B.不变化C.不能确定(3)、在两个恒温热源间工作的热机A、B均进行可逆循环,A机的工质为理想气体,B 机是水蒸汽,则热效率ηA和ηB( A )A.相等B. ηA>ηBC. ηA<ηBD.不能确定.(4)、在闭口绝热系中进行的一切过程,必定使系统的熵( D )A 增大.B 减少.C. 不变D. 不能确定(5)、在房间内温度与环境温度一定的条件下,冬天用热泵取暖和用电炉取暖相比,从热力学观点看( A )A.热泵取暖合理.B.电炉取暖合理.C.二者效果一样.D.不能确定.(6)、闭口系能量方程为( D )A. Q+△U+W=0B. Q+△U-W=0C. Q-△U+W=0D. Q-△U-W=0(7)、理想气体的是两个相互独立的状态参数。
( C )A.温度与热力学能B.温度与焓C.温度与熵D.热力学能与焓(8)、已知一理想气体可逆过程中,w t=w,此过程的特性为( B )A.定压B.定温C.定容D.绝热(9)、可逆绝热稳定流动过程中,气流焓的变化与压力变化的关系为( B )A. dh=-vdpB.dh=vdpC.dh=-pdvD.dh=pdv(10)、水蒸汽动力循环的下列设备中,作功损失最大的设备是( A )A.锅炉B.汽轮机C.凝汽器D.水泵(11)外界(或)环境的定义是指( D )。
A 系统边界之外的一切物体B 与系统发生热交换的热源C 与系统发生功交换的功源D 系统边界之外与系统发生联系的一切物体(12)系统平衡时的广延性参数(广延量)的特点是 ( D )。
A 其值的大小与质量多少无关B 不具有可加性C 整个系统的广延量与局部的广延量一样D 与质量多少有关,具有可加性(13)理想气体多变指数n<0的多变膨胀过程,其过程特性具有__ A __的结果A Q>0 ,ΔU>0 ,W>0B Q<0 ,ΔU<0 ,W>0C Q>0 ,ΔU<0 ,W>0D Q<0 ,ΔU>0 ,W>0(14)卡诺定理表明:所有工作于两个不同恒温热源之间的一切热机的热效率( B )。