Nuance多光谱成像系统快速使用说明-final2
- 格式:pdf
- 大小:2.89 MB
- 文档页数:4

Nikon TIRFCell Imaging Shared Resource (CISR) 742B Light Hall Quick Guide 1. Sign in to the log book.2. Turn on switches 1-4 in numerical order. The computer must be OFF before starting 1-4.∙1 is the power strip on the left wall.∙ 2 is the key on the top laser box. ∙3 is the key on the bottom laser box.∙4 is the green button on the power strip on the left and tothe back of the microscope.3. The computer should start up.4. Log in to the computer usingyour VUNetID and password.5. Start NIS -Elements software.6. Login to NIS -Elements using your first name and no password.1324561 32 45 61. There are preset layouts along the bottom of the screen for Widefield (WF), TIRF, and Bleaching. These will open the appropriate windows for each type of imaging.2. Along the top of the screen arepreset Optical Configurations . You will see all the default configurations. You may dupli-cate a configuration by right clicking. Rename for yourself, and now you are able to change this new duplicated configuration to fit your imaging needs. This new configura-tion will only be visible under your named login.3. To reuse settings from a previous image, open the image and right click within the image. You will have choice for “reuse camera settings”, “reuse acquisition settings”, or “reuse XYZ”.4.To view your image on the screen, use the green arrow “live” button on the top left. Stop with the red circle. Capture a single time point with the camera button. 5. Autoscale can be useful for viewing images when setting exposure time and laser power.6. For fast imaging, you may wish to adjust the frame size. In a live image, choose ROI. You may choose a preset size or define an ROI.7. Images may besaved as ei-ther .nd2 (Nikonformat) or TIF. Movies will save auto-matically ac-cording to your settings in the ND Acquisitionwindow.1 32 13 24 41.Choose objective (10x dry, 20x dry, or 60x Oil immersion)on left side of scope or in software. Use Nikon oil.2.Add oil to objective if using 60x TIRF lens.3.Loosen screws on stage to adjust for sample. Place samplein holder and tighten screws.4.On either side of scope, choose Coarse, Fine, or Extra Fineto move focus with focus knobs. Turn knob toward user tobring objective up.5.XY joystick also has Coarse, Fine, and Extra Fine formovement. Twist joystick to toggle between choices.132132JoystickPerfect Focus (PFS)1. To find your sample by bright light through the oculars, choose either DIC or BF from the top menu bar.2. To find your sample by fluorescence through the oculars, choose “FITC Eyes” configura-tion from top menu bar.3. Click “Spectra” to turn on widefield illumi-nation to eyes. Ensure that E100 is selected under Ti Pad under Light Path.4. You should be able to see fluorescence through the oculars. This filter show both Green and Red excitation.132 4 13 246.To visualize sample on screen, choose WF tab at bottomof software, and choose WF optical configuration at top(DAPI WF, FITC WF, TRITC WF, CY5 WF, CFP WF, YFP WF).7.Start “Live” with green arrow button.8.Focus with focus knobs on scope.9.Perfect Focus (PFS) may be used to find and hold correctfocal plane.10.Choose PFS ON button on front of scope. While thisbutton is blinking, focus with the focus knob. When PFSstops blinking, focal plane is found. Now use the PFS wheelfor fine focusing.1 32456132456JoystickPerfect Focus (PFS)81231. For live cell imaging, turn on orange power button on the incubator above the laser boxes.2. Three heaters will come to their appropriate tem-peratures. Top Heater will reach 43, Stage Heater will reach 39, and Bath Heater will reach 41. The Lens Heater needs to be switched on separately. Dicuss your needs with CISR staff.3. If not already in place, put the heated stage adap-tor in place. Use lab tape to hold in place.4. Ensure there is sufficient water in the heated stage water bath. Use dI H2O.5. Turn on the CO2 tank on the wall by the main CISR door. Turn on with the main silver knob.6. Check the CO2 indicator on the front of the incu-bator box to ensure CO2 is on.7. Although temperatures will be ready within 5-10 minutes, for optimal environmental conditions, al-low temperature and CO2 to equilibrate for 30 minutes.1231 231.Choose WF tab at the bottom of screen, and choose optical configuration at the top of the screen to match your fluorophore of interest. 2. To adjust signal, adjust Spectra % output as well as exposure time in Zyla camera window. 3. Use PFS to focus sample.4. Choose “Live ” green arrow to see image on screen.5. For single time point, click “Capture ”. Repeat for multiple channels, and merge to create multi -channel image. Merge can be found under File.6. For time -lapse acquisition, use ND Acquisition window.7. Set -up multiple channels under Wavelength. Choose each channel under Optical Configuration.8. Set -up time -lapse under Time. Choose Define. Inter-val is time between images, and Duration is total time.1 2 45 713 24 6 7 31256H-TIRFAutomated TIRF alignment in software1.Raise microscope condenser to make visualizing light easier.2.H-TIRF alignment is done in the software.3.For H-TIRF, open Ti-LAPP H-TIRF Pad.4.Adjust Angle until you see the laser spot on the wall.5.Continue adjusting until the light is overhead.6.Focus the spot to the smallest possible spot.7.Set Direction to 180.8.Adjust Angle again until you see TIRF signal on sample. You will see a bright signal andthen nothing. Adjust Angle back until see image again.9.Adjust Direction to fine tune across the best region of your sample.M-TIRFManual TIRF Alignment1.M-TIRF is done manually with adjustments on the microscope.2.Angle3.Focus4.Direction1.After finding an image by widefield, choose TIRF layout at bottom of screen and TIRF optical configuration at topof screen (488 H -TIRF, 561 M -TIRF, or General M -TIRF).In the previous sections you should have found cells and focused and adjusted TIRF angle.2. Optimize signal by adjusting laser power in the LU -NV Nidaq Pad window and exposure time in the Zyla camera window.3. For single time point, capture image with “capture” cam-era button along top of screen.4. For time -lapse imaging, open ND Acquisition window.5. First tab in ND Acquisition is for time -lapse. Interval is de-lay between images. Duration is total time -lapse. For shortest possible interval, choose “no delay” for interval.6. Choose RUN NOW in ND Acquisition window.1324561 32 45 61. Switch configuration to 561M@H -TIRF or 640M@H -TIRF on top of screen.2. Open the following 3 windows — Triggered Acquisition, ND Acquisition, and Ti -LAPP H -TIRF Pad3. For Triggered Acquisition add channel. For each channel add 3 lines —LineFilter WheelLU -NV NIDAQ Switcher .4. Choose appropriate excitation wavelength for Line .5. For 488, FilterWheel =1 and Switcher =1.6. For 561, FilterWheel =2 and Switcher =4.7. For 640, FilterWheel =3 and Switcher =4.8.Set exposure time in Triggered Acquisition window. Exposure time must be the same for both channels. 9. Set time -lapse parameters in ND Acquisition window. Open Define window.10. C heck “Enable Triggering” in Triggered Acquisition window.11. E nsure that the Lower Turret Layer in the Ti -LAPP Pad shows both H -TIRF and TIRF highlighted . 12. C lick “RUN NOW” in ND Acquisition window.1 3 24 5 6132 45661. Choose the “Bleaching” tab at the bottom of the screen.2. In addition to the TIRF set -up on the previous page, open the Bruker Miniscanner window.3. Choose laser for bleaching and set parameters (% and dwell time) in both the Bruker Miniscanner window and the LU_N4 Padwindow. 4. On right side of image window, right click on ROI icon to choose ROI shape. Draw ROI.5. Right click on ROI and choose “Use as Stimulation ROI ”.6. Set exposure time in camera window.7. Set bleaching and time -lapse in ND Sequence Acquisition window. Bleaching can be Sequential or Simultaneous (next page).12 5 34 1 2 53 47. For Sequential bleaching, set up actions in ND SequenceAcquisition window. For example, add #1 ND Acqui-sition, #2 Stimulation, #3 ND Acquisition. Open Define window for each to set interval and delay.8. For Simultaneous bleaching, set up actions in ND Se-quence Acquisition using Simultaneous Stimulation. Open Define window to set interval and delay. Stimula-tion time will be set based on ROI size and dwell time in miniscanner window. 9. For bleaching, ensure that the following buttons are active:A. Under Filters , choose Galvo on Turret 2(blue box, second from left)B. In Ti -LAPP Pad window, choose FRAP on Upper Turret LayerC. Under menu bar at top of screen, turn on AOTF. 10. RUN NOW. 1 2 43 1 24 3Check the CISR scheduling calendar to see if anyone issigned up after you. If another user is coming with 1 hour,please log out of the software, sign out in the log book, andleave the microscope and lasers ON.If no one is coming after you, follow the next steps.1.Close NIS software.2.Shut down the computer.3.Turn off power strip 4 (green)4.Turn off laser box 3 (bottom)5.Turn off laser box 2 (top).6.Turn off power strip 1 (left wall).7.Sign out in log book.e again soon!Updated 05/2016。


高光谱成像仪(版本1.1 2012-02-29)操作指南(草案试行版)1.光谱相机简介1.1.什么是光谱相机?光谱相机是一种将SPECIM的成像光谱仪和面阵单色照相机完整的结合在一起的系统。
成像光谱仪每次成目标上一条线的像,并分光使每个光谱成分对应线阵上的一个像素点。
因此,每一幅来自光谱相机的图像结构包括一个维度(空间轴)上的线阵像素和在另一个维度(光谱轴)上的光谱分布(光在光谱元素的强度),如下图所示的说明。
成像光谱仪和面阵单色照相机已经被正确的校直和固定在一起,不需要用户去调节和校直。
图1.1. 光谱照相机的工作原理。
想了解我们最新开发的光谱照相机或者其他产品,请访问我们的网站.1.2.光谱相机的成像光谱仪光谱相机的成像光谱仪使用一个新的准直(轴上)光学构造和一个体全息透射光栅。
这种构造提供高衍射效率和很好的线性光谱。
由于轴上操作引起的几何畸变和透射光学的应用引起的独立的入射光偏振。
透射光栅是人造全息在两块玻璃粘板之间的DCG(DiChormated Gelation)的上。
DCG有很高的衍射效率、较低的色散、较低的多级衍射和不产生鬼线。
由于这种材料较高的特征而普遍被用来生产光学元件。
这种全息光栅是密封的,可以承受相当大的湿度、温度范围在-20-120° C、物理撞击和振动。
典型的衍射效率如图2.1.所示。
这里所涉及的值仅供参考并且它们可能各不相同。
每个光栅都是单独测试的。
光谱照相机可用的有四个标准波段和分辨率供于选择。
光谱相机V8(380-800nm)和V9(430-900nm)的光谱范围高于一个倍频,需要加一个遮光滤波片防止二级光谱与一级光谱的尾部叠加。
图2.1.图(a) VIS(400-700nm)和VIS-NIR(450-900nm)体相位全息透射光栅的典型衍射效率。
图(b)显示体相位全息透射光栅对偏振的依赖很低,图中曲线分别是平行和垂直偏振光。
图(c)显示的是典型偏振依赖于反射光栅(对平行和垂直偏振)。

WA VESCAN操作重点提示开机须先暖机15分钟※开机后,会自动执行硬件测试,如有异常,请手动点取再测试,如重复多次测试仍无法通过,请通知工程师。
※暖机15分钟后(自行测量时间),进行假眼校正程序,操作方式于后介绍。
一次拍照(操作者自选模式)1.选择ACQUIRE功能键2.选取病人或是在需要的区域键入新的病人信息(名字,ID,何眼先测量及正确之Vertex)按NEXT键3.做病人定位,将下巴与前额靠在架子适当的位置4.请病人放轻松的看着前端的红光,不需在意红光影像的清晰模糊。
(可提醒病人想象在遥望远方的感觉)5.使用游戏杆,调整对准十字网线,对准病人瞳孔中心点,调整虹膜在focus位置6.选择AUTOFOCUS,按NEXT自动FOCUS 影像7.屏幕上的小光点必须是圆的(不是矩形或椭圆形)且是锐利的焦距●假如Hartmann-Shack(HS)光点影像不是理想的,按RESETPRECOMPENSATION并重新再按AUTOFOCUS假使AUTOFOCUS是再次测试失效,可使用MANUAL模式( 详阅操作手册的介绍)8.告诉病人眨眼(前列过程中,病人皆可任意眨眼,直到下个步骤再保持眼睛张开不动。
)(前导波为红外线雷射,勿使病人持续注视超过15分钟)9.当HS影像位置正确置中及对焦后,提醒病人保持张眼不动约3秒钟,按NEXT,即可拍照获得测量结果10.浏览Hartman Shack影像●假如不接受此影像,撤除相对应检查的功能键●选PREV去获得HS新的影像11.当满意测量的影像,按NEXT去浏览图形。
此时四个窗口将会出现,如此便可以同时浏览四个不同的图形和测量数据12.想要改变浏览的图形,选择VIEW OPTIONS键●选CUSTOM VIEW功能●选取4个窗口内想要对应浏览的图形,按下OK13.测量另外一个眼睛时,按下NEXT,重复影像获得的程序14.当测量完成时,选取PRINT OPTION功能键可以选择打印图形和数据15.选NEXT储存数据并继续下个病人三次拍照(计算机挑选模式)1.拍照方式相同,惟需事先输入最佳视矫度数、角膜K值及暗室瞳孔直径。
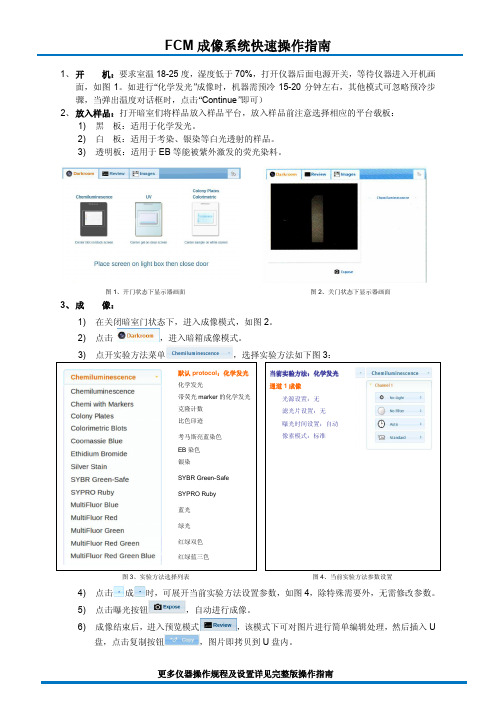
1、 开 机:要求室温18-25度,湿度低于70%,打开仪器后面电源开关,等待仪器进入开机画面,如图1。
如进行“化学发光”成像时,机器需预冷15-20分钟左右,其他模式可忽略预冷步骤,当弹出温度对话框时,点击“Continue ”即可)
2、 放入样品:打开暗室们将样品放入样品平台,放入样品前注意选择相应的平台载板:
1) 黑 板:适用于化学发光。
2) 白 板:适用于考染、银染等白光透射的样品。
3) 透明板:适用于EB 等能被紫外激发的荧光染料。
图1、开门状态下显示器画面 图2、关门状态下显示器画面 3、 成 像:
1) 在关闭暗室门状态下,进入成像模式,如图2。
2) 点击 ,进入暗箱成像模式。
图3、实验方法选择列表
图4、当前实验方法参数设置 4) 点击成时,可展开当前实验方法设置参数,如图4,除特殊需要外,无需修改参数。
5) 点击曝光按钮,自动进行成像。
6) 成像结束后,进入预览模式
,该模式下可对图片进行简单编辑处理,然后插入U
盘,点击复制按钮,图片即拷贝到U 盘内。
更多仪器操作规程及设置详见完整版操作指南。
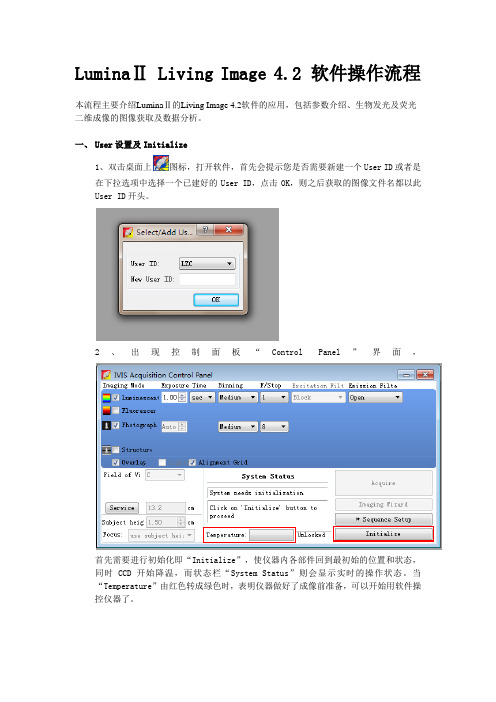
LuminaⅡ Living Image 4.2 软件操作流程本流程主要介绍LuminaⅡ的Living Image 4.2软件的应用,包括参数介绍、生物发光及荧光二维成像的图像获取及数据分析。
一、User设置及Initialize1、双击桌面上图标,打开软件,首先会提示您是否需要新建一个User ID或者是在下拉选项中选择一个已建好的User ID,点击OK,则之后获取的图像文件名都以此User ID开头。
2、出现控制面板“Control Panel”界面,首先需要进行初始化即“Initialize”,使仪器内各部件回到最初始的位置和状态,同时CCD开始降温,而状态栏“System Status”则会显示实时的操作状态。
当“Temperature”由红色转成绿色时,表明仪器做好了成像前准备,可以开始用软件操控仪器了。
二、控制面板参数介绍整个图像的获取过程都通过该控制面板操作,其中曝光时间Exposure Time、binning值及光圈大小F/Shop是最为关键的参数,直接影响图像获取的质量。
1、曝光时间(Exposure time)1)曝光时间决定了信号强度,曝光时间越长,信号强度越高,推荐的设定为0.5s—5min,若曝光5min仍未看到信号,表明动物体内确实无目标信号。
2)对于设置多少曝光时间可得到合适曝光水平的图像,软件设置了非常方便的自动曝光即Auto exposure功能,仪器会自动检测一个合适的曝光时间以成像。
自动曝光的设置只需在Exposure time选项中点击“▼”两下,即出现。
3)自动曝光工作原理:软件对曝光水平设置了阈值即Target count,为达到这个阈值,软件会对成像参数进行自动调节,点击Edit,出现Preference对话框,点击Acquisition选项。
软件首先调节First preference,若仍未达到阈值要求则继续调节Second及Third preference。
Nanophotometer Pearl 操作指南● Step1 插上电源,按 键开机。
● Step2 开机后,见如下页面:按字母数字键选择所需功能。
○1 微量级测量 (常用方法测RNA,DNA 和蛋白质) ○2 常规比色皿测量 (核酸,蛋白质,细胞浓度) ○3 其他功能 (全波长扫描,动力学测定等) ○4 用户自建方法 ○5 相关设置 (时间,打印机等) ● Step3○1 选择数字键1 进入微量级测量,如下页面:○1 核酸分析 (dsDNA, ssDNA 等)------Nucleic Acid ○2 蛋白分析 ----------------------Protein Step4○1按数字键1进入核酸分析界面Step5按数字键1进入dsDNA---双链DNA 分析Step5---第1步选择不同的Lid Factor---光程盖,有5倍、10倍、50倍、100倍、250倍可选,机器标配一般是10倍和50倍,先选50倍,如果提示浓度太低再换10倍的Step5---第2步选择右边的Units 浓度单位,一般选ng/ulStep5---第3步按绿色Sample 键进入分析界面,先用水或缓冲液点样,按Blank 键做空白校正,然后用搽镜纸把点样台和光程盖搽干净,把样品点到点样台中间的小镜子上,盖上光程盖,按绿色Sample 键3.5秒内显示测量结果Step5---第4步1、查看测量结果,左上角显示230nm 、260nm 、280nm 的吸光度,如果吸光度在0.01—1.5之间,结果是可以信赖的,在0.3是最准确的,在0.01—1.5范围之外的结果不可信赖2、左下角给出的比值如果在1.8—2.0之间说明客户提的核酸比较纯,小于1.8说明有蛋白质干扰,大于2.0说明有RNA 干扰;注:DNA :260/280=1.8---2.0,小于1.8说明有蛋白质干扰,大于2.0说明有RNA 干扰; RNA :260/280=2.0---2.5, 小于2.0说明有蛋白质干扰,大于2.5说明有寡聚RNA ; 蛋白质中所含核酸很少,对蛋白质的影响忽略不计。
想做多重免疫荧光?收好指南,教你一张片子染出七种颜色想做多重免疫荧光?需要先思考这几个问题:问题1:你认得全动物园里的动物们吗,比如大鼠,小鼠,兔,山羊,绵羊,鸡,荷兰猪(豚鼠)?不同种属的抗体需闹清楚。
问题2:你确定能分得清字母表并做得了十以内得加减法吗?有不同亚型鉴定的过的一抗,比如:IgG1,IgG2a,IgG2b,IgG2c,IgM,IgE 不知道怎能行?问题3:你确定能将动物和数字字母们对号入座,并找对门牌吗?有对应种属特异反应性的Fab 二抗,比如:F(ab')2 Fragment (避免Fc 反应性出现的非特异染色),Cross adsorbed(抗体纯化过程交叉吸附,避免物种交叉反应带来的背景)。
问题4:你确定能将重峦叠嶂移出两山排闼吗?选择合适的荧光素,明辨激发光和发射光,且不会导致荧光背景增强,比如:FITC、PE、Cy、Alexa Fluor、DyLight。
就算上面的问题你都能搞定,订购来了各种试剂,准备来了片子,你就一定能染出来多重颜色?你只是迈开了万里长征的第一步而已。
因为要得到理想的荧光实验结果,每一个步骤都需深(w ā) 度(kēng) 优(mái) 化(tǔ),固定通透方法、浓度配比、抗体共孵育、抗体稀释液、封闭条件等等。
此时,有人在你发际线还没有升高,头发还乌黑浓密的时候,在你的耳边悄悄跟你说:做多重荧光简单,有种快捷省时的方法。
先让你们随意感受一下这种方法染出来的图片:接下来我们将仔细介绍该方法实验原理和实验步骤。
多重荧光免疫组化(mIHC)实验原理上述方法采用TSA 技术(Tyramide Signal Amplification?,酪胺信号放大技术):简单来说,用该方法做多重免疫荧光是利用二抗上带有的HRP(而不是直接偶联荧光素),来催化后续添加入体系的非活性荧光素。
荧光素在HRP 和过氧化氢的作用下被活化,跟临近蛋白的酪氨酸残基共价偶联,使得蛋白样品与荧光素稳定结合。
IndiGO 2 软件操作系统使用流程1、初次采集1.1定义初个应用程序IndiGO通过界定某些应用区分不同的测量方法(例如:发光检测,荧光检测),例如:测量模式,曝光时间,测量序列和可以定义滤光片设置。
初始用户名及密码如下:Login: AdminPassword: Admin输入后出现的图片如下:首先点击按钮<Applications & Templates>开始创建一个新的应用,在<Measuring Templates> . 里边选择<New Measuring Template>,首次使用可以为你的应用建立一个名称及描述点击,进行检测条件的设置,包括发光图,白光图,荧光等,点击《add》添加需要的测量内容,如选择《Luminescence》,可进行曝光时间的设置设置完成后点击下一步,设置发射光的位置为photo,波长为560设置完成点击《finish》。
出现数据信息,如图在点击<Add>, <Photo>.进行白光图像采集的设置初始的数据为0.1ms,10%灰度,不需要更改。
下一步进行样本大小,及焦距的设置,如图,同时可以点击,进行对焦查看。
完成之后点击设置感兴趣区域,初始状态为1-1024,需要更改,设置完成后点击1.2定义初个项目设定应用后,必须创建一个项目,以便运行第一次测量,没有特殊测量的属性被定义在一个项目中,例如,用户访问权限,规模设置,样本安排等在<Project & Analysis>里面, 找到<Available Projects>. 选择<New Project >选择后图片如下,可以定义项目的名称以及评价,设置好后按Nest可以设置实验结果的名称,如加上前缀后缀,日期等。
设置完成之后点击next 在这里选择你要使用哪个application,用来执行之前的application 设置。
明场成像快速指南前提:基于Nuance多光谱成像系统的正确安装、连接和配置以及与显微镜准确校准1.启动电脑并连接Nuance的电源。
在电脑启动的过程中,Nuance进行初始化:滤光片自检时前面板上的扫描波长指示灯滚动闪烁。
当CAMERA和STATUS指示灯稳定时初始化完成,打开Nuance操作软件。
2.放置样本,显微镜调焦。
调节光路使检测光全部进入Nuance系统。
如果进行多光谱成像,将面板前方“MONO/MS”I滑块向右调节至“MSI”位置。
3.选择“Acquire>Brightfield”面板。
如不能看到“实时图像显示”(Live Stream)窗口,点击“Live”按钮以显示样本的实时图像。
4.在”Wavelength And Exposure”框中,输入期望获得样本图像的波长(使用500nm或以上波长进行调焦)。
点击“Autoexpose Mono”按钮,提高实时图像显示质量。
手动调整曝光时间方法:a)如果实时图像太暗,在“Exposure(ms)”选项增加曝光时间。
b)如果实时图像太亮或者曝光过度(出现红色像素点),减少曝光时间。
5.最大化实时图像窗口或者按“Zoom”按钮,点击实时图像(以点击位置为中心放大图像)或者在图像上选取矩形区域(将该区域图像放大),然后微调焦距。
6.根据成像区域和图像质量的要求,选择“像素合并比”(“Binning”)和“感兴趣区域”(“Region-Of-Interest(ROI)”).感兴趣区域越小;像素合并比越高;图像文件就越小。
像素合并比越高;成像灵敏度就越高,但是图像分辨率会降低。
明场成像系统默认的像素合并比是1x1.7.在“Filter/Wavelength Selection”组中对扫描波长进行“Start”,“Step”和“End”设置。
选择“Narrow”复选框时,扫描带宽是20nm,无选择时带宽为40nm。
具体参考Nuance User’s Manual。
8.点击“Autoexpose Cube”自动选择成像的曝光设置,当自动曝光完成时“Use Custom Wavelengths and Exposures“复选框为选择。
该情况适用于某一波长需要不同的的曝光时间。
9.在“Optical Density”选择框中注意“Convert To OD”复选框默认是选择的。
当该复选框为选中状态时,在获得多光谱cube前一定要先获得参考cube。
具体操作过程:a)将采集样本移出视野b)点击“Acquire Reference”按钮获得参考cubec)将样本移回视野10.点击“Acquire Cube“按钮采集设置波长范围内的数据cube。
如果你想采集当前波长下的单色快照,点击“Acquire Mono”按钮。
如果想获得当前波长下的RGB快照,点击“AutoExpose RGB”按钮再点击“Acquire RGB”。
11.当数据采集完成,数据浏览区显示一个标有代表色的图像结果。
12.点击“Save Cube”工具条图标存储数据模型,选择存储路径并输入文件名。
(建议文件名格式:项目_样本_实验人_日期及时间)。
13.选择数据cube的存储格式:a)“Image Cubes”将以CRi既定的.im3格式存储,此数据中包括硬件信息等设置信息。
b)“TIFF Cubes”将以一系列的TIFF图像的格式存储,此时每一图像的文件名会添加相应的波长信息。
14.图像分离将下页说明。
明场图像分离工作站无须连接Nuance 成像模块也可实现图像分离和数据分析1.在屏幕左边选择“Spectra”面板。
2.如果数据文件已经打开,它将在数据浏览区域显示。
如果需要打开一个文件,点击工具栏的“Load Cube”。
Cube 格式有CRi 既定格式(*.im3)和TIFF 格式(*.tif)。
3.本指南中的演示数据位于如下的文件夹:C:\Nuance Data\Images\Sample Data\ki67-20x\ki67-20x stack 4.如果实时观察窗口仍然处于打开状态,点击按钮选择光谱库中光谱样本的颜色,再在cube 显示图像上用光标在感兴趣部分划线即可。
8.光谱显示区可看到和所划每一条线对应的同颜色的光谱曲线(在“Scaling ”的下拉菜单中选择其他的光谱显示选项)。
a)该实例中,用蓝线在蓝色细胞核区域(上图中蓝色圆圈所示)划线取纯光谱样本。
通过“Zoom”按钮可以放大图片,更清楚的看到细胞核区域。
b)用绿线在被染成棕蓝色的细胞区域(上图绿色圆圈所示)划线取混合光谱样本c)如果需要可以调整光谱库中各光谱的说明标签,使之更直观。
9.上述步骤完成后,点击“Manual Compute Spectra”按钮。
10.在对话框中,选择已知光谱”Known Spectrum ”和混合光谱“Mixed Spectrum”计算纯光谱。
本实例中,选择蓝色光谱为“Known Spectrum”,选择绿色光谱为“Mixed Spectrum”。
计算得到的光谱“Computed Spectrum ”显示为红色,本例子中将颜色改为品红色。
11.点击“Transfer to Library”.12.当进行“纯光谱计算”时观察光谱曲线图。
每个点都应该有如上图所示类似的高斯曲线。
在这个示例中,“Scale”和“Fit Offset”选项为纯光谱计算都处于选择状态。
13.关闭“Manual Compute Spectra”对话框。
14.在下方图象中绿线代表的光谱已经消失取而代之的是代表棕色染料纯光谱的品红色线。
15.点击“Unmix”按钮,一个新的“Unmixed Composite”图象在原来图象右显示。
在原图象下边显示的是分离出的各种光谱的灰色图象。
示例中用ki67标记的样本分离出2张灰色图象,一种用蓝色标记外框,一种用品红色标记。
16.存储结果图像:a)选择如下菜单:“File >Save Image >Save All (As Displayed)”,b)将结果图像全部存储于数据文件目录中。
图像的存储格式为TIFF ,该格式可以在大部分的图像处理软件中打开、预览等操作。
c)选择如下菜单:“File >Save Image >Save All Images (As Unscaled Data )”。
详见:Nuance User’s Manuald)选择如下菜单:“File >Save Result Set ”,命名后,所有工作区中的文件存储至单一文件中。
17.存储“协议文件”/“光谱库文件”,以备今后实验所用:a)存储Nuance 协议文件:该文件包括光谱库文件。
,操作为:“File >Save Protocol ”。
b)存储光谱库文件操作:“File >Save Spectral Library ”。
荧光成像快速指南前提:基于Nuance多光谱成像系统的正确安装、连接和配置以及与显微镜准确校准1.根据样本选择合适的激发光和发射光滤光片,当选择长通滤光片时确保其它滤光片不会对它起到干扰作用。
激发光快门尽可能处于关闭状态以防止样本产生光漂白现象。
2.启动电脑并连接Nuance的电源。
在电脑启动的过程中,Nuance进行初始化:滤光片自检时前面板上的扫描波长指示灯滚动闪烁。
当CAMERA和STATUS指示灯稳定时初始化完成,打开Nuance操作软件。
3.放置样本,显微镜调焦。
调节光路进行使检测光全部进入Nuance系统。
如果进行多光谱成像,将前面板上“MONO/MSI”滑块调节至“MSI”一侧。
4.选择“Acquire>Fluorescence”面板。
如不能看到“实时图像显示”(“Live Stream”)窗口,点击“Live”按钮以显示样本的实时图像。
5.在”Wavelength And Exposure”中,输入期望获得样本图像的波长(使用500nm或以上波长进行调焦),输入的波长应该在使用的发射光滤光允许范围以内。
点击“Autoexpose Mono“按钮,提高实时图像显示质量。
手动调整曝光时间方法:a)如果实时图像太暗,在“Exposure(ms)”选项增加曝光时间。
b)如果实时图像太亮或者曝光过度(出现红色像素点),减少曝光时间。
6.最大化实时图像窗口或者按“Zoom”按钮,点击实时图像(以点击位置为中心放大图像)或者在图像上选取矩形区域(将该区域图像放大),然后微调焦距。
7.根据成像区域和图像质量的要求,选择“像素合并比”(“Binning”)和“感兴趣区域”(“Region-Of-Interest(ROI)”).感兴趣区域越小,像素合并比越高;图像文件就越小。
像素合并比越高成像灵敏度就越高,但是图像分辨率会降低。
荧光成像系统默认的像素合并比是2x2。
8.在“Filter/Wavelength Selection”组中,选择与已经选定的滤光片组对应的滤光片选项。
如没有发现适用于样本的滤光片选项,可以手动编辑“Start”,“Step”和“End”设置。
具体参考Nuance User’s Manual9.“Narrow”复选框对扫描带宽进行选择:选择“Narrow”时,扫描带宽为20nm。
没有选择“Narrow”时,带宽为40nm。
10.点击“Autoexpose Cube”自动选择图像的曝光设置11.为采集均匀发光的结果,选择“Flat Field”复选框。
将样本移出视野,放入一个塑料的荧光载玻片(不包含在产品里)。
点击“Acquire Ref.Image”获得各个波长下的参照图像,最后再将样本放回。
12.点击“Acquire Cube”按钮获得设定波长范围内的数据cube(采集当前波长下的单色快照,单击“Acquire Mono”按钮)。
13.数据采集完成时,数据浏览区域显示一个标有代表色的图像结果。
14.点击“Save Cube”工具条图标存储数据模型,选择存储路径并输入文件名。
(建议文件名格式:项目_样本_实验者_日期及时间).15.选择数据cube的存储格式:a)“Image Cubes”将以CRi既定的.im3格式存储,此时数据中包括硬件信息等设置信息。
b)“TIFF Cubes”将以一系列的TIFF图像的格式存储,此时每一图像文件名会添加相应的波长信息。
16.图像分离将在下页说明。
荧光图像分离工作站无须连接Nuance 系统也可实现图像分离和数据分析1.选择屏幕左边“Spectra”面板。
2.如果数据文件已经打开,将显示在数据浏览区域。
如果需要打开一个文件,点击工具栏的“Load Cube”。
Cube 格式有CRi 既定格式(*.im3)和TIFF 格式(*.tif)。