乙醇脱水反应动力学参数测定实验讲义
- 格式:pdf
- 大小:499.17 KB
- 文档页数:7

化工专业实验报告实验名称:固定床乙醇脱水反应研究实验姓名:邢瑞哲实验时间:2014.04.15同组人:徐晗、苟泽浩专业:化学工程与工艺组号: 3 学号: 3011207058 指导教师:实验成绩:固定床乙醇脱水反应研究实验实验报告固定床乙醇脱水反应研究实验1. 实验目的①掌握乙醇脱水实验的反应过程和反应机理特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程;②学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法;③学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布;④学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择;⑤学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
2. 实验仪器和药品实验仪器:乙醇脱水气固反应器;气相色谱及计算机数据采集和处理系统;精密微量液体泵;蠕动泵。
药品:ZSM-5型分子筛乙醇脱水催化剂;分析纯乙醇;蒸馏水。
3. 实验原理乙烯是重要的基本有机化工产品。
乙烯主要来源于石油化工,但是由乙醇脱水制乙烯在南非、非洲、亚洲的一些国家中仍占有重要地位。
乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增多的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C-H 键,需要的活化能较高,所以要在高温才有和于乙烯的生成。
目前,在工业生产方面,乙醚绝大多数是由乙醇在浓硫酸液相作用下直接脱水制得。

乙醇脱水反应实验一、实验目的1.掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、付反应的影响规律和生成的过程。
2.学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3.学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4.学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5.学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验仪器和药品及装置乙醇脱水固反应器,气相色谱及计算机数据采集和处理系统,精密微量液体泵,蠕动泵。
ZSM-5型分子筛乙醇脱水催化剂,分析纯乙醇,蒸馏水。
三、实验原理乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生成,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯。
而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H键,需要的活化能较高,所以要在高温才有乙烯的生成。
乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。
本实验采用ZSM -5分子筛为催化剂,在固定床反应器中进行乙醇脱水反应研究,通过改变反应的进料速度,可以得到不同反应条件下的实验数据,通过对气体和液体产物的分析,可以得到在一定反应温度条件下的反应最佳工艺条件和动力学方程。
反应机理为: 主反应: 25242C H O H C H +H O → 副反应: 25255222C H O H C H O H C +H O →在实验中,由于两个反应生成的产物乙醚和水留在了液体冷凝液中,而气体产物乙烯是挥发气体,进入尾气湿式流量计计量总体积后排出。

一、实验目的1、巩固所学的有关动力学方面的知识;2、掌握获得的反应动力学数据的方法和手段;3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值;4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇脱水属于平等反应。
既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
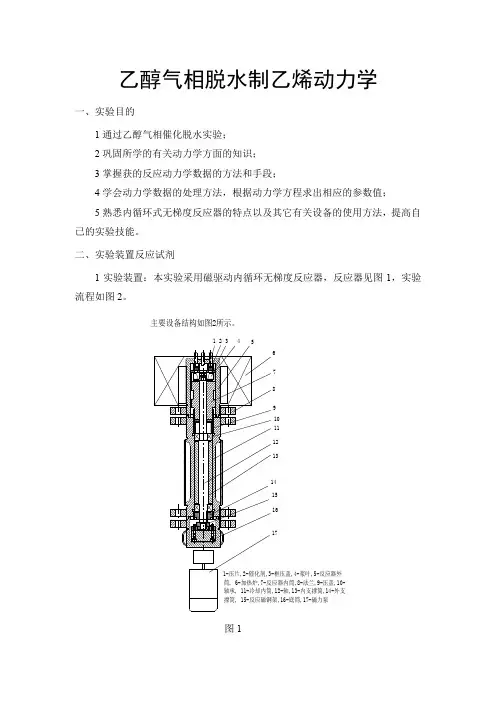
三、实验装置及流程1.实验装置图7-1 反应器装置图装置由三部分组成:第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统;第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。
2.实验流程如下图所示:PI 内循环无梯度反应色谱实验装置流程示意图1017TI TCI8911TIC-控温;TT-测温;PI-压力计;V1-进气截止;V2-进气预热截止阀;K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵1211V 1PI 色谱TCITCI TCI 2345613141531618K 1K 2V 2进气预热截止K 37J图7-2 内循环无梯度反应色谱实验装置流程示意图3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重0.4克。
四、实验步骤1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ;2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至160℃;3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。

乙醇脱水反应研究实验一、实验目的1. 掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2. 学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3. 学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4. 学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5. 学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验原理乙烯是重要的基本有机化工产品。
乙烯主要来源于石油化工,但是由乙醇脱水制乙烯在南非、非洲、亚洲的一些国家中仍占有重要地位.我国的辽源、苏州、兰州、南京、新疆等地的中小型化工企业由乙醇脱水制乙烯的工艺主要采用-Al2O3,虽然其活性及选择性较好,但是反应温度较高,空速较低,能耗大。
乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C-H键,需要的活化能较高,所以要在高温才有利于乙烯的生成。
乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。
现有的研究报道认为,乙醇分子内脱水可看成单分子的消去反应,分子间脱水一般认为是双分子的亲核取代反应,这也是两种相互竞争的反应过程,具体反应式如下:C2H5OH—C2H4(g)+H2O(g) (1)C2H5OH—C2H5OC2H5(g)+H2O(g) (2)目前,在工业生产方面,乙醚绝大多数是由乙醇在浓硫酸液相作用下直接脱水制得。

乙醇脱水反应研究实验一、实验目的1.掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2.学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3.学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4.学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5. 学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验仪器和药品乙醇脱水气固反应器,气相色谱及电脑数据采集和处理系统,精密微量液体泵,蠕动泵。
ZSM-5型分子筛乙醇脱水催化剂,分析纯乙醇,蒸馏水。
三、实验原理乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增多的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H 键,需要的活化能较高,所以要在高温才有利于乙烯的生成。
乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。
现有的研究报道认为,乙醇分子内脱水可看成单分子的消去反应,分子间脱水一般认为是双分子的亲核取代反应,这也是两种相互竞争的反应过程,具体反应式如下:C2H5OH〔g〕→ C2H4〔g〕+ H2O〔g〕C2H5OH〔g〕→ C2H5OC2H5〔g〕+H2O〔g〕目前,在工业生产方面,乙醚绝大多数是由乙醇在浓硫酸液相作用下直接脱水制得。

实验三简易内循环无梯度反应(乙醇气相脱水制乙烯宏观反应速率的测定)一、实验目的1.巩固所学有关反应动力学方面的知识。
2.掌握测取宏观反应动力学数据的手段和方法。
3.学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。
4.了解内循环式无梯度反应器的特点及其使用方法。
二、实验原理反学动力学描述了化学反应速率与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反应工程学科的重要组成部分。
气固相催化反应是一个多步骤的反应,它包括以下七个步骤:1.反应物分子由气流主体向催化剂的外表面扩散(外扩散);2.反应物分子由催化剂外表面向催化剂微孔内表面扩散(内扩散);3.反应物分子在催化剂微孔内表面上被吸附(表面吸附);4.吸附的反应物分子在催化剂的表面上发生化学反应,转化成产物分子(表面反应);5.产物分子从催化剂的内表面上脱附下来(表面脱附);6.脱附下来的产物分子从微孔内表面向催化剂外表面扩散(内扩散);7.产物分子从催化剂的外表面向气流主体扩散。
这七个步骤可分为物理过程和化学过程。
其中步骤1、2、6、7为物理扩散过程,步骤3、4、5为化学过程。
在化学过程中,步骤3、步骤5分别为化学吸附和化学脱附过程,步骤4为表面化学反应过程。
整个反应的总速率取决于这7个步骤中阻力最大的一步,该步骤称为反应的速率控制步骤。
如果步骤1或7为控制步骤,称反应为外扩散控制反应;如果步骤2或6为控制步骤,称反应为内扩散控制反应;如果步骤3、4或5的任何一步为控制步骤,称反应过程为反应控制或动力学控制。
在考虑以上所有步骤的影响的反应速率为为宏观反应速率,在消除了传递过程(包括热量传递和质量传递)的影响的理想情况下,测得的化学反应的反应速率为相应反应的本征反应速率。
在实际反应过程中,由于固体催化剂一般都具有很大的内表面,反应物质通过扩散达到催化剂内部的不同深度进行反应,因而导致常常具有浓度梯度和温度梯度,而这个浓度梯度和温度梯度对催化反应影响一般很大,因此需要了解催化剂颗粒内表面的浓度和温度梯度,即内扩散对总反应速率的影响。

乙醇脱水反应研究实验一、实验目的1.掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2.学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3.学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4.学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5. 学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验仪器和药品乙醇脱水气固反应器,气相色谱及电脑数据采集和处理系统,精密微量液体泵,蠕动泵。
ZSM-5型分子筛乙醇脱水催化剂,分析纯乙醇,蒸馏水。
三、实验原理乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增多的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H 键,需要的活化能较高,所以要在高温才有利于乙烯的生成。
乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。
现有的研究报道认为,乙醇分子内脱水可看成单分子的消去反应,分子间脱水一般认为是双分子的亲核取代反应,这也是两种相互竞争的反应过程,具体反应式如下:C2H5OH〔g〕→ C2H4〔g〕+ H2O〔g〕C2H5OH〔g〕→ C2H5OC2H5〔g〕+H2O〔g〕目前,在工业生产方面,乙醚绝大多数是由乙醇在浓硫酸液相作用下直接脱水制得。

乙醇脱水反应研究实验一、实验目的1.掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2.学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3.学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4.学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5.学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验原理1.实验仪器和药品:乙醇脱水固定床反应器,精密微量液体泵,蠕动泵,锥形瓶,烧瓶。
气相色谱仪GC−910及计算机数据采集和处理系统:载气1柱前压:0.06MPa载气流量:36ml/min载气2柱前压:0.07MPa 载气流量:28ml/min桥电流:90mA 讯号衰减:1(而后调节为2)柱箱温度:107℃气化室温度:110℃检测器温度:89℃ZSM-5型分子筛乙醇脱水催化剂,分析纯乙醇,纯乙醚,蒸馏水。
2.反应机理:乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H键,需要的活化能较高,所以要在高温才有乙烯的生成。
反应式如下:主反应:C2H5OH→C2H4+H2O副反应:2C2H5OH→C2H5OC2H5+H2O3.催化机理:ZSM-5分子筛,因其具有亲油疏水性,在催化脱水性能方面更具有优势。

乙醇脱水实验报告材料5) 依次进行错误!未找到引用。
的吸附,错误!未找到引用。
在表面上的反应生成产物分子,产物分子自表面解吸,这个过程称为表面反应过程;6) 产物分子由颗粒内表面扩散到外表面;7) 产物分子由外表面扩散到气相主体;从以上过程可以看出,气固相催化反应的反应速率由以下三个方面共同决定:1) 外扩散速率:可用费克第一定律描述,与气相主体和颗粒表面的浓度差和分子扩散系数有关;2) 内扩散速率:与内扩散有效因子,颗粒表面与活性中心处的浓度精彩文档.实用标准文案差有关;3) 表面反应速率:由反应本征动力学决定;、外扩散有效因子可以通过计算内扩算有效因子对于不同的催化剂,及总有效因子 ?得到扩散对反应速率的影响。
当空速较小时,气相主体浓度o较低,内、外扩散都有影响,反应速率低;当空速 (本实验中通过乙醇流速反应 ) 增大时,外扩散影响逐渐减少,内扩散其主要作用;当空速进一步增大时,内外扩散影响均可忽略,反应本征动力学是主要作用,因此,增大空速,对反应速率的影响较小,只能通过改变温度、压力才能使转化率进一步提高。
反应机理如下:主反应:C HOH → CH + HO (1) 24225副反应:CHOH → CHOCH +HO (2)2525252在实验中,由于两个反应生成的产物乙醚和水留在了液体冷凝液中,而气体产物乙烯是挥发气体,进入尾气湿式流量计计量总体积后排出。
对于在相同的反应温度,不同的进样量下,稳态反应30分钟,研究进样量对反应转化率,收率及选择性的影响,为工程实践中选择合适的空时(或空速)提供依据。
四、实验流程图精彩文档.实用标准文案五、实验步骤1.按照实验要求,将反应器加热温度设定为270℃。
设置乙醇的加料速度为1.2ml/min,开始加入乙醇;2.反应进行30分钟后,正式开始实验。
打开气液分离器旋塞,放出液体倒入回收瓶,记录湿式流量计读数,而后关闭旋塞。
每隔10min记录反应温度、预热温度和炉内温度等实验条件;精彩文档.实用标准文案3.每个加料速度下反应30分钟。

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:化工、班姓名:、学号、同组者姓名:指导教师:杨春风日期:2012年3月8日一、实验目的1.巩固所学的有关动力学方面的知识。
2.掌握获得反应动力学数据的方法和手段。
3.学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
4.熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC 2H5OH→C2H4+H2O三、实验装置及流程实验装置:无梯度反应器试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,重3.0克。
内循环无梯度反应色谱实验装置流程示意图四、实验步骤开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可按实验步骤进行实验。
1.打开H2钢瓶使柱前压达到0.5kg/cm2确认色谱检测中截气通过后启动色谱,柱温110℃,气化室130℃,检测室温达到120℃,待温度稳定后,打开热导池—微电流放大器开关,桥电流至100mA。
2.在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至150℃。
3.打开反应器温度控制器开关,升温,同时向反应器冷却水夹套通冷却水。
4.打开微量泵,以小流量向气化器内通原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在260-360℃之间选两个温度,改变三次进料速度,测定各种条件下的数据。
五、原始实验数据(附页)六、实验数据记录及处理乙醇密度:0.79g/ml 进料速度:0.3ml/min 乙醇进料质量:3.0g计算说明:乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)反应器内乙醇的浓度:C A=P A/(R·T)式中P A为乙醇的分压;反应的总压为0.1Mpa。
实验三乙醇脱水实验三乙醇气相脱水制乙烯反应动力学(本实验学时:7×1)实验室小型管式炉加热固定床、流化床催化反应装置是有机化工、精细化工、石油化工等部门的主要设备,尤其在反应工程、催化工程及化工工艺专业中使用相当广泛。
本实验是在固定床和流化床反应器中,进行乙醇气相脱水制乙烯,测定反应动力学参数。
固定床反应器内填充有固定不动的固体催化剂,床外面用管式炉加热提供反应所需温度,反应物料以气相形式自上而下通过床层,在催化剂表面进行化学反应。
流化床反应器内装填有可以运动的催化剂层,是一种沸腾床反应器。
反应物料以气相形式自下而上通过催化剂层,当气速达到一定值后进入流化状态。
反应器内设有档板、过滤器、丝网和瓷环(气体分布器)等内部构件,反应器上段有扩大段。
反应器外有管式加热炉,以保证得到良好的流化状态和所需的温度条件。
反应动力学描述了化学反应速度与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反应工程学科的重要组成部分。
在实验室中,乙醇脱水是制备纯净乙烯的最简单方法。
常用的催化剂有:浓硫酸液相反应,反应温度约170℃。
三氧化二铝气-固相反应,反应温度约360℃。
分子筛催化剂气-固相反应,反应温度约300℃。
其中,分子筛催化剂的突出优点是乙烯收率高,反应温度较低。
故选用分子筛作为本实验的催化剂。
一、实验目的1、巩固所学有关反应动力学方面的知识。
2、掌握获得反应动力学数据的手段和方法。
3、学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。
4、熟悉固定床和流化床反应器的特点及多功能催化反应装置的结构和使用方法,提高自身实验技能。
二、实验原理乙醇脱水属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
一、实验目的1. 理解乙醇脱水反应的原理。
2. 掌握乙醇脱水实验的操作步骤。
3. 学习通过实验分析反应结果,验证实验原理。
4. 掌握实验过程中安全注意事项。
二、实验原理乙醇脱水是指乙醇分子中的氢原子和羟基(-OH)被去除,生成乙烯(C2H4)和水(H2O)的过程。
该反应在酸性催化剂的作用下进行,常用的催化剂有浓硫酸、五氧化二磷等。
反应方程式如下:\[ \text{C}_2\text{H}_5\text{OH} \xrightarrow{\text{催化剂}}\text{C}_2\text{H}_4 + \text{H}_2\text{O} \]三、实验材料与仪器1. 实验材料:- 乙醇(95%)- 浓硫酸(98%)- 乙醇钠(C2H5ONa)- 氢氧化钠(NaOH)- 碳酸钠(Na2CO3)- 碳酸钙(CaCO3)- 水浴锅- 冷凝管- 蒸馏烧瓶- 接引管- 收集瓶- 酒精灯- 温度计- 秒表2. 实验步骤:1. 将5mL乙醇加入蒸馏烧瓶中。
2. 向烧瓶中加入适量浓硫酸,搅拌均匀。
3. 将烧瓶放入水浴锅中,加热至70-80℃。
4. 观察反应现象,记录乙烯产生的速率。
5. 将反应生成的气体通过冷凝管冷却,收集在收集瓶中。
6. 将收集瓶中的气体用燃烧法检验,观察火焰颜色。
四、实验结果与分析1. 实验现象:在加热过程中,烧瓶中产生气泡,气泡逐渐增多,最终形成一股稳定的气流。
收集瓶中的气体燃烧时,火焰呈蓝色。
2. 实验结果:通过实验,我们观察到乙醇在浓硫酸催化下脱水反应生成了乙烯。
燃烧实验进一步验证了产物的存在。
五、实验讨论1. 实验过程中,温度对反应速率有显著影响。
温度越高,反应速率越快。
但在过高温度下,可能会发生副反应,影响产物的纯度。
2. 催化剂的选择对反应速率和产物纯度也有一定影响。
实验中,浓硫酸作为催化剂,具有较好的催化效果。
3. 实验过程中,注意安全操作,防止浓硫酸溅到皮肤或衣物上。
六、实验结论通过本实验,我们成功实现了乙醇的脱水反应,生成了乙烯。
乙醇气相脱水制乙烯动力学实验乙醇气相脱水制乙烯动力学实验是一个研究乙醇脱水反应动力学的实验,该实验旨在探究反应条件对反应速率的影响,从而了解反应机理和动力学规律。
以下是实验的详细步骤和数据分析。
一、实验步骤1.准备实验装置:本实验采用气相反应装置,包括反应器、加热器、温度控制器、压力控制器、冷凝器、收集瓶等。
2.准备试剂:本实验采用95%乙醇作为原料,催化剂为酸性催化剂(如硫酸或磷酸)。
3.装填催化剂:将酸性催化剂装填到反应器中,确保催化剂表面平整。
4.添加原料:将95%乙醇加入到反应器中,确保液面在催化剂表面以上。
5.启动实验:开启加热器,将反应器加热到预设的反应温度,同时开启压力控制器,保持反应压力在预设值。
6.收集数据:在实验过程中,通过冷凝器收集反应产物,并记录不同时间下的产物产量。
7.实验结束:实验结束后,关闭加热器和压力控制器,取出产物进行分析。
二、数据分析1.产物分析:通过气质联用仪(GC-MS)对产物进行分析,确定产物种类及其含量。
2.动力学参数测定:根据实验数据,采用适当的动力学模型进行拟合,求得反应速率常数、活化能等动力学参数。
3.反应机理研究:结合产物分析和动力学参数测定结果,推断反应机理。
三、实验结果与讨论1.产物分析结果:实验结果表明,乙醇气相脱水制乙烯的主要产物为乙烯和水,其中乙烯的产量随反应时间的延长而增加。
2.动力学参数测定结果:通过拟合实验数据,得到反应速率常数为k=0.05min-1,活化能为Ea=300kJ/mol。
这些参数可以用于描述乙醇气相脱水制乙烯的动力学行为。
3.反应机理研究结果:结合产物分析和动力学参数测定结果,可以推断乙醇气相脱水制乙烯的反应机理为:乙醇在酸性催化剂的作用下脱去一分子水生成乙烯和水蒸气,整个反应过程包括扩散、吸附、反应和脱附等步骤。
其中,扩散和吸附是限制反应速率的步骤,而反应和脱附则相对较快。
四、结论本实验研究了乙醇气相脱水制乙烯的动力学行为,得到了反应速率常数和活化能等动力学参数,并确定了反应机理。
一、 实验目的1. 掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2. 学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3. 学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4. 学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5. 学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、 实验原理 2.1 过程原理乙烯是重要的基本有机化工产品。
乙烯主要来源于石油化工,但是由乙醇脱水制乙烯在南非、非洲、亚洲的一些国家中仍占有重要地位.我国的辽源、苏州、兰州、南京、新疆等地的中小型化工企业由乙醇脱水制乙烯的工艺主要采用γ-Al 2O 3为催化剂,虽然其活性及选择性较好,但是反应温度较高,空速较低,能耗大。
乙醇脱水生成乙烯和乙醚是一个吸热、分子数增不变的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C -H 键,需要的活化能较高,所以要在高温才有和于乙烯的生成。
乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。
现有的研究报道认为,乙醇分子内脱水可看成单分子的消去反应,分子间脱水一般认为是双分子的亲核取代反应,这也是两种相互竞争的反应过程,具体反应式如下:O(g)H (g)H OC H C —OH(g)H C O(l)H (g)H C —OH(g)H C 252525224252++目前,在工业生产方面,乙醚绝大多数是由乙醇在浓硫酸液相作用下直接脱水制得。
乙醇脱水反应研究实验一、实验目的1.掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目的产物的反应条件对正、副反应的影响规律和生成的过程。
2.学习气固相管式催化反应器的构造、原理和使用方法,学习反应器正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件的研究步骤和方法。
3.学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控制床层温度分布。
4.学习气体在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5.学习微量泵和蠕动泵的原理和使用方法,学会使用湿式流量计测量流体流量。
二、实验原理1.实验仪器和药品:乙醇脱水固定床反应器,精密微量液体泵,蠕动泵,锥形瓶,烧瓶。
1号气相色谱仪GC−910及1号计算机数据采集和处理系统:载气1柱前压:0.03MPa载气流量:36ml/min载气2柱前压:0.025MPa 载气流量:28ml/min桥电流:100mA 讯号衰减比:6柱箱温度:125℃气化室温度:100℃检测器温度:150℃ZSM-5型分子筛乙醇脱水催化剂,分析纯乙醇,纯乙醚,蒸馏水。
2.反应机理:乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。
提高反应温度、降低反应压力,都能提高反应转化率。
乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。
有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H键,需要的活化能较高,所以要在高温才有乙烯的生成。
反应式如下:主反应:C2H5OH→C2H4+H2O副反应:2C2H5OH→C2H5OC2H5+H2O3.催化机理:ZSM-5分子筛,因其具有亲油疏水性,在催化脱水性能方面更具有优势。
实验六 乙醇气固相脱水制乙烯动力学实验一、实验目的1、熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法。
2、通过乙醇气固相催化脱水实验,巩固所学的有关动力学方面的知识。
3、掌握内循环式无梯度(全混流)反应器的设计方程。
4、掌握利用内循环式无梯度反应器获得反应动力学数据的方法和手段,巩固动力学数据的处理方法,并可根据动力学方程求出相应的参数值。
二、实验原理本实验采用磁驱动内循环无梯度反应器,催化剂颗粒置于不锈钢筐内,不锈钢筐置于反应器内腔,反应器整体置于恒温电炉中。
由于搅拌轮的推动作用,使气流强制循环,可使反应器内的反应混合物达到理想混合,即无浓度梯度和温度梯度,物料的流动方式近于全混流。
根据全混流反应器的设计方程可知,反应物的反应速率满足式(1)。
0mol-'=,()g hA A A F X r W ⋅ (1) 其中,F A 0——进料的摩尔流率,mol/h ;X A ——反应物A 的转化率; W ——催化剂质量,g ;-r A `——反应物A 的消耗速率,mol/(g ·h)。
由此可计算出反应物的反应速率。
通过调整进料速率,可以得到不同的反应物转化率(或反应器出口浓度),从而可得出反应速率常数k 与反应级数n 。
本实验的对象为乙醇脱水反应,该反应为平行反应,乙醇进行分子内脱水成乙烯,同时可能分子间脱水生成乙醚,参见式(2)和式(3)。
25252522C H OH C H OC H +H O → (2)25242C H OH C H +H O → (3)一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
在给定温度压力条件下,在所述内循环无梯度反应器内,以60~80目分子筛为催化剂,在一定的乙醇进料速率下,进行乙醇脱水气固相反应。
利用六通阀对产物进行采样分析,得到各组分的色谱分析面积百分比。
利用表1所提供的校正因子按式(4)计算得出各组分的质量分数或摩尔分数。