无机材料科学基础--4位错
- 格式:ppt
- 大小:9.94 MB
- 文档页数:51



第七章固体中的扩散【例7-1】什么叫扩散?在离子晶体中有几种可能的扩散机构?氧化物晶体中哪种扩散是主要的,为什么?【解】固体中的粒子(原子、离子或分子)由浓度高处迁移至浓度低处的现象称为扩散。
离子晶体中有五种可能的扩散机构:易位扩散、环形扩散、间隙扩散、准间隙扩散、空位扩散。
氧化物晶体中空位扩散是最主要的扩散,原因:空位扩散所需活化能最小。
【例7-2】试说明扩散系数的定义、物理意义及量纲。
【解】扩散系数:表征物质扩散本领大小的一个重要参量,是物质的一个多性指标。
物理意义:单位浓度梯度、单位时间内通过单位面积所扩散的物质的量。
量纲:L2T-1(cm2/秒)【例7-3】试分析具有肖特基缺陷的晶体中阴离子的扩散系数小于阳离子的扩散系数的原因。
【解】在晶体中,阴离子半径较大,还常作密堆积,形成结构骨架。
阳离子的半径较小,填充于空隙中。
则阳离子的肖氏缺陷(空位)的(形成能及)迁移能小于阴离子空位的(形成能及)迁移能。
由式中::缺陷形成能:缺陷迁移能因为Q增大所以D减小()Q阳<Q阴则D阳离子>D阴离子【例7-4】扩散系数与哪些因素有关?为什么?为什么可以认为浓度梯度大小基本上不影响D值,但浓度梯度大则扩散得快又如何解释?【解】影响扩散系数D的因素:(1)T增大,D增大;Q增大,D减小;(2)扩散物质的性质:扩散粒子性质与扩散介质性质间差异越大,D值越大。
扩散粒子半径越小,D值越大。
(3)扩散介质的结构:结构越致密,D越小。
(4)位错、晶界、表面:处于位错、晶界、表面处的质点,D较大。
D表面(10-7cm2/s)>D晶界(10-10 cm2/s)>D内部(10-14 cm2/s)(5)杂质(第三组元):第三组元与扩散介质形成化合物——对扩散离子产生附加键力,则D减小。
第三组元不与扩散介质形成化合物——使扩散介质晶格产生畸变,则D增大。
(6)粘度:r减小D增大式中:T—温度r—扩散粒子半径η—扩散介质系数η增大D减小即;扩散介质粘度越大,D越小。

第一章一、是非题:1、在物体诸态中,晶体是最稳定的。
2、空间群包含了宏观晶体中全部要素的总和以及它们相互间的结合关系。
3、离子晶体的结构取决于其正负离子半径之比。
4、空间点阵中按平行六面体选取原则所得到的空间格子的基本单位称为晶胞。
5、六方紧密堆积的原子密排面是晶体中的(001)面。
6、聚形均为闭形。
7、在单质晶体中,原子作等大球体的紧密堆积,不论是六方还是立方其每个原子的配位数CN=12。
8、阳离子在配位数相同的情况下,其配位多面体形状都是完全相同的。
9、八面体空隙的空间小于四面体空隙的空间。
10、立方晶系的单位平行六面体参数为a 0≠b 0≠c 0,α=β=900,γ=1200。
二、选择题1、下列性质中 不是晶体的基本性质。
A 、对称性B 、有限性C 、均一性D 、各向异性 2、点群L 6PC 属 晶族 晶系。
A 、高级等轴B 、高级六方C 、中级六方D 、低级正交 3、在Si —O 四面体中,一般采用 方式相连。
A 、共顶 B 、共面 C 、共棱 D 、不确定 4、晶体结构中一切对称要素的集合称为 。
A 、对称性B 、点群C 、微观对称要素的集合D 、空间群5、晶体在三结晶轴上的截距分别为2a 、3b 、6c 。
该晶面的晶面指数为 。
A 、(236) B 、(326) C 、(321) D 、(123)6、依据等径球体的堆积原理得出,六方密堆积的堆积系数 面心立方堆积的堆积系数。
A 、大于 B 、小于 C 、等于 D 、不确定7、晶体中具有方向性的化学键为 。
A 、共价键B 、离子键C 、金属键D 、分子键8、某晶体AB ,A —的电荷数为1,A —B 键的S=1/6,则A +的配位数为 。
A 、4 B 、6 C 、8 D 、129、某晶体ABO 3,B —O 键的S=2/3,在单位晶胞中,A 2+的个数为8,B 4+的个数为1,则A 2+的配位数为 。
A 、4B 、6C 、8D 、1210、在单位晶胞的NaCl 晶体中,其八面体空隙和四面体空隙的数量分别为 。

无机材料科学与基础1.名词解释二八面体:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体结构。
三八面体:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三八面体结构。
稳态扩散:扩散质点浓度不随时间变化。
不稳态扩散:扩散质点浓度随时间变化,扩散通量与位置有关。
互扩散:有浓度差的空间扩散。
自扩散:没有浓度差的扩散。
顺扩散:由高浓度区向低浓度区的扩散叫顺扩散,又称下坡扩散。
逆扩散:由低浓度区向高浓度区的扩散叫逆扩散,又称上坡扩散。
本征扩散:不含有不含有任何杂质的物质中由于热起伏引起的扩散。
非本征扩散:非热能引起,如由杂质引起的扩散。
刃型位错:滑移方向与位错线垂直的位错称为刃型位错。
螺型位错:位错线与滑移方向相互平行的位错称为螺型位错热缺陷:在没有外来原子时,当晶体的热力学温度高于0K时,由于晶格内原子热振动,使一部分能量较大的原子离开正常的平衡位置,造成缺陷,这种由于原子热振动而产生的缺陷称为热缺陷。
杂质缺陷:由于杂质进入晶体而产生的缺陷。
点缺陷:在三维方向上尺寸都很小(远小于晶体或晶粒的线度)的缺陷。
线缺陷:是指晶体内部结构中沿着某条线(行列)方向上的周围局部范围内所产生的晶格缺陷。
它的表现形式主要是位错。
弗兰克尔缺陷:在晶格内原子振动时,一些能量足够大的原子离开平衡位置后,进入晶格点的间隙位置,变成间隙原子,而在原来的位置上形成一个空位,这样的缺陷称为弗兰克尔缺陷。
肖特基缺陷:如果正常格点上的原子,热起伏过程中获得能量离开平衡位置,跳跃到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
类质同晶:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其他离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
一致熔融化合物:是一种稳定的化合物,它与正常的纯物质一样具有固定的熔点,熔化时所产生的液相与化合物组成一致,故称一致熔融化合物。

名师整理优秀资源4.1 名词解释(a)弗伦克尔缺陷与肖特基缺陷;(b)刃型位错和螺型位错解:(a)当晶体热振动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗伦克尔缺陷。
如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(b)滑移方向与位错线垂直的位错称为刃型位错。
位错线与滑移方向相互平行的位错称为螺型位错。
4.2试述晶体结构中点缺陷的类型。
以通用的表示法写出晶体中各种点缺陷的表示符号。
试举例写出CaCl2中Ca2+置换KCl中K+或进入到KCl间隙中去的两种点缺陷反应表示式。
解:晶体结构中的点缺陷类型共分:间隙原子、空位和杂质原子等三种。
在MX晶体中,间隙原子的表示符号为MI或XI;空位缺陷的表示符号为:VM或VX。
如果进入MX晶体的杂质原子是A,则其表示符号可写成:AM或AX(取代式)以及Ai(间隙式)。
当CaCl2中Ca2+置换KCl中K+而出现点缺陷,其缺陷反应式如下:++2Cl CaCl Cl2CaCl2中Ca2+进入到KCl间隙中而形成点缺陷的反应式为:+2CaCl+2Cl Cl24.3在缺陷反应方程式中,所谓位置平衡、电中性、质量平衡是指什么?解:位置平衡是指在化合物MaXb中,M格点数与X格点数保持正确。
电中性是指在方程式两边应具有相同的b:X=a:M的比例关系,即.名师整理优秀资源有效电荷。
质量平衡是指方程式两边应保持物质质量的守恒。
4.4(a)在MgO晶体中,肖特基缺陷的生成能为6ev,计算在25℃和1600℃时热缺陷的浓度。
(b)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
解:(a)根据热缺陷浓度公式:(-)exp由题意△G=6ev=6×1.602×10-19=9.612×10-19JK=1.38×10-23 J/KT1=25+273=298K T2=1600+273=1873K-5110=1.92:×exp 298K-9×10=8exp1873K:(b)在MgO中加入百万分之一的Al2O3杂质,缺陷反应方程为:[ ]杂质。

4.1 名词解释(a )弗伦克尔缺陷与肖特基缺陷;(b )刃型位错和螺型位错 (c )类质同象与同质多晶解:(a )当晶体热振动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗伦克尔缺陷。
如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(b )滑移方向与位错线垂直的位错称为刃型位错。
位错线与滑移方向相互平行的位错称为螺型位错。
(c )类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
6-3 名词解释(并比较其异同)⑴晶子学说:玻璃内部是由无数“晶子”组成,微晶子是带有晶格变形的有序区域。
它们分散在无定形介中质,晶子向无定形部分过渡是逐渐完成时,二者没有明显界限。
无规则网络学说:凡是成为玻璃态的物质和相应的晶体结构一样,也是由一个三度空间网络所构成。
这种网络是由离子多面体(三角体或四面体)构筑起来的。
晶体结构网是由多面体无数次有规律重复构成,而玻璃中结构多面体的重复没有规律性。
⑵单键强:单键强即为各种化合物分解能与该种化合物配位数的商。
⑶分化过程:架状[SiO 4]断裂称为熔融石英的分化过程。
缩聚过程:分化过程产生的低聚化合物相互发生作用,形成级次较高的聚合物,次过程为缩聚过程。
⑷网络形成剂:正离子是网络形成离子,对应氧化物能单独形成玻璃。
即凡氧化物的单键能/熔点﹥0.74kJ/mol .k 者称为网络形成剂。
网络变性剂:这类氧化物不能形成玻璃,但能改变网络结构,从而使玻璃性质改变,即单键强/熔点﹤ 0.125kJ/mol .k 者称为网络变形剂。
5.1试述影响置换型固溶体的固溶度的条件。
解:1.离子尺寸因素 :从晶体稳定性考虑,相互替代的离子尺寸愈相近,则固溶体愈稳定。

名词解释弗伦克尔缺陷:在晶格热振动时,一些能量足够大的原子离开平衡位置后,挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位。
这种缺陷称为弗伦克尔缺陷。
肖特基缺陷:如果正常格点上的原子,热起伏过程中活的能量离开平衡位置迁移到晶体的表面,在晶体内正常格点上留下空位,这即是肖特基缺陷。
刃型位错:伯格斯矢量b与位错线垂直的位错称为刃型位错。
螺形位错:位错线和滑移方向(伯格斯矢量b)平行,由于位错线垂直的平行面不是水平的,而是像螺旋形的,故称螺旋位错。
类质同晶:物质结晶时,其晶体结构中原有离子或原子的配位位置被介质中部分类质类似的它种离子或原子占存,共同结晶成均匀的,单一的混合晶体,但不引起键性。
同质多晶:化学组成相同的物质,在不同的热力学条件下结晶或结构不同的晶体。
正尖晶石:二价阳离子分布在1/8四面体空隙中,三价阳离子分布在1/2八面体空隙的尖晶石。
反尖晶石:如果二价阳离子分布在八面体空隙中,而三价阳离子一半在四面体空隙中,另一半在八面体空隙中的尖晶石。
晶子学说:硅酸盐玻璃是由无数“晶子”组成,“晶子”的化学性质取决于玻璃的化学组成。
所谓“晶子”不同于一般微晶,而是带有晶格变形的有序区域,在“晶子”中心质点排列较有规律,愈远离中心则变形程度愈大。
“晶子”分散在无定形部分的过渡是逐步完成的,两者之间无明显界线。
晶子学说的核心是结构的不均匀性及进程有序性。
无规则网络学说:凡是成为玻璃态的物质和相应的晶体结构一样,也是由一个三度空间网络所构成。
这种网络是由离子多面体(三角体或四面体)构筑起来的。
晶体结构网是由多面体无数次有规律重复构成,而玻璃中结构多面体的重复没有规律性。
分化过程:架状[SiO4]断裂称为熔融石英的分化过程。
缩聚过程:分化过程产生的低聚化合物相互发生作用,形成级次较高的聚合物,次过程为缩聚过程。
网络形成剂:正离子是网络形成离子,单键强度大于335 kJ/mol,能单独形成玻璃的氧化物。


一、解释以下基本概念肖脱基空位:晶体中某结点上的原子空缺了,则称为空位。
脱位原子进入其他空位或者迁移至晶界或表面而形成的空位称为肖脱基空位弗兰克耳空位:晶体中的原子挤入结点的空隙形成间隙原子,原来的结点位置空缺产生一个空位,一对点缺陷(空位和间隙原子)称为弗兰克耳(Frenkel)缺陷。
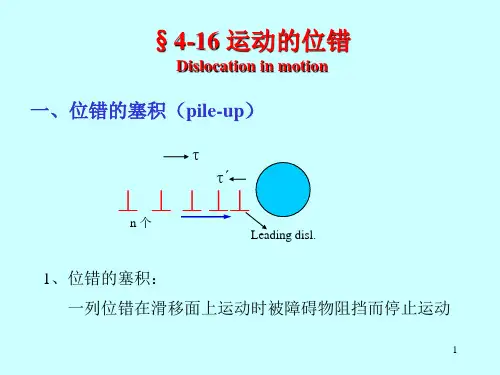
刃型位错:晶体内有一原子平面中断于晶体内部,这个原子平面中断处的边沿及其周围区域是一个刃型位错。
螺型位错:沿某一晶面切一刀缝,贯穿于晶体右侧至BC处,在晶体的右侧上部施加一切应力τ,使右端上下两部分晶体相对滑移一个原子间距,BC线左边晶体未发生滑移,出现已滑移区与未滑移区的边界BC。
从俯视角度看,在滑移区上下两层原子发生了错动,晶体点阵畸变最严重的区域内的两层原子平面变成螺旋面,畸变区的尺寸与长度相比小得多,在畸变区范围内称为螺型位错混合位错:位错线与滑移矢量两者方向夹角呈任意角度,位错线上任一点的滑移矢量相同。
柏氏矢量:位错是线性的点阵畸变,表征位错线的性质、位错强度、滑移矢量、表示位错区院子的畸变特征,包括畸变位置和畸变程度的矢量就称为柏氏矢量。
=L/υ;单位面积位错露头数ρs=N/s 位错密度:单位体积内位错线的总长度ρυ位错的滑移:切应力作用下,位错线沿着位错线与柏氏矢量确定的唯一平面滑移,位错线移动至晶体表面时位错消失,形成一个原子间距的滑移台阶,大小相当于一个柏氏矢量的值.位错的攀移:刃型位错垂直于滑移面方向的运动,攀移的本质是刃型位错的半原子面向上或向下运动,于是位错线亦向上或向下运动。
弗兰克—瑞德源:两个结点被钉扎的位错线段在外力的作用下不断弯曲弓出后,互相邻近的位错线抵消后产生新位错,原被钉扎错位线段恢复到原状,不断重复产生新位错的,这个不断产生新位错、被钉扎的位错线即为弗兰克-瑞德位错源。
派—纳力:周期点阵中移动单个位错时,克服位错移动阻力所需的临界切应力。
《无机材料科学基础》课程教学大纲课程英文名称:Fundamentals of Inorganic Materials Science课程编号:1313014002课程计划学时:72学分:4.5课程简介:《无机材料科学基础》课程是一门专业基础理论课程,适用于硅酸盐工程与无机材料科学与工程专业。
主要讲授本专业范围内各种物理化学过程的变化和共性规律,为学生学习专业课打下理论基础,是一门必修的重点课程。
本课程是在修完无机化学、物理学、物理化学、结晶矿物岩石学等课程之后,方能开设的课程。
通过本课程的学习,可以使学生了解无机材料的组成-结构-性能之间的相互关系和变化规律,为学生学习专业课程和将来从事无机材料的研究与开发奠定理论基础。
一、课程教学内容及教学基本要求绪论(1学时)要求了解无机材料的分类,特点,组成、结构、性能、工艺以及其与环境的关系。
第一章晶体结构(12学时)本章重点为晶体化学基本原理、典型晶体结构和硅酸盐晶体结构,难点为硅酸盐晶体结构。
第一节结晶学基础本节要求了解各晶系晶体定向法则与结晶符号的表示方法(考核概率0%),理解晶体的基本性质、晶胞与空间点阵的概念与区别(考核概率50%),掌握七大晶系与十四种布拉维格子的划分与特征(考核概率40%)。
1 晶体的基本概念与性质;2 晶胞与空间点阵;3 晶体的对称分类——7个晶系和14种布拉维格子;4 晶体定向与结晶学指数——晶面指数与晶向指数。
第二节晶体化学基本原理本节要求了解晶体中质点间的结合力与结合能(考核概率0%),理解球体最紧密堆积原理和影响离子晶体结构的因素(考核概率40%),掌握同质多晶和类质同晶的概念以及鲍林规则的应用(考核概率100%)1 晶体中质点间的结合力与结合能;2 晶体中质点的堆积——球体最紧密堆积原理;3 影响离子晶体结构的因素——原子半径和离子半径,配位数与配位多面体,离子极化,电负性,结晶化学定律;4 同质多晶与类质同晶;5 鲍林规则。
2-1 【2 】名词解释(a )弗伦克尔缺点与肖特基缺点;(b )刃型位错和螺型位错(c )类质同象与同质多晶解:(a )当晶体热振动时,一些能量足够大的原子分开均衡地位而挤到晶格点的间隙中,形成间隙原子,而本来地位上形成空位,这种缺点称为弗伦克尔缺点.假如正常格点上原子,热升沉后获得能量分开均衡地位,跃迁到晶体的表面,在原正常格点上留下空位,这种缺点称为肖特基缺点.(b )滑移偏向与位错线垂直的位错称为刃型位错.位错线与滑移偏向互相平行的位错称为螺型位错.(c )类质同象:物资结晶时,其晶体构造中部分原有的离子或原子地位被性质类似的其它离子或原子所占领,配合构成平均的.呈单一相的晶体,不引起键性和晶体构造变化的现象.同质多晶:同一化学构成在不同热力学前提下形成构造不同的晶体的现象.2-6(1)在CaF 2晶体中,弗仑克尔缺点形成能为2.8eV,肖特基缺点的生成能为5.5eV,盘算在25℃和1600℃时热缺点的浓度?(k =1.38×10-23J/K )(2)假如CaF 2晶体中,含有百万分之一的YF 3杂质,则在1600℃时,CaF 2晶体中时热缺点占优势照样杂质缺点占优势?解释原因.解:(1)弗仑克尔缺点形成能为2.8eV,小于肖特基缺点形成能5.5eV,所以CaF 2晶体中主如果弗仑克尔缺点,肖特基缺点可疏忽不计.-----------1分 当T =25℃=298K 时,热缺点浓度为:2423192981006.2)2981038.1210602.18.2exp()2exp(---⨯=⨯⨯⨯⨯⨯-=∆-=⎪⎭⎫⎝⎛kT G N n f ----2分当T =1600℃=1873K 时,热缺点浓度为:423191873107.1)18731038.1210602.18.2exp()2exp(---⨯=⨯⨯⨯⨯⨯-=∆-=⎪⎭⎫⎝⎛kT G N n f -----2分(2)CaF 2中含百万分之一(10-6)的YF 3时的杂质缺点反响为:CaF Ca CaF V F Y YF ''++−−→−•62223由此可知:[YF3]=2[CaV ''],所以当参加10-6YF3时,杂质缺点的浓度为:73105][21][-⨯==''YF V Ca杂--------------------1分此时,在1600℃下的热缺点盘算为:Cai Ca V Ca Ca ''+→••x x +5×10-7则:8241089.2)107.1()exp(][]][[--••⨯=⨯=∆-==''kT G k Ca V Ca f Ca Cai即:871089.21)105(--⨯=⨯+xx,x ≈8.1×10-4热缺点浓度:4101.8][-⨯=≈''xVCa热------------------1分显然:][][热杂CaCaVV''>'',所以在1600℃时是弗仑克尔热缺点占优势2-10 ZnO是六方晶系,a=0.3242nm,c=0.5195nm,每个晶胞中含2个ZnO分子,测得晶体密度分离为5.74,5.606 g/cm3,求这两种情形下各产生什么型式的固溶体?解:六方晶系的晶胞体积V===4.73cm3在两种密度下晶胞的重量分离为W1=d1v=5.74×4.73×10-23=2.72×10-22(g)W2=d2v=5.606×4.73×10-23=2.65×10-22(g)理论上单位晶胞重W==2.69(g)∴密度是d1时为间隙型固溶体,是d2时为置换型固溶体.2-12从化学构成.相构成斟酌,固溶体.化合物和机械混杂物的差别固溶体机械混杂物化合物形成原因以原子尺寸“消融”生成粉末混杂原子间互相反应生成相数平均单相多相单相平均化学计量不遵照定比定律遵照定比定律化学构成不肯定有几种混杂物就有若干化学构成肯定以AO溶质消融在B2O3溶剂中为例:比较项固溶体化合物机械混合物化学构成(x=0~2)AB2O4AO+B2O3相构成平均单相单相两相有界面3-1试简述硅酸盐熔体聚合物构造形成进程和构造特色?答:聚合物的形成是以硅氧四面体为基本单位,构成大小不同的聚合体.可分为三个阶段初期:石英的分化;中期:缩聚并伴随变形;后期:在一准时光和必定温度下,聚合息争聚达到均衡.产物中有低聚物.高聚物.三维晶格碎片以及游离碱.吸附物,最后得到的熔体是不同聚合度的各类聚合物的混杂物,构成硅酸盐构造.聚合物种类.大小和数量随熔体的构成和温度而变化3-2简述影响熔体粘度的身分?答:影响熔体粘度的重要身分:温度和熔体的构成.碱性氧化物含量增长,激烈降低粘度.随温度降低,熔体粘度按指数关系递增.3-3名词解释(并比较其异同)晶子学说和无规矩收集学说⑵单键强⑶分化和缩聚⑷收集形成剂和收集变性剂答:⑴晶子学说:玻璃内部是由很多“晶子”构成,微晶子是带有晶格变形的有序区域.它们疏散在无定形介中质,晶子向无定形部分过渡是逐渐完成时,二者没有显著界线.无规矩收集学说:凡是成为玻璃态的物资和响应的晶体构造一样,也是由一个三度空间收集所构成.这种收集是由离子多面体(三角体或四面体)修建起来的.晶体构造网是由多面体很多次有纪律反复构成,而玻璃中构造多面体的反复没有纪律性.⑵单键强:单键强即为各类化合物分化能与该种化合物配位数的商.⑶分化进程:架状[SiO4]断裂称为熔融石英的分化进程.缩聚进程:分化进程产生的低聚化合物互相产生感化,形成级次较高的聚合物,次进程为缩聚进程.⑷收集形成剂:正离子是收集形成离子,对应氧化物能单独形成玻璃.即凡氧化物的单键能/熔点﹥0.74kJ/mol.k 者称为收集形成剂.收集变性剂:这类氧化物不能形成玻璃,但能改变收集构造,从而使玻璃性质改变,即单键强/熔点﹤0.125kJ/mol.k者称为收集变形剂.3-4玻璃的构成是13wt%Na2O.13wt%CaO.74wt%SiO2,盘算非桥氧分数?解:Na2O CaO SiO2wt% 13 13 74mol 0.21 0.23 1.23mol% 12.6 13.8 73.6R=(12.6+13.8+73.6 ×2)/ 73.6=2.36∵Z=4 ∴X=2R﹣Z=2.39×2﹣4=0.72Y=Z ﹣X= 4﹣0.72=3.28 非氧桥%=Y/2+X X=0.72/(3.28×0.5+0.72) =30.5%3-5试用试验办法辨别晶体SiO 2.SiO 2玻璃.硅胶和SiO 2熔体.它们的构造有什么不同?答:应用X —射线检测.晶体SiO 2—质点在三维空间做有纪律的分列,各向异性. SiO 2熔体—内部构造为架状,近程有序,长途无序. SiO 2玻璃—各向同性.硅胶—松散多孔.3-9在SiO 2中应参加若干Na 2O,使玻璃的O/Si=2.5,此时析晶才能是加强照样减弱? 解:设参加x mol 的Na 2O,而SiO 2的量为y mol.则O/Si=(x+2y )/ y =2.5∴x=y/2 即二者的物资量比为1:2时,O/Si=2.5.因为O/Si 增长了,粘度降低,析晶才能加强了3-11有一组二元硅酸盐熔体,其R 值变化纪律如下,写出熔体一系列性质的变化纪律(用箭头表示) R =2; 2.5 ; 3 ; 3.5 ; 4 (1) 游离碱含量 (2) O/Si(3) 低聚合物数量(4) 熔体粘度 (5) 形成玻璃才能(6) 析晶才能4-5试解释粘土构造水和联合水(牢凝联合水.松联合水).自由水的差别,剖析后两种水在胶团中的感化规模及其对工艺机能的影响.解: 粘土构造水是粘土构造中的水;因为粘土颗粒一般带负电,又因水是极性分子,当粘土颗粒疏散于水中时,在粘土表面负电场的感化下,水分子以必定取向散布在粘土颗粒四周以氢键与其表面上的氧和氢氧基联合,负电端向外.在第一层水分子的外围形成一个负电表面,因而又吸引第二层水分子.负电场对水分子的引力感化,跟着分开粘土表面距离的增长而减弱,是以水分子的分列也有定向逐渐过渡到凌乱.接近内层形成的定向分列的水分子层称为牢凝联合水,环绕在粘土颗粒四周,与粘土颗粒形成一个整体,一路在介质中活动,其厚度约为3-10个水分子厚.在牢凝联合水的外围吸引着一部分定向程度较差的水分子层称为松联合水,因为分开粘土颗粒表面较远,他们之间的联合力较小.在松联合水以外的水叫自由水.联合水的密度大,热容小,界电常数小,冰点低等,在物理性质上与自由水不同.粘土和水联合的数量可以用测量修饰热来断定.粘土与这三种水联合的状况与数量将会影响粘土-水体系的工艺机能.在粘土含水量必定的情形下,若联合水削减,则自由水就多,此时粘土胶的体积减小,轻易移动,因而泥浆粘度小,流淌性好;当联合水量多时,水膜厚,利于粘土胶粒间的滑动,则可塑性好.4-7黏土胶粒疏散在水中时,因吸附层与集中层各带有相反的电荷,所以相对移动时两者之间就消失着电位差,这个电位差称电动电位或ζ-电位.其数值对黏土泥浆的稳固性有重要的感化.8-3 大小(1)离子置换才能(2)黏土的ζ-电位(3)泥浆的流淌性(4)泥浆的稳固性(5)黏土的联合水(6)泥浆的触变性(7)泥团的可塑性4-10影响粘土可塑性的身分有哪些?临盆上可以采用什么措施来进步或降低粘土的可塑性以知足成型工艺的须要?(1)含水量 ,(2)电解质,(3)颗粒大小,(4)黏土的矿物构成,(5)泥料处理工艺,(6)腐殖质含量,添加剂.(9分)工艺措施:泥料经由真空练泥消除气体;经由一准时光陈腐使水分平均;合适的腐殖质含量;添加塑化剂等办法进步瘠性物料的塑化6-1名词解释凝集体系:不含气相或气相可以疏忽的体系.介稳均衡:即热力学非均衡态,能量处于较高状况,经常消失于硅酸盐体系中.连线规矩:将一界线(或其延伸线)与响应的连线(或其延伸线)订交,其交点是该界线上的温度最高点.切线规矩:将界线上某一点所作的切线与响应的连线订交,如交点在连线上,则表示界线上该处具有共熔性质;如交点在连线的延伸线上,则表示界线上该处具有转熔性质,远离交点的晶相被回吸.不一致熔熔化合物:是一种不稳固的化合物.加热这种化合物到某一温度便产生分化,分化产物是一种液相和一种晶相,两者构成与化合物构成皆不雷同,故称不一致熔熔化合物.6-5具有不一致熔融二元化合物的二元相图〔图10-12(c)〕在低共熔点E产生如下析晶进程:L A+C,已知E点的B含量为20%,化合物C的B含量为64%.今有C1,C2两种配料,已知C1中B含量是C2中B含量的1.5倍,且在高温熔融冷却析晶时,从该二配估中析出的初相(即达到低共熔温度前析出的第一种晶体)含量相等.请盘算C1,C2的构成..解:设C2中B含量为x, 则C1中B含量为1.5x,由题意得:所以C1构成B含量为26%,C2构成B含量为17.3%.6-6 今经由过程试验测得如图6-3所示的各相图,试断定这些相图的准确性.假如有错,请指出错在何处?并解释来由.图6-3解:第一图错,B组元有一个固定的熔点,是以液相线和固相线在B侧应交于一点.第二图错,A.B组元具有一个低共熔点,是以A.B的两条液相线应交于一点.第三图错,析晶进程中,达到共熔点后,体系进入低共熔进程,从液相中析出固溶体α.β,体系进入三相均衡状况,体系的温度不能变,是以中央的那条线应与AB平行.第四图错,具有低共熔点的有限固溶体二元体系相图中γ固溶体不可能消失.第五图错,具有转熔点的有限固溶体二元体系相图中γ固溶体不可能消失.6-11 图6-6是一个未完成的具有一个不一致熔化合物并形成固溶体的二元体系相图.请依据已给出的诸点完成此相图的草图.6-7已知A,B两组分构成具有低共熔点的有限固溶体二元相图〔图10-12(i)〕.试依据下列试验数据绘制相图的大致外形:A的熔点为1000℃,B的熔点为700℃.含B为0.25mol的试样在500℃完整凝固,个中含0.733 mol初相α和0.267mol(α+β)共生体.含B为0.5mol的试样在同一温度下完整凝固,个中含0.4 mol初相α和0.6mol(α+β)共生体,而α相总量占晶相总量的50%.试验数据均在达到均衡状况时测定.解:设C点含B为x%,E点含B为y%,D点含B为z%,由题意借助杠杆规矩得关系式:解得: x=5.1% y=79.9% z=94.9%由此可肯定C.D.E三点的地位,从而绘出其草图6-23试剖析图6-11上配料点1.2.3的结晶进程,写出结晶进程的相均衡表达式(表明液.固相构成点的变化及结晶进程各阶段体系中产生的相变化和自由度数的变化).解:1点冷却析晶进程:2点冷却析晶进程:3点冷却析晶进程:图6-11 图6-126-24图6-12所示为生成一个三元化合物的三元体系相图.(1)断定三元化合物N的性质;(2)标出界线上的温降偏向(转熔界线用双箭头);(3)指出无变量点K.L.M的性质,并写出相均衡方程;(4)剖析点l.2的结晶进程,写出结晶进程的相均衡表达式.解:(1)N为不一致熔融三元化合物(2)如图所示(3)副△ACN 对应M 低共熔点副△BCN 对应L 低共熔点副△ABN 对应K 单转熔点(4)1的结晶进程:2的结晶进程:影响潮湿的身分有那些?答:⑴固体表面光滑度当真实接触角θ小于90°时,光滑度越大,表面接触角越小,就越轻易潮湿;当θ大于90°,则光滑度越大,越不利于潮湿.⑵吸附膜吸附膜的消失使接触角增大,起着阻碍感化.7-5 解释吸附的本质?答:吸附是固体表面力场与吸附分子发出的力场互相感化的成果,它是产生在固体上的.依据互相感化力的性质不同,可分为物理吸赞同化学吸附两种.物理吸附:由分子间引力引起的,这时吸附物分子与吸附剂晶格可看作是两个分立的体系.化学吸附:伴随有电子转移的键合进程,这时应把吸附分子与吸附剂晶格作为一个同一的体系来处理.什么是晶界构造?答:晶界构造是指晶界在多晶体中的外形.构造和散布.试比较硅酸盐玻璃与硼酸盐玻璃在构造与机能上的差异.答:构造差异:硅酸盐玻璃:石英玻璃是硅酸盐玻璃的基本.石英玻璃是硅氧四面体[SiO4]以顶角相连而构成的三维架状构造.因为Si—O—Si键角变动规模大,使石英玻璃中[SiO4]四面体分列成无规矩收集构造.SiO2是硅酸盐玻璃中的重要氧化物.硼酸盐玻璃:B和O瓜代分列的平面六角环的B—O团体是硼酸盐玻璃的重要基元,这些环经由过程B—O—B链连成三维收集.B2O3是收集形成剂.这种连环构造与石英玻璃硅氧四面体的不规矩收集不同,任何O—B三角体的四周空间并不完整被临接的三角体所填充,两个原子接近的可能性较小.机能差异:硅酸盐玻璃:试剂和蔼体介质化学稳固性好.硬度高.临盆办法简略等长处.硼酸盐玻璃:硼酸盐玻璃有某些优良的特征.例如:硼酐是独一能用以制作有接收慢中子的氧化物玻璃;氧化硼玻璃的转化温度比硅酸盐玻璃低得多;硼对中子射线的敏锐度高,硼酸盐玻璃作为原子反响堆的窗口对材料起屏障中子射线的感化.试解释晶粒之间的晶界应力的大小对晶体机能的影响?答:两种不同热膨胀系数的晶相,在高温燃烧时,两个相完整密合接触,处于一种无应力状况,但当它们冷却时,因为热膨胀系数不同,压缩不同,晶界中就会消失应力.晶界中的应力大则有可能在晶界上消失裂纹,甚至使多晶体决裂,小则保持在晶界内.牢凝构造水吸附在黏土矿物层间及表面的定向水分子层,它与黏土胶粒形成整体并一路移动松构造水黏土表面定向分列过度到非定向分列的水层,它处于胶粒的集中含水量低,黏度小而流淌度大的性质..一级相变:体系由一相变为另一相时,如两相的化学势相等但化学势的一级偏微商(一级导数)不相等的称为一级相变.二次再结晶:是液相自力析晶:是在转熔进程中产生的,因为冷却速度较快,被收受接管的晶相有可能会被新析出的固相包裹起来,使转熔进程不能持续进行,从而使液相进行另一个单独的析晶进程,就是液相自力析晶五相图剖析(20分)1划分副三角形;(见图)(4分)2标出各条界线上的温度变化偏向(见图);(4分)3断定各无变点的性质;E点为低共熔点,P为转熔点(4分)4写出各无变点的均衡反响式;L E=A+B+S L P+A=B+S (2分)5写出构成为M点的熔体析晶的旅程;(见图中线路) (6分)1影响集中的身分?(1)化学键(1)化学键(2)缺点(3)温度(4)杂质(5)集中物资的性质和集中介质的构造2烧结的重要传质方法有那些?剖析产生的原因是什么? (8分)答:烧结初期,晶界上气孔数量许多,此时气孔阻拦晶界移动,Vb=0.)烧结中.后期,温度掌握恰当,气孔逐渐削减.可以消失Vb=Vp,此时晶界带动气孔以正常速度移动,负气孔保持在晶界上,气孔可以应用晶界作为空位传递的快速通道而敏捷汇集或消掉.持续升温导致Vb》Vp,晶界超出气孔而向曲率中间移动,气孔包入晶体内部,只能经由过程体积集中消除,这是十分艰苦的.从实现致密化目标斟酌,晶界应带动气孔以正常速度移动,负气孔保持在晶界上,气孔可以应用晶界作为空位传递的快速通道而敏捷汇集或消掉.(1分)掌握办法:掌握温度,参加外加剂等.3影响置换型固溶体和间隙型固溶体形成的身分有哪些?解:影响形成置换型固溶体影响身分:(1)离子尺寸:15%纪律:1.(R1-R2)/R1>15%不持续.2.<15%持续.3.>40%不能形成固熔体.(2)离子价:电价雷同,形成持续固熔体. ( 3)晶体构造身分:基质,杂质构造雷同,形成持续固熔体.(4)场强身分.(5)电负性:差值小,形成固熔体.差值大形成化合物.影响形成间隙型固溶体影响身分:(1)杂质质点大小:即添加的原子愈小,易形成固溶体,反之亦然.(2)晶体(基质)构造:离子尺寸是与晶体构造的关系亲密相干的,在必定程度上来说,构造中央隙的大小起了决议性的感化.一般晶体中闲暇愈大,构造愈松散,易形成固溶体.(3)电价身分:外来杂质原子进人世隙时,必然引起晶体构造中电价的不均衡,这时可以经由过程生成空位,产生部分代替或离子的价态变化来保持电价均衡.4试剖析形成固溶体后对晶体性质的影响.解:影响有:(1)稳固晶格,阻拦某些晶型改变的产生;(2)活化晶格,形成固溶体后,晶格构造有必定畸变,处于高能量的活化状况,有利于进行化学反响;(3)固溶强化,溶质原子的溶入,使固溶体的强度. 硬度升高;(4)形成固溶体后对材料物理性质的影响:固溶体的电学.热学.磁学等物理性质也随成分而持续变化,但一般都不是线性关系.固溶体的强度与硬度往往高于各组元,而塑性则较低,5影响陶瓷烧结的重要身分有哪些?答:1.影响陶瓷烧结的重要身分有:(1)原始粉料的粒度;(2)外加剂的感化;(3)烧结温度与保温时光;(4)盐类的选择及煅烧前提;(5)氛围的影响;(6)成型压力第11页,-共11页。