【人教版】高中化学选修5知识点总结:第三章烃的含氧衍生物
- 格式:doc
- 大小:498.50 KB
- 文档页数:4

第二节 醛学习目标核心素养1.掌握乙醛的组成、结构及主要化学性质。
2.了解醛、酮在结构上的区别及醛基的检验。
3.了解丙酮的结构特点及主要性质。
4.了解甲醛对环境和人类健康的影响。
1.通过宏观实验认识乙醛的性质,运用结构决定性质的观点,从微观角度认识乙醛性质的本质。
(宏观辨识与微观探析)2.从乙醛性质出发,依据探究目的,改进实验装置,优化探究方案,运用化学实验对乙醛的性质进行探究。
(科学探究与创新意识)3.通过乙醛的特征性质,运用从特殊到一般的方法,类推其他醛类物质的化学性质,建立分析同类有机物性质的思维模型。
(证据推理与模型认知)一、醛类1.醛的结构特点及物理性质2.醛的分类3.常见的醛类别 甲醛(蚁醛) 乙醛 分子式 CH 2O C 2H 4O 结构简式 HCHO CH 3CHO 物 理 性质 颜色 无色 无色 气味 有刺激性气味有刺激性气味状态气体液体 溶解性 易溶于水,35%~40%的甲醛水溶液又称福尔马林能跟水、 乙醇等互溶【微思考】最简单的醛的结构简式是什么?醛是饱和的有机物吗?为何某些醛被称为饱和一元醛?提示:最简单的醛是甲醛,结构简式为HCHO 。
醛中的醛基可以发生加成反应,所以不能说醛是饱和的有机物。
所谓的饱和一元醛实际指的是醛的烃基是饱和的。
【教材二次开发】教材资料卡片“桂皮和杏仁中含有的醛”介绍了桂皮含肉桂醛 (),肉桂醛含有哪些官能团?其核磁共振氢谱含有几组峰?峰面积之比是多少?提示:碳碳双键、醛基 6 1∶1∶1∶1∶2∶2 二、乙醛的化学性质 1.氧化反应 (1)银镜反应。
实验操作实验现象向①中滴加氨水,现象为先出现白色沉淀后变澄清,水浴加热一段时间后,试管内壁出现一层光亮的银镜①银氨溶液配制。
a.溶液配制步骤。
在洁净的试管中加入1 mL 2%的AgNO3溶液,然后边振荡边滴加2%的稀氨水,至最初产生的沉淀恰好溶解为止。
b.发生的化学反应。
AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O②银镜反应。

一、烃的衍生物二、有机合成(2013·长安一中高二期末)2011年西安世园会期间对大量盆栽鲜花施用了诱抗素剂,以保持鲜花盛开。
诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羧基、酯基三种官能团B .1 mol 该物质在催化剂加热条件下最多可与4 mol H 2发生加成反应C .1 mol 该有机物与足量的溴水反应能消耗4 mol Br 2D .该分子中所有碳原子可能位于同一平面上【解析】 该分子含有碳碳双键、羧基和羰基三种官能团,A 项错误;1 mol 该有机物最多消耗3 mol Br 2,C 项错误;分子内部有饱和碳原子,D 项不正确;分子中三个碳碳双键和羰基能够与H2发生加成反应,—COOH中的碳氧双键不能与H2反应,B项正确。
【答案】 B醇、由于与—OH相连的基团不同,—OH受相连基团的影响也不同,这些羟基上的氢原子活性也就不同,表现在性质上也就有较大差异。
如下表:2332 ROH。
(2012·上海高考)过量的下列溶液与水杨酸(COOHOH)反应能得到化学式为C7H5O3Na的是()A.NaHCO3溶液B.Na2CO3溶液C.NaOH溶液D.NaCl溶液【解析】由于酸性:COOH>H2CO3>OH,可知水杨酸与NaHCO3溶液反应时只是—COOH作用转化为—COONa,产物的分子式为C7H5O3Na,A项正确;水杨酸与Na2CO3溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,B项错误;水杨酸与NaOH溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,C项错误;与NaCl溶液不反应,D项错误。
【答案】 A现有4种液态有机物A、B、C、D,分子式均为C3H6O2,请根据下表所给出的实验结果,判断这4种物质为何物质(写出结构简式)。
A________;B________;C________;D________。


![人教版高中化学选修5[知识点整理及重点题型梳理]_《烃的含氧衍生物》全章复习与巩固_提高](https://uimg.taocdn.com/e6c468d76294dd88d0d26b51.webp)
人教版高中化学选修5知识点梳理重点题型(常考知识点)巩固练习全章复习与巩固【学习目标】1、认识醇、酚、醛、酸、酯的典型代表物的组成、结构特点及性质,并根据典型代表物,认识上述各类物质的结构特点和性质;2、了解逆合成分析法,通过简单化合物的逆合成分析,巩固烃、卤代烃、烃的含氧衍生物的性质和转化关系,并认识到有机合成在人类生活和社会进步中的重大意义;3、能结合生产、生活实际了解烃的含氧衍生物对环境和健康可能产生的影响,讨论烃的含氧衍生物的安全使用,关注烃的含氧衍生物对环境和健康的影响。
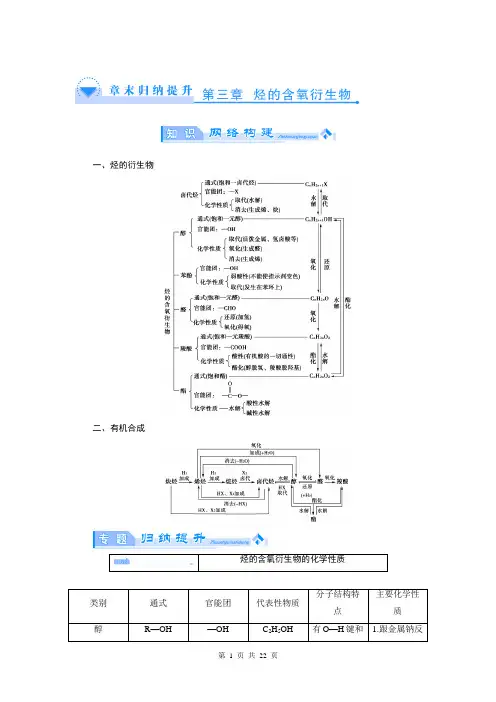
【知识网络】1.烃的衍生物的分子通式和主要性质。
2.重要的有机物之间的相互转化关系(1)烃的衍生物的相互转化关系。
(2)掌握2个碳原子的烃及烃的衍生物的相互转化(3)掌握含苯环的烃及其烃的衍生物的相互转化。
【要点梳理】要点一、官能团1、决定有机物化学特征的原子团称为官能团。
2、常见的官能团有:卤素原子(—X)、羟基(—OH)、醛基(—CHO)、羧基(—COOH)、酯基()、烯键()、炔键(—C≡C—)等。
3、有机物的官能团决定了有机物的性质。
研究有机物的性质实质上是研究有机物所具有的官能团的性质。
要点二、重要的有机化学反应类型CH 3COOH+CH 3CH 2OH∆浓硫酸CH 3COOCH 2CH 3+H 2O C −−−−→浓硫酸C 2H 5—O —C有机物加氢:CH 2=CH 2+H 2NiΔ−−→CH 3—CH 3CH 3COOH+CH 高级脂肪酸钠+甘油(皂化反应)要点三、有机合成的常规方法及解题思路有机合成题一直是高考的热点题型,也是高考的难点题型。
有机合成题的实质是根据有机物的性质,进行必要的官能团反 应,要熟练解答合成题,必须首先掌握下列知识。
1、有机合成的常规方法。
①官能团的引入。
a .引入羟基(—OH ):烯烃与水加成;醛(酮)与H 2加成;卤代烃碱性水解;酯的水解等。
b .引入卤原子(—X ):烃与X 2取代;不饱和烃与HX 或X 2加成;醇与HX 取代等。

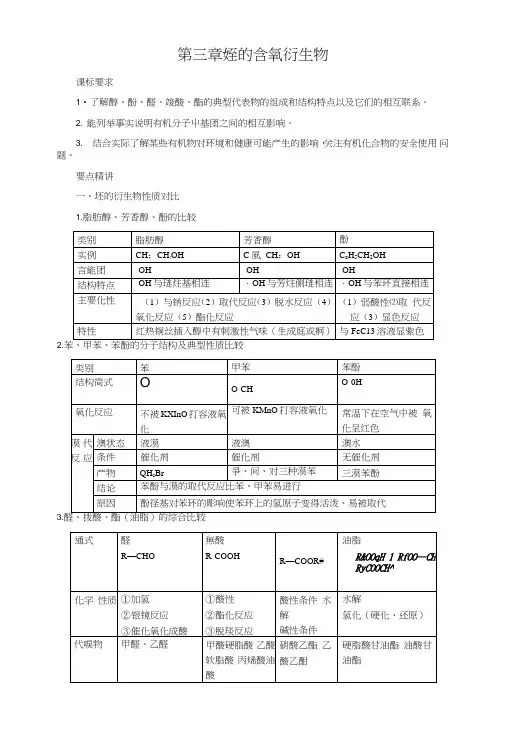
第三章姪的含氧衍生物课标要求1•了解醇、酚、醛、竣酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
2. 能列举事实说明有机分子屮基团之间的相互影响。
3. 结合实际了解某些有机物对环境和健康可能产生的影响,关注有机化合物的安全使用问题。
要点精讲一、坯的衍生物性质对比1.脂肪醇、芳香醇、酚的比较2.3.4. 绘的轻基衍生物性质比较5. 绘的拨基衍生物性质比较6. 酯化反应与屮和反应的比较酣化反应中和反应反应的过程酸脱・0H醇去・H结合生成水酸中H•与碱中0H务合生成水反应的实质分子间反应离子反应反应的速率缓慢迅遠反应的程序可逆反应可逬行彻底的反应是否需要催化剂需浓硫酸催化不需要催化剂7. 泾的衍生物的比较类别官能团分子结构特点分类主要化学性喷代卤原子(--X)碳-(3键(C-X)有极性,易断裂①氛煖、氯坯、渎怪;②一卤坯和;③饱和卤:S、不炮和(5泾和芳看茴坯①取代反应冰解反应):R- X-H2O J!型L>R-OH*HX②消去反应:R- CH:- CH:X + NaOH △ RCH= H: + NaX+ H:0均为(-0H)0H在菲承环磯原子上①脂肪醇(包括饱和薛、不论和酹);②脂环薛(如环己薛◎芳香萌(如議甲薛),④ 一元醇与多元前(如乙二誘、丙三醉)①取代反应:「与门等活泼金属反应;b・与HX反应,c・分孑间脱水:d・能化反应&化剂1②氟化反应:2R- CH:OH - 02 A 2R-CH0*2H:0③消去反应:CHjCH:OH 1WC * CH:= H: t *H:0物质结构简式轻基中氢原子活泼性乙醇苯酚乙酸CH5CH2OHGH5OHCHjCOOH酸性与钠反应与NaOH的反应与Na:CO3的反应中性能不能不能比H:CO§弱能能能强于H:CO;能能能物质结构简式乙醒CH;CHO乙酸乙酸乙酣CHsCOOCH^CHs 無基稳定性不稳定稳定—与吐加成其它性质容易不易不易醛基中C・H键易被氧化(成酸)竣基中C・0键易断裂(酣化)酣琏中C・0键易断裂(水解)二、有机反应的主要类型三、桂及其重要衍生物之间的相互转化关系加成(♦ H2O)加成(+ H20)消去(-论0)加成( + HXK2)I 还M*H2I 韜化消去(・HX)水解加成(+ HX t X2)。

人教版高中化学选修5第三章知识点人教版高中化学选修5第三章知识点(附练习)烃的含氧衍生物核心内容:1. 认识醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点,知道它们的转化关系。
2. 能列举事实说明有机分子中基团之间存在相互影响。
3. 根据有机化合物组成和结构的特点,认识加成、取代和消去反应。
4. 结合生产、生活实际了解烃的衍生物对环境和健康可能产生的影响,关注有机化合物的安全使用问题。
一、醇和酚1. 醇1) 定义:醇是羟基与烃基或苯环侧链上的碳原子相连的化合物。
根据醇分子中含有羟基的数目,可分为一元醇、二元醇和多元醇。
饱和一元醇的通式为:C n H 2n+1OH 或C n H 2n+2O ,简写为R -OH 。
C 原子数相同的饱和一元醇和饱和一元醚互为同分异构体。
2) 命名:a) 选主链:含有与羟基相连的碳原子的最长链作为主链,根据主链碳原子数称为某醇;(羟基不是链端,只是充当取代基,与醛、羧酸的命名不同,后面会介绍) b) 编号定位:从距离羟基最近的一端给主链碳原子依次编号定位。
c) 命名:羟基的位置用阿拉伯数字表示,羟基的个数用“一、二、三”表示。
如2-丙醇:3) 重要的一元醇有甲醇、乙醇等,重要的二元醇和多元醇有乙二醇、丙三醇等。
a) 饱和一元醇同系物的物理性质递变规律:i.熔沸点随C 原子数增大而升高,密度逐渐增大,与烷烃变化规律相似。
ii. 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃,原因在于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着氢键。
iii. 甲醇、乙醇和丙醇均可与水以任意比例互溶,因为它们与水形成了氢键。
b) 饱和二元醇和多元醇:乙二醇的结构简式为:丙三醇的结构简式为:乙二醇和丙三醇都是无色、黏稠、有甜味的液体,易溶于水和乙醇,是重要的化工原料。
CH 2—OH CH 2—OHCH 2—OHCH —OH CH —OHH 3C —CH —CH 3OH乙二醇可用作汽车防冻液,丙三醇有强烈吸湿性,可用于配制化妆品。

第三章烃的含氧衍生物
课标要求
1.了解醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
2.能列举事实说明有机分子中基团之间的相互影响。
3.结合实际了解某些有机物对环境和健康可能产生的影响,关注有机化合物的安全使用问题。
要点精讲
一、烃的衍生物性质对比
1.脂肪醇、芳香醇、酚的比较
2.苯、甲苯、苯酚的分子结构及典型性质比较
3.醛、羰酸、酯(油脂)的综合比较
4.烃的羟基衍生物性质比较
5.烃的羰基衍生物性质比较
6.酯化反应与中和反应的比较
7.烃的衍生物的比较
二、有机反应的主要类型
三、烃及其重要衍生物之间的相互转化关系。