常见的放热反应以及吸热反应
- 格式:doc
- 大小:137.50 KB
- 文档页数:9


常见吸热反应和放热反应类型化学反应作为一种基本的自然现象,是生命和物质变化的重要过程。
化学反应可以通过释放能量来产生热量或动力,也可以吸收能量来获得化学结构的变化。
在这篇文章中,我们将讨论常见的吸热反应和放热反应类型,并探索它们如何影响我们的日常生活。
吸热反应吸热反应是一种能量吸收化学反应,会导致反应体系的温度下降。
这种反应需要从周围环境中吸收能量,通常在可见范围内会产生明显的冷却效果。
以下是几种常见的吸热反应类型。
1. 溶解当某些物质溶解在水中时,会吸收热量来支持物质分子之间的相互作用。
这种过程可以在日常生活中观察到,比如冰块融化,会吸收热量来使冰块变成液体。
在制冷技术中,我们常用这种反应来制造低温环境。
2. 蒸发蒸发是一种吸热反应,意味着液体变为气体的过程需要吸收热量。
在日常生活中,我们经常使用这种方法来制冷。
汽车散热器中积累的热量可以通过汽车冷却液和空气之间的热交换来蒸发。
身体也通过出汗来吸收体内多余的热量,保持体温在正常范围内。
3. 化学反应在化学反应中,许多反应继续进行需要吸收热量的过程。
这种过程可以通过添加其他物质来达到控制和管理。
例如,在烟火中添加某些化学物质会在空气中释放许多光和热,形成色彩缤纷的“烟火秀”。
放热反应放热反应是一种化学反应类型,会释放热量,导致反应体系升温。
以下是几种常见的放热反应类型。
1. 燃烧反应燃烧是常见的放热反应类型之一,它通过反应中物质与氧气之间的化学反应产生热量。
这种类型的反应广泛应用于日常生活中,比如家庭供暖和炉灶烹饪。
例如,烤火腿,烟熏鱼,煮面等。
2. 氧化还原反应氧化还原反应是一种常见的放热反应类型,会引起变化的物质发生氧化或还原反应,产生热量。
在日常生活中,我们可以看到许多氧化还原反应,如燃烧,铁和氧化剂的反应等。
3. 反应放热有些物质在进行化学反应时,会产生热量并释放给周围环境。
这类反应中涉及的化学物质主要有电、光、热等,如电池电解,核裂变,太阳能等,都是反应放热类型中的常见例子。

《化学反应原理》知识点大全第一章、化学反应与能量考点1:吸热反应与放热反应1、吸热反应与放热反应的区别特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应①一切燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③等也是吸热反应;④水解反应考点2:反应热计算的依据1.根据热化学方程式计算反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算ΔH=E生成物-E反应物。
3.根据键能计算ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
第二章、化学反应速率与化学平衡考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式:___________ 。
其常用的单位是__________ 、或__________ 。
2、影响化学反应速率的因素1)内因(主要因素)反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
②活化能:如图图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。

吸热反应与放热反应放热反应:反应物总能量大于生成物总能量,化学反应放出能量,反应放热吸热反应:反应物总能量小于生成物总能量,化学反应吸收能量,反应吸热一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是放热反应。

常见的放热反应以及吸热反应常见的放热反应和吸热反应⑴常见的放热反应①燃烧反应。
如C、CO、C2H5OH等到的燃烧②酸碱中和反应。
如2KOH+H2SO4=K2SO4+2H2O③活泼⾦属与⽔或酸的反应。
如2Al+6HCl=2AlCl3+3H2↑④多数化合反应。
如Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应①多数分解反应,如CaCO3CaO+CO2↑②铵盐与碱的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O (s)=BaCl2+2NH3↑+10H2O③C(s)+H2O(g) CO+H2④CO2+C 2CO测定反应热Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热:酸碱中和反应所放出的热量中和热:在稀溶液中,酸和碱发⽣中和反应⽣成1mol⽔时的放出的热量中和热数值⼤⼩与反应物量多少⽆关焓:物质本⾝所具有的能量⽤焓来表⽰符号:H焓变△H=H ⽣成物-H反应物H<0时,为放热反应H>0时,为吸热反应影响焓及焓变⼤⼩的因素1、不同物质,H不同,△H也不同2、同⼀物质,物质的量越⼤,H也越⼤,△H也越⼤3、同⼀物质,H(⽓)> H(液)>H(固)焓变与反应热的不同:△H⼤⼩要看符号,Q的⼤⼩不看符号书写热化学⽅程式,注意以下⼏点:(1)热化学⽅程式要标明物质的状态:固体—s,液体—l,⽓体—g;⽔溶液中的溶质⽤aq表⽰(2) △H后要注明反应的温度,对于298K时进⾏的反应可以不注明温度;(3) △H单位是J·mol-1或KJ ·mol-1(4)若⽅程式中各物质系数加倍,则△H数值也加倍,若反应逆向进⾏,则符号也要变电解池与原电池有哪些异同(续)装置原电池电解池电⼦离⼦流向电⼦流向:负极→导线→正极离⼦流向:电⼦流向:电源负极→电解池阴极电解池阳极→电源正极盖斯定律对于⼀个化学反应,⽆论是⼀步完成还是分⼏步完成,其反应焓变都是⼀样的,这⼀规律称为盖斯定律。

常见的放热反应和吸热反应⑴常见的放热反应①燃烧反应。
如C、CO、C2H5OH等到的燃烧②酸碱中和反应。
如2KOH+H2SO4=K2SO4+2H2O③活泼金属与水或酸的反应。
如2Al+6HCl=2AlCl3+3H2↑④多数化合反应。
如Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应①多数分解反应,如CaCO3 CaO+CO2↑②铵盐与碱的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O (s)=BaCl2+2NH3↑+10H2O③C(s)+H2O(g) CO+H2④CO2+C 2CO测定反应热Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热:酸碱中和反应所放出的热量中和热:在稀溶液中,酸和碱发生中和反应生成1mol水时的放出的热量中和热数值大小与反应物量多少无关焓:物质本身所具有的能量用焓来表示符号:H焓变△H=H 生成物-H反应物∆H<0时,为放热反应∆H>0时,为吸热反应影响焓及焓变大小的因素1、不同物质,H不同,△H也不同2、同一物质,物质的量越大,H也越大,△H也越大3、同一物质,H(气)> H(液)> H(固)焓变与反应热的不同:△H大小要看符号,Q的大小不看符号书写热化学方程式,注意以下几点:(1)热化学方程式要标明物质的状态:固体—s,液体—l,气体—g;水溶液中的溶质用aq表示(2) △H后要注明反应的温度,对于298K时进行的反应可以不注明温度;(3) △H单位是J·mol-1或KJ ·mol-1(4)若方程式中各物质系数加倍,则△H数值也加倍,若反应逆向进行,则符号也要变盖斯定律对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,这一规律称为盖斯定律。
电解池与原电池有哪些异同(续)装置 原电池 电解池电子离子 流向电子流向: 负极 →导线→正极 离子流向: 阳离子→正极 阴离子→负极电子流向: 电源负极→电解池阴极电解池阳极→电源正极 离子流向: 阴离子→阳极 阳离子→阴极电解池与原电池①两电极接直流电源 ②电解质溶液 ③形成闭合回路①活泼性不同的两电极 ②电解质溶液③形成闭合回路形成条件 将电能转变成化学能的装置 将化学能转变成电能的装置 定义装置 实例电解池原电池装置电解池与原电池有哪些异同(续)电镀①电极: 阳极——镀层金属 阴极——待镀金属制品 ②电镀液:含有镀层金属离子的电解质溶液。

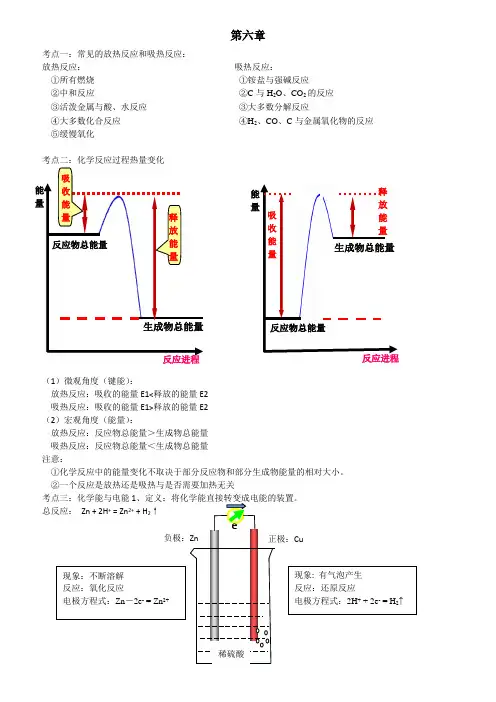
第六章考点一:常见的放热反应和吸热反应:放热反应: 吸热反应:①所有燃烧 ①铵盐与强碱反应②中和反应 ②C 与H 2O 、CO 2的反应 ③活泼金属与酸、水反应 ③大多数分解反应④大多数化合反应 ④H 2、CO 、C 与金属氧化物的反应 ⑤缓慢氧化考点二:化学反应过程热量变化(1)微观角度(键能):放热反应:吸收的能量E1<释放的能量E2 吸热反应:吸收的能量E1>释放的能量E2 (2)宏观角度(能量):放热反应:反应物总能量>生成物总能量 吸热反应:反应物总能量<生成物总能量 注意:①化学反应中的能量变化不取决于部分反应物和部分生成物能量的相对大小。
②一个反应是放热还是吸热与是否需要加热无关总反应: Zn + 2H + = Zn 2+ + H 2↑e - 反应物总能量生成物总能量 能量 反应进程 吸收能量 能量释放能量反应进程反应物总能量生成物总能量吸收能量释放能量稀硫酸负极:Zn 正极:Cu 现象:不断溶解 反应:氧化反应 电极方程式:Zn -2e - = Zn 2+ 现象: 有气泡产生 反应:还原反应 电极方程式:2H + + 2e - = H 2↑外电路:电子由负极经导线流向正极内电路:阳离子→正极;阴离子→负极2.形成原电池的条件(两极一液一回路):①两个活泼性不同的电极(金属与金属或金属与碳棒)②电解质溶液③形成闭合回路,自发进行的氧化还原反应3.氢氧燃料电池:(1)酸性燃料电池:负极:2H2-4e-= 4H+ 正极:O2 +4e- + 4H+= 2H2O(2)碱性燃料电池:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH-总反应:2H2 + O2 =2H2O4.甲烷燃料电池:(电解质为KOH)负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH-总反应:CH4+2O2+2KOH=K2CO3+3H2O练习:1.下列关于能量变化的说法,正确的是()A.等质量的红磷和白磷完全燃烧生成P2O5(s)放出的热量相同B.2Na+2H2O===2NaOH+H2,该反应生成物的总能量高于反应物的总能量C.放热反应中,反应物的总能量大于生成物的总能量D.有化学键断裂的是吸热过程,并且一定发生了化学变化2.下列反应既属于氧化还原反应,又是放热反应的是()A.铝与盐酸反应B.NaOH和HCl反应C.Ba(OH)2·8H2O与NH4Cl的反应D.CaCO3受热分解为CaO和CO23.下列变化过程,属于放热反应的是:()①NaOH固体溶于水②炸药爆炸③食物因氧化而腐败④铝热反应⑤酸碱中和反应⑥煅烧石灰石制生石灰⑦盐酸溶液中插入打磨过的铝片A.②③④⑤⑦B.①②④⑤C.②③④⑤D.①②③⑥⑦4.已知拆开1mol H–H键,1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H22NH3中,每生成2mol NH3,()A.放出92 kJ热量B.吸收92 kJ热量C.放出209kJ热量D.吸收209kJ热量5.反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。

常见的吸放热反应吸热反应放热反应:①活泼金属置换水或酸中氢的反应,如:2Na+2H2O=2NaOH+H2↑2Al+6HCl=2AlCl3+3H2↑②酸碱中和反应。
如:NaOH+HCl=NaCl+H2O2KOH+H2SO4=K2SO4+2H2O③含碳燃料燃烧的反应,如:2CO+O2=2CO2CH3CH2OH+3O2=2CO2+3H2O④易爆物质的爆炸反应。
⑤多数的化合反应,如:Na2O+H2O=2NaOHCaO+H2O=Ca(OH)2⑥一些物质的溶解,如浓硫酸的稀释、氢氧化钠的溶解、氧化钙的溶解等。
吸热反应:①几个常见的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2OC+H2O(g)=CO+H2②多数的分解反应,如:CaCO3=CaO+CO2↑CuSO4·5H2O=CuSO4+5H2O③一些物质的溶解,如硝酸铵溶解等。
常见的放热反应:1.一切燃烧,以及部分氧化(如氨气氧化)2.中和、沉淀(不全是)3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)4.特别剧烈的反应,如电石和水常见的吸热反应:1.高温下碳还原金属氧化物2.电离,水解3.多数化和,如KClO3,KMnO4,CaCO34.必须持续加热的反应,如石油裂化常见的放热反应:所有的燃烧反应(O2,Cl2中进行)酸碱中和反应金属与酸H+(H2O)铝热反应合成氨硫酸工业(接触室)2SO2+O2=(可逆)2SO3 硝酸工业制NO 4NH3+502=4NO+6H2O常见的吸热溶解吸热NH4NO3Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O大多数的分解反应C+H2O=CO+HC(制水煤气法)C+CO2=2CO(制煤气)N2+O2=2NO1、高温下碳或H2还原金属氧化物,如:C + 2CuO=高温=2Cu+ CO2↑2Fe2O3+3C=高温=4Fe+ 3CO2↑Fe3O4+2C=高温=3Fe + 2CO2↑CuO + H2 =△=Cu + H2OFe2O3+3H2=△=2Fe+3H2OFe3O4+4H2=△=3Fe+4H2OWO3+3H2=△=W +3H2OMoO3+3H2=△=Mo +3H2O2、电离反应3、盐类的水解4、CO2+C=高温=2CO C+H2O(气)=高温=CO+H25、CuO +CO=△=Cu + CO2↑6、氢氧化钡晶体与氯化铵晶体的反应THANKS !!!致力为企业和个人提供合同协议,策划案计划书,学习课件等等打造全网一站式需求欢迎您的下载,资料仅供参考。

常见的吸放热反应吸热反应放热反应:①活泼金属置换水或酸中氢的反应,如:2Na+2H2O=2NaOH+H2↑2Al+6HCl=2AlCl3+3H2↑②酸碱中和反应。
如:NaOH+HCl=NaCl+H2O2KOH+H2SO4=K2SO4+2H2O③含碳燃料燃烧的反应,如:2CO+O2=2CO2CH3CH2OH+3O2=2CO2+3H2O④易爆物质的爆炸反应。
⑤多数的化合反应,如:Na2O+H2O=2NaOHCaO+H2O=Ca(OH)2⑥一些物质的溶解,如浓硫酸的稀释、氢氧化钠的溶解、氧化钙的溶解等。
吸热反应:①几个常见的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2OC+H2O(g)=CO+H2②多数的分解反应,如:CaCO3=CaO+CO2↑CuSO4·5H2O=CuSO4+5H2O③一些物质的溶解,如硝酸铵溶解等。
常见的放热反应:1.一切燃烧,以及部分氧化(如氨气氧化)2.中和、沉淀(不全是)3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)4.特别剧烈的反应,如电石和水常见的吸热反应:1.高温下碳还原金属氧化物2.电离,水解3.多数化和,如KClO3,KMnO4,CaCO34.必须持续加热的反应,如石油裂化常见的放热反应:所有的燃烧反应(O2,Cl2中进行)酸碱中和反应铝热反应合成氨硫酸工业(接触室)2SO2+O2=(可逆)2SO3硝酸工业制NO 4NH3+502=4NO+6H2O常见的吸热溶解吸热NH4NO3Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O大多数的分解反应C+H2O=CO+HC(制水煤气法)C+CO2=2CO(制煤气)N2+O2=2NO1、高温下碳或H2还原金属氧化物,如:C + 2CuO=高温=2Cu+ CO2↑2Fe2O3+3C=高温=4Fe+ 3CO2↑Fe3O4+2C=高温=3Fe + 2CO2↑CuO + H2 =△=Cu + H2OFe2O3+3H2=△=2Fe+3H2OFe3O4+4H2=△=3Fe+4H2OWO3+3H2=△=W +3H2OMoO3+3H2=△=Mo +3H2O2、电离反应3、盐类的水解4、CO2+C=高温=2CO C+H2O(气)=高温=CO+H25、CuO +CO=△=Cu + CO2↑6、氢氧化钡晶体与氯化铵晶体的反应黄色黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄→橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加浓硝酸。

吸热反应与放热反应1、化合反应中常见的放热反应:①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO2、分解反应中多数是吸热反应①氧化铜受热分解生成氧化亚铜和氧气时吸热:4CuO高温2Cu2O+O2↑②氧化汞受热分解产生汞和氧气时吸热:2HgO 加热2Hg+O2 ↑(3)氧化性酸受热分解时吸热的实例:4HNO3(浓)加热4NO2↑+O2↑+2H2O①氢氧化镁受热分解产生氧化镁和水时吸热:Mg(OH)2加热MgO+H2O②氢氧化铝受热分解产生三氧化二铝和水时吸热:2Al(OH)3加热Al2O3+3H2O③氢氧化铁受热分解产生三氧化二铁和水时吸热:2Fe(OH)3加热Fe2O3+3H2O④氢氧化铜受热分解产生氧化铜和水时吸热:Cu(OH)2加热CuO+H2O⑤氨水受热分解产生氨气和水时吸热:NH3 ·H2O加热NH3↑+H2O①碳酸氢铵受热分解产生氨气、水和二氧化碳时吸热:NH4HCO3加热NH3↑+CO2↑+H2O②碳酸氢钠受热分解产生碳酸钠、二氧化碳和水时吸热:2NaHCO3加热Na2CO3 +CO2↑+H2O③碳酸钙高温分解产生氧化钙和二氧化碳时吸热:CaCO3高温CaO+CO2↑①硝酸钾受热分解生成亚硝酸钾和氧气时吸热:2KNO3加热2KNO2 + O2↑②硝酸镁受热分解生成氧化镁、二氧化氮和氧气时吸热:2Mg(NO3)2加热2MgO+4NO2↑+ O2↑③硝酸银受热分解生成银、二氧化氮和氧气时吸热:2AgNO3加热2Ag+2NO2↑+ O2↑(7)铵盐受热分解时吸热的实例①氯化铵受热分解产生氨气和氯化氢时吸热:NH4Cl 加热NH3↑+HCl↑②碳酸铵受热分解产生氨气、二氧化碳和水时吸热:(NH4)2CO3加热2NH3↑+CO2↑+H2O (三)、置换反应中的反热反应和吸热反应1、大多数置换反应是放热反应(1)活泼金属与水发生置换反应放热的实例①钠与水发生置换反应时放热:2Na+2H2O=2NaOH+H2↑②钾与水发生置换反应时放热:2K+2H2O=2KOH+H2↑(2)活泼非金属与水发生置换反应放热的实例①氟气与水发生置换反应时放热:2F2+2H2O=4HF+O2↑②氯气与水发生岐化反应时放热:Cl2+H2O=HCl+HClO(3)单质铝与某些金属氧化物发生的铝热反应放热的实例①在高温条件下铝粉与四氧化三铁发生置换反应时放热:8Al+3Fe3O4高温4Al2O3 +9Fe②在高温条件下铝粉与三氧化二铬发生置换反应时放热:2Al+Cr2O3高温Al2O3 + 2Cr③在高温条件下铝粉与二氧化锰发生置换反应时放热:4Al+3MnO2高温2Al2O3 + 3Mn(4)活泼金属与酸发生的置换反应放热的实例①金属钠与盐酸发生置换反应时放热:2Na+2HCl=2NaCl+H2↑②金属镁与盐酸发生置换反应时放热:Mg+2HCl=MgCl2+H2↑③金属铝与盐酸发生置换反应时放热:2Al+6HCl=2AlCl3+3H2↑2、少数置换反应是吸热放应(1)中等活泼金属与水蒸汽高温条件下反应时吸热的实例①在高温条件下铁与水蒸汽发生置换反应时吸热:3Fe+4H2O(g) 高温Fe3O4+4H2②在高温条件下铅与水蒸汽发生置换反应时吸热:3Pb+4H2O(g) 高温Pb3O4+4H2(2)还原性非金属单质碳与水蒸汽高温条件下发生置换反应时吸热的实例①在高温条件下红热炭与水蒸汽发生置换反应时吸热:C+H2O(g) 高温CO+H21、酸碱中和反应是放热反应(1)盐酸和氢氧化钠溶液反应是放热反应:HCl+NaOH=NaCl+H2O2、强碱和铵盐的复分解反应是吸热反应(1)氯化铵和熟石灰发生复分解反应时吸热:2NH4Cl+Ca(OH)2加热CaCl2 +2NH3↑+2H2O(2)氯化铵和八水合氢氧化钡发生复分解反应时吸热:2NH4Cl+Ba(OH)2·8H2O加热BaCl2 +2NH3↑+10H2O1、在相同温度和压强下,将32克硫分别在纯氧和空气中完全燃烧,设前者放热为Q1,后者放热为Q2,则关于Q1和Q2的相对大小正确的是( A )A. Q1=Q2B. Q1>Q2C. Q1<Q2D.无法判断2. 下列说法中正确的是 ( CD )A 需要加热才能发生的反应一定是吸热反应B 任何放热反应在常温条件下一定能发生反应C反应物和生成物所具有的总能量决定了放热还是吸热 D 吸热反应在一定条件下(如常温、加热等)也能发生反应3.下列反应既是氧化还原反应,又是吸收能量的化学反应的是( C )A铝片与稀盐酸的反应 B Ba(OH)2·8H2O与NH4Cl的反应 C 灼热的炭与CO2反应 D甲烷在氧气中的燃烧反应4.已知化学反应2C(s)+O2(g)点燃2CO(g),2CO(g)+O2(g)点燃2CO2都是放热反应。
常见的吸热反应和放热反应
放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2.8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
化学反应和物理反应的区别
1、反应的原理不同。
化学反应就是两种或者是两种以上的物质在一起反应以后产生了新的物质,这就叫化学变化,物理变化就是各种物质在一起的时候不产生新的变化。
2、分子种类不同。
化学反应不会改变元素的数目,反应前后的元素数目及种类是一样,不过分子(即原子组合)发生改变而已,而物理变化一般都是物质的状态改变,不改变分子种类的。
3、反应的状态范围大小不同。
化学反应必有物理反应,化学反应实际上就是一些电场作用下的电力学问题而已。
例如,不同的物质的溶解就发生不同的变化。
蔗糖溶解在水里时,它的分子均匀地分散在水分子之间,形成均一状态混合物,属于物理变化。
食盐溶解在水里时,它的晶体受极性的水分子的吸引而分散,Na+和Cl-在水里的分散属于物理变化,而Na+和Cl-跟水分子结合成水合离子的过程,则属于化学变化。
但食盐的基本化学性质没有变,物理变化居主导地位。
放热反应的
1、分解反应——吸热反应
分解反应一般为吸热反应,如碳酸氢钠加热的情况下分解为碳酸钠、水和二氧化碳;碳酸钙高温条件下可分解为氧化钙和二氧化碳等。
2、少数化合反应——吸热反应
如碳和二氧化碳在高温的条件下反应生成了一氧化碳就是吸热反应。
3、燃烧反应——放热反应
燃烧反应通常发生在碳氢化合物与氧气反应产生二氧化碳和水。
燃烧反应是混合物中的可燃成分急剧与氧反应形成火焰放出大量的热和强烈的光的过程。
4、中和反应——放热反应
酸碱中和反应指酸和碱互相交换成分,生成盐和水,并且放出热量的反应。
中和反应的实质是:氢离子和氢氧根结合生成水,或者是酸和碱作用生成盐和水。
5、铝热反应——放热反应
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。
可简单认为是铝与某些金属氧化物(如三氧化二铁、三氧化二铬、二氧化锰等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应其中镁条为引燃剂,氯酸钾为助燃剂。
常见得放热反应与吸热反应
⑴常见得放热反应
①燃烧反应、如C、CO、C2H5OH等到得燃烧
②酸碱中与反应、如2KOH+H2SO4=K2SO4+2H2O
③活泼金属与水或酸得反应、如2Al+6HCl=2AlCl3+3H2↑
④多数化合反应。
如Na2O+H2O =2NaOH,SO3+H2O=H2SO4
⑵常见得吸热反应
①多数分解反应,如CaCO3CaO+CO2↑
②铵盐与碱得反应,
如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
③C(s)+H2O(g) CO+H2
④CO2+C 2CO
测定反应热
Q= —C(T2-T1)=—C0m(T2-
T1)
中与反应得反应热:
酸碱中与反应所放出得热量
中与热:
在稀溶液中,酸与碱发生中与反应生成1 m
ol水时得放出得热量
中与热数值大小与反应物量多少无关
焓:物质本身所具有得能量用焓来表示
符号:H
焓变△H=H 生成物-H反应物
∆H〈0时,为放热反应
∆H>0时,为吸热反应
影响焓及焓变大小得因素1、不同物质,H不同,△H也不同
2、同一物质,物质得量越大,H也越大,△H也越大3、同一物质,H(气)〉H(液)〉H(固)
焓变与反应热得不同:
△H大小要瞧符号,Q得大小不瞧符号
书写热化学方程式,注意以下几点:
(1)热化学方程式要标明物质得状态:固体—s,液体—l,气体—
g;水溶液中得溶质用aq表示
(2) △H后要注明反应得温度,对于298K时进行得反应可以不注明温度;
(3) △H单位就是J·mol-1或KJ ·mol-1
(4)若方程式中各物质系数加倍,则△H数值也加倍,若反应逆向进行,则符号也要变
电解池与原电池有哪些异同(续)
装置 原电池 电解池 电子离子 流向
电子流向: 负极 →导线→正极 离子流向: 阳离子→正极 阴离子→负极
电子流向: 电源负极→电解
池阴极电解池阳极→电源正极 离子流向: 阴离子→阳极 阳离子→阴极
盖斯定律
对于一个化学反应,无论就是一步完成还就是分几步完成,其反应焓变都就是一样得,这一规律称为盖斯定律。
电解池与原电池
①两电极接直流电源 ②电解质溶液 ③形成闭合回路
①活泼性不同得两电极 ②电解质溶液
③形成闭合回路
形成条件 将电能转变成化学能得装置 将化学能转变成电能得装置 定义
装置 实例
电解池
原电池
装置
电解池与原电池有哪些异同(续)
电镀
①电极: 阳极——镀层金属 阴极——待镀金属制品 ②电镀液:含有镀层金属离子得电解质溶液。
③电解质溶液:溶液中CuSO 4得浓度保持不变。
铜得电解精炼
粗铜: 含少量Zn ﹑Fe ﹑Ni ﹑Ag ﹑Au 、 Pt 等 阳极: 粗铜 阴极: 纯铜 电解液: CuSO 4溶液 阳极: Cu - 2e - = Cu 2+ (主要反应)
Zn - 2e - = Zn 2+
Fe - 2e - = Fe 2+ Ni - 2e - = Ni 2+
(Au ﹑Ag 、Pt 沉积下来,形成阳极泥)
阴极:
Cu 2+ + 2e - = Cu
待镀制品
铜片
氯化铜溶液
原电池电极式得书写:
判断就是否有自发得氧化还原反
应
判断正、负极
根据负失氧,正得还写正负极电极式
原电池两极得判断方法
(1)根据电极材料判断:(泼负)一般,相对活泼得金属为负极,活泼性较弱得金属或能导电得非金属为正极。
(2)根据电流方向(或电子流向)判断 电流:正极→负极 电子:负极→正极 (3)根据溶液中离子得移动方向判断 阳离子向 正极移动,阴离子向负极移动 (4)根据现象判断:
一般,电极变细得为负极,有气泡产生或变粗得一极为正极 (5)根据发生得反应判断(负失氧,正得还)
化学腐蚀与电化学腐蚀
化学腐蚀
电化学腐蚀
条件 金属跟周围物质(气体或溶液)直接接触被氧化 不纯金属或合金跟电
解质溶液接触 现象 无电流产生 有微弱电流产生 本质 金属被氧化
较活泼金属被氧化
联系
两者往往同时发生,电化学腐蚀更普遍
钢铁得析氢腐蚀与吸氧腐蚀比较
析氢腐蚀 吸氧腐蚀
条件
酸性环境
中性或酸性很弱得环境
电极反应 负极
正极
Fe -2e=Fe 2+ 2H ++2e
-
= Fe —2e=Fe 2+
O 2+2H2O+4e =4OH -
氢氧燃料电池
电池反应为:
在碱性条件下,氢氧燃料电池中得电极反应:
在酸性条件下,氢氧燃料电池中得电极反应:
总反应 H 2↑ F e+2H +=Fe 2++H 2↑
2Fe+2H 2O+O 2= 2 F e(OH)2
4Fe(OH)2+2H2
O
+O 2=4Fe(OH)3 Fe 2O 3 · n H 2O(铁锈)
用牺牲锌块得方法来保护船身,锌块必须定期更换
航海得船只得船底四周镶嵌锌块(白色),就就是利用牺牲阳极保护
法。
阴极电保护法——电解原理
将被保护金属与另一附加电极作为电解池得两个极,使被保护得金属作为阴极,在外加直流电得作用下使阴极得到保护、此法主要用于防止土壤、海水及水中金属设备得腐蚀。
电解池及原电池得应用----金属得防护
1)金属腐蚀快慢得判断
2)金属得防护方法 ①改变金属内部结构 ②覆盖保护层 ③电化学保护法
外加电源得阴极保护法
牺牲阳极保护法
在同一电解质溶液中,金属腐蚀得由快到慢规律如下: 电解原理引起得腐蚀>原电池原理引起得腐蚀>化学 腐蚀>应用原电池保护措施得腐蚀>应用电解池原理保 护措施得腐蚀
废铁。