初中九年级上册化学 金刚石、石墨和C60知识点
- 格式:doc
- 大小:81.02 KB
- 文档页数:3

金刚石、石墨和C60一、碳的单质金刚石、石墨和C60都是由碳元素组成的单质,但三种单质中碳原子的排列方式不同,导致他们的物理性质和用途上存在比较大的差异。
即:结构决定性质,性质决定用途。
1.金刚石纯净的金刚石是无色透明、正八面体形状的固体。
金刚石是天然存在的最硬的物质。
右图是金刚石的微观结构图,每一个小球代表一个碳原子,每个碳原子位于一个正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连续的、坚固的骨架结构。
这样的结构决定了金刚石的性质的稳定性。
世界上最著名的金刚石产地在南部非洲。
这个地区的金刚石常常存在死火山的喷井中。
人们认为它们是在极高的温度和压强下慢慢地形成的。
开采出来的金刚石并没有宝石的外形和光彩,通过切割和磨光等工艺才给它们以光耀的外形。
习惯上人们常将加工过的称为钻石,而未加工过的称为金刚石。
金刚石是最好的热导体。
完整的金刚石单晶的导热性是银和铜的导热性的5倍(银和铜是最好的金属导体)。
它的不导电性结合着它的优良的导热性使金刚石在半导体装置方面很有用。
金刚石在普通溶剂中是不溶解的。
人造金刚石与天然金刚石在化学上是完全等同的,但它们是在实验室中生产出来的。
它们是在对石墨以及作为溶剂和催化剂的金属施以极高的压强(5500大气压)和高温(2000℃)约一天的时间后制得的。
金刚石的硬度很大。
它是碳的最密集的形式,密度大约是水的3.5倍。
它的硬度(抗磨性)和密度都可以用它的结构来解释。
由于它极高的硬度,金刚石被用于切割、钻孔和研磨。
金刚石常被用来作为经久耐用的唱机针头。
2.石墨石墨是深灰色的有金属光泽而不透明的细鳞片状固体。
质地很软,有滑腻感,在隔绝空气的条件下,其熔点在3000℃以上,是最耐高温的矿物之一。
右图是石墨的微观结构示意图。
石墨晶体是层状结构。
在每一层内,每个碳原子都和相邻的三个碳原子相连,六个碳原子排成正六边形,一个个六边形排列成平面的网状结构。
层与层之间作用力较微弱,因此石墨的润滑性很好。

中考化学金刚石石墨和C60的综合热点考点难点一、初中化学金刚石石墨和C601.关于金刚石、石墨和C60的说法正确的是A.都是黑色固体B.都具有导电性C.都是由原子直接构成的D.燃烧都生成二氧化碳【答案】D【解析】A、金刚石不是黑色固体,错误;B、金刚石不导电,错误;C、金刚石、石墨是由碳原子构成,但是C60是由分子构成,错误;D、金刚石、石墨和C60都含有碳元素,燃烧后都生成二氧化碳,正确。
故选D。
2.高铁动车与电路连接的是石墨电刷,它没有体现出石墨具有的性质是A.导电性B.还原性C.滑腻感D.稳定性【答案】B【解析】【详解】高铁动车与电路连接的石墨电刷利用了石墨的导电性、滑腻感、稳定性,故选B。
3.化学上把同种元素组成的不同单质互称为同素异形体。
下列各组物质互为同素异形体的是A.液氧和氧气B.CO和CO2C.金刚石和石墨D.冰和干冰【答案】C【解析】【分析】同素异形体:同种元素组成的不同单质。
【详解】A、液氧和氧气是同种物质,不是同素异形体,故A不正确;B、CO和CO2是化合物,不是单质,则不是同素异形体,故B不正确;C、金刚石和石墨都是由碳元素形成的不同单质,属于同素异形体,故C正确;D、冰是固体的水,干冰是固体的二氧化碳,都是化合物,不是同素异形体,故D不正确。
故选C。
4.空气中含量最多,又可以作为焊接金属的保护气的是()A.氧气B.氮气C.二氧化碳D.一氧化碳【答案】B【解析】【详解】A、氧气是一种化学性质比较活泼的物质,能与空气中多种物质发生反应,不能做保护气,故A不正确;B、氮气在空气中含量较多化学性质稳定,不易与其它物质发生化学反应,常作为焊接金属时的保护气,故B正确;C、二氧化碳在空气中含量仅占0.03%,题目中该气体在空气中含量较多,故C不正确;D、一氧化碳在空气中含量很少,题目中该气体在空气中含量较多,故D不正确。
故选B。
5.吸烟有害身体健康,香烟的烟气中含有几百种有毒物质,其中易与人体血红蛋白相结合的有毒气体是A.CO2 B.N2 C.O2 D.CO【答案】D【解析】烟草在燃烧过程中,产生了许多有害物质,如尼古丁、一氧化碳、烟焦油、尼古丁等,其中一氧化碳有毒,它能与血液中的血红蛋白结合,导致体内组织器官严重缺氧而死亡。
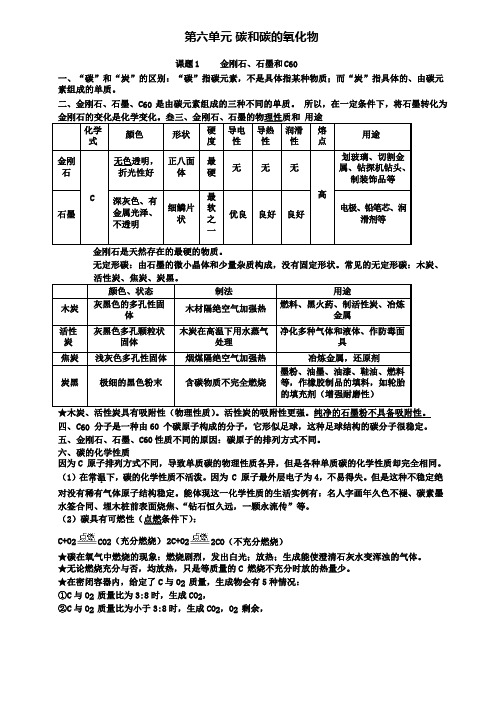
第六单元碳和碳的氧化物课题1 金刚石、石墨和C60一、“碳”和“炭”的区别:“碳”指碳元素,不是具体指某种物质;而“炭”指具体的、由碳元素组成的单质。
二、金刚石、石墨、C60 是由碳元素组成的三种不同的单质。
所以,在一定条件下,将石墨转化为无定形碳:由石墨的微小晶体和少量杂质构成,没有固定形状。
常见的无定形碳:木炭、四、C60 分子是一种由60 个碳原子构成的分子,它形似足球,这种足球结构的碳分子很稳定。
五、金刚石、石墨、C60 性质不同的原因:碳原子的排列方式不同。
六、碳的化学性质因为C 原子排列方式不同,导致单质碳的物理性质各异,但是各种单质碳的化学性质却完全相同。
(1)在常.温.下,碳的化学性质不活泼。
因为 C 原子最外层电子为4,不易得失。
但是这种不稳定绝对没有稀有气体原子结构稳定。
能体现这一化学性质的生活实例有:名人字画年久色不褪、碳素墨水签合同、埋木桩前表面烧焦、“钻石恒久远,一颗永流传”等。
(2)碳具有可燃性(点燃条件下):C+O2CO2(充分燃烧)2C+O22CO(不充分燃烧)★碳在氧气中燃烧的现象:燃烧剧烈,发出白光;放热;生成能使澄清石灰水变浑浊的气体。
★无论燃烧充分与否,均放热,只是等质量的C 燃烧不充分时放的热量少。
★在密闭容器内,给定了C 与O2质量,生成物会有5 种情况:①C 与O2质量比为3:8 时,生成CO2,②C 与O2质量比为小于3:8 时,生成CO2,O2 剩余,③C 与O2质量比为3:4 时,生成CO,④C 与O2质量比为大于3:4 时,生成CO,C 有剩余,⑤C 与O2质量比大于3:8,且小于3:4 时,生成。
(3)碳具有还原性(高温的条件下,且要注意隔开氧气):C+2CuO2Cu+CO2↑2Fe2O3+3C4Fe+3CO2↑ 单质碳的还原性可用于冶金工业。
七、实验6-2(图见课本,装.置.必.须.密.封.,.且.要.隔.O.2.或.空.气.,本实验成功的 2 个关键点:气.密.性.要.要.好.,.温.度.要.高.)1、药品要平铺?答:.2、试管口要倾斜?: .3、试管内导管伸入不宜过长?答:.4、加金属网罩的作用?答:.5、为什么要先预热?答:①;②.6、实验前段时间,右侧导管口有气泡冒出,石灰水为什么不变浑浊?答:.7、木炭还原氧化铜反应开始和结束的标志分别是什么?答:【开始】;【结束】。

课题 1·金刚石、石墨和C·知识要点60【要点1】碳的单质1.金刚石和石墨我们可以通过列表对比,更明确地看出金刚石和石墨的物理性质和用途的差异.(表6-1)思考:金刚石和石墨都是由碳元素组成的单质,为什么物理性质会有很大的差异呢?一种元素可以组成多种单质,金刚石和石墨都是由碳元素组成的单质,但是组成单质时原子的排列不同(见课本图6-1、图6-2),所以物理性质会有很大的差异.2.C60分子C60也是由碳元素组成的单质.C60分子是一种由60个碳原子构成的分子,它形似足球(见课本图6-4),有人因此称它为“足球烯”.说明:C是美国休斯顿大学的克罗脱(Kroto, H. W.)和史沫莱60(Smalley, R. E.)等人在1985年发现的.我国北京大学化学系和物理系分子.研究小组也研制出了C601991年科学家又发现一种碳的单质——碳纳米管,它是由六边环形的碳原子构成的管状大分子(如图6-1),它的直径只有几个纳米.讨论:同种元素组成的物质是否一定为单质?不是,一种元素可以组成几种单质,只有一种元素组成的纯净物才是单质,如果金刚石和石墨混合在一起,经检测,虽然只有碳元素,但金刚石和石墨不属于同种物质,所以应该是混合物.我们应该说同种元素组成的物质可能是单质,也可能是混合物.【要点2】木炭木炭主要是由石墨的微小晶体和少量杂质构成的,具有疏松多孔的结构,与木炭类似的,还有焦炭、活性炭和炭黑.说明:木炭和活性炭因为具有疏松多孔的结构,所以具有很强的吸附能力,活性炭的吸附能力比木炭的还要强.在吸附的过程中,只是把物质的微小粒子吸附到疏松多孔的表面上,并没有生成新的物质,是物理变化.【要点3】碳的化学性质1.常温下:碳的化学性质不活泼(稳定性)说明:碳受日光照射或跟空气、水分接触,都不容易起变化.例如我国古代用墨汁书写、绘制的字画,可以保存多年而不褪色(如图6-2);我们填写的档案资料均要求用碳素墨水书写,碳素墨水写字不易褪色.讨论:木桩做电线杆埋入地下之前,通常将其表面部分微烤焦,为什么?烤焦的表面形成一层木炭,减慢电线杆的腐烂速度,使其经久耐用.2.碳跟氧气的反应(可燃性)(1)充分燃烧生成二氧化碳说明:这个反应过程中,放出大量的热,所以碳可以用作燃料.(2)不充分燃烧生成一氧化碳说明:这个反应过程中也放热.注意:反应的生成物一氧化碳有剧毒,对人体有害,室内用煤取暖时要注意安全.3.碳跟某些氧化物的反应(还原性)现象:黑色粉末逐渐变成红色,能生成使澄清石灰水变浑浊的气体..分析:红色物质应该是铜,使澄清石灰变浑浊的气体应该是CO2讨论:在上面的反应中,哪种物质具有还原性?在上述反应中,碳是使氧化铜还原为铜的物质,它具有还原性.说明:碳能够夺取金属氧化物中的氧,碳的还原性可以用在冶金工业上.。

第六单元碳和碳的氧化物第一课时【学完本课题你应该知道】1.不同元素可以组成不同的物质。
同一种元素也可以组成不同的物质。
如金刚石、石墨、和C60等都是由碳元素组成的单质2.木炭和活性炭具有吸附性3.在常温下,碳的化学性质很稳定。
在高温下,碳能够与很多物质其反应。
4.物质的性质在很大程度上决定物质的用途。
【知识回顾】什么叫单质?。
由同种元素组成的物质一定是纯净物吗?举例说明。
同种元素可以组成不同的单质吗?举例说明。
【学习新知识】研究表明:金刚石、石墨和C60都是由碳元素组成的单质。
PPT展示金刚石石墨的照片一.金刚石和石墨金刚石石墨颜色形状硬度导电性导热性用途组成结构物理性质差异原因转化二.其他(1)无定形碳(是由的微小晶体和少量杂质构成的物)——木炭、焦炭、活性炭、炭黑①木炭和活性炭具有的结构,因此它具有能力。
焦炭和活性炭与木炭结构类似。
②木炭和活性炭的用途:利用木炭和活性炭的这个性质来吸附一些食品和工业产品里的,也可以用它来吸附有的物质。
例如自来水的净化过程是沉淀、过滤、、消毒。
3、新的以单质形式存在的碳——C60C60是一种由60个碳原子构成的分子,形似足球,性质很稳定。
它应用于材料科学、超导体等方面的研究正在进行中。
4、更新的碳单质:C70 C240 C540课后巩固1、将以下左例和右例有关项目用线连接起来。
石墨冰箱去味剂、防毒面具炭黑导电金刚石新型催化剂C60 制油墨活性炭切割坚硬金属2.测得某物质中只含有碳元素,这种物质 ( )A.一定是一种单质 B.一定是石墨C.可能是二氧化碳 D.可能是一种单质,也可能是几种碳的单质的混合物3.以美国为首的北约在对南联盟的野蛮轰炸中悍然使用了石墨炸弹,用来破坏输变电系统,石墨炸弹的破坏性主要是利用了石墨的什么性质()A、质软B、能导电C、有润滑性D、有金属光泽4.2022年底江苏省考古专家对“泗水王陵”进行保护性挖掘,在考古的过程中发现在棺室外围的土层中有厚厚的一层一千多年前的木炭,这表明木炭具有()A . 可燃性B . 还原性C . 稳定性D . 吸附性5.金刚石、石墨、C60、C70 都是碳元素组成的单质,关于它们的说法正确的是(填序号)A . 碳原子的排列方式不同B . 化学性质相似C . 物理性质相似D . 是同一种物质E . 完全燃烧都生成二氧化碳F . 都是黑色固体6.金刚石、石墨、C60都是碳的几种单质,请你设计一个方案,证明金刚石、石墨、C60都是由碳元素组成的7.如下图所示,中盛有红棕色二氧化氮气体的集气瓶里放几小块活性炭,最终观察到红棕色 (填“变深”或“消失”或“不变”),漏斗中液面(填“上升”或“下降”或“不变”)。

九年级化学金刚石石墨和C60知识点九年级化学知识点:金刚石、石墨和C60金刚石、石墨和C60,这是在九年级化学课程中经常提到的三个重要的碳元素形式。
它们都是由碳元素构成的,但是它们在结构和性质上却完全不同。
本文将会分别介绍金刚石、石墨和C60的特点和应用,让我们更深入地了解这些化学物质。
1. 金刚石金刚石是自然界中最硬的材料之一,它的硬度在克诺斯硬度等级中为10,是所有材料中最高等级。
金刚石是由碳元素通过共价键连接而成的,每个碳原子与四个相邻碳原子形成四面体结构,并排列成紧密的晶格结构。
由于结构的稳定性和精确性,使得金刚石具有极高的硬度和抗磨损性,因此被广泛应用于切割工具、钻石饰品等领域。
虽然金刚石的硬度很高,但它的热稳定性却很低。
在高温下,金刚石会逐渐转变为石墨相。
这主要是因为金刚石的晶格结构过于紧密,不利于热运动,从而导致结构的不稳定性。
2. 石墨与金刚石相比,石墨的硬度要低得多。
石墨是由均匀相互平行排列的碳层构成,在每一层中碳原子通过共价键连接,而层与层之间的键是相互弱的范德华力。
由于碳层之间的键弱,因此石墨具有很好的层间滑移性,使得石墨具有良好的润滑性和导电性。
石墨还有一个特殊的性质,即热稳定性。
由于石墨中的碳层与层之间的键弱,因此石墨可以抵抗高温下的结构转变,保持稳定。
这也是为什么石墨可以用来制造铅笔芯的原因,因为在摩擦过程中碳层之间会发生剥离和滑移,从而形成细小的黑色颗粒。
除了润滑和导电性方面的应用外,石墨还被广泛应用于电池、气体处理和高温材料等领域。
例如,石墨电极在电池中起着储存和释放电荷的重要作用,而石墨在高温条件下具有良好的耐蚀性和热传导性能,因此可以用来制造高温容器和导热材料。
3. C60富勒烯C60富勒烯是由60个碳原子组成的球状分子,由于它的结构形状类似于足球,因此被称为“碳纳米足球”。
C60富勒烯具有许多独特的物理和化学性质,因此在材料科学和医学领域具有广泛的应用前景。
第六单元碳和碳的氧化物第一节金刚石、石墨和C60一、“碳”和“炭”的区别:“碳”指碳元素,不是具体指某种物质;而“炭”指具体的、由碳元素组成的单质。
二、金刚石、石墨、C60是由碳元素组成的三种不同的单质。
所以,在一定条件下,将石墨转化为金刚石的变化是化学变化。
三、金刚石、石墨的物理性质和用途化学式颜色形状硬度导电性导热性润滑性熔点用途金刚石C 无色透明正八面体最硬无无无高划玻璃、切割金属、钻探机钻头、制装饰品等石墨深灰色、有金属光泽、不透明细鳞片状最软之一优良良好良好电极、铅笔芯、润滑剂等⏹金刚石是天然存在的最硬的物质。
⏹无定形碳:由石墨的微小晶体和少量杂质构成,没有固定形状。
常见的无定形碳:木炭、活性炭、焦炭、炭黑。
颜色、状态制法用途木炭灰黑色的多孔性固体木材隔绝空气加强热燃料、黑火药、制活性炭、冶炼金属活性炭灰黑色多孔颗粒状固体木炭在高温下用水蒸气处理净化多种气体和液体、作防毒面具焦炭浅灰色多孔性固体烟煤隔绝空气加强热冶炼金属炭黑极细的黑色粉末含碳物质不完全燃烧墨、油墨、油漆、鞋油、燃料等,作橡胶制品的填料⏹木炭、活性炭具有吸附性(物理性质)。
活性炭的吸附性更强。
四、C60分子是一种由60个碳原子构成的分子,它形似足球,这种足球结构的碳分子很稳定。
五、金刚石、石墨、C60性质不同的原因:碳原子的排列方式不同。
六、碳的化学性质⏹单质碳的物理性质各异,而各种单质碳的化学性质却完全相同⏹在常温下,碳的化学性质不活泼。
⏹碳具有可燃性:C+O2CO2(充分燃烧)2C+O22CO(不充分燃烧)碳在氧气中燃烧的现象:燃烧剧烈,发出白光;放热;生成能使澄清石灰水变浑浊的气体。
⏹ 碳具有还原性:C+2CuO 2Cu+CO 2↑ 2Fe 2O 3+3C4Fe+3CO 2↑单质碳的还原性可用于冶金工业。
七、 木炭还原氧化铜的实验(见右图)【实验操作】① 把刚烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管; ② 将试管固定在铁架台上。
九年级化学《金刚石、石墨和C60》知识点整理九年级化学《金刚石、石墨和C60》知识点整理一、碳的几种单质(金刚石、石墨、C60)1、金刚石(C)是自然界中最硬的物质,无色透明,正八面体。
可用于制钻石;刻划玻璃、钻探机的钻头(体现了它的硬度大)等。
2、石墨(C)是最软的矿物之一,深灰色,具有金属光泽,细鳞片状的固体,有优良的导电性,润滑性。
可用于制铅笔芯(体现它深灰色、质软)、干电池的电极(体现了它的导电性)、电车的电刷(体现了它的导电性,滑腻感、常温下化学性质稳定)、做润滑剂(体现它具有滑腻感)等金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。
3、无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等.活性炭、木炭具有强烈的吸附性(因为具有疏松多孔的结构),木炭可用于食品、工业产品中除去色素、异味等,活性炭可用于防毒面具中除去毒气、制糖业中脱色以制白糖;焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。
注意:吸附性是活性炭、木炭的物理性质4、C60:C60分子由60个碳原子构成的分子,形似足球,结构稳定。
二、.单质碳的化学性质:单质碳的物理性质各异,而各种单质碳的化学性质却完全相同!1、常温下的化学性质比较稳定。
因此古代用墨书写、绘画的字画保存时间很久,仍不变色。
2、可燃性:完全燃烧(氧气充足),生成CO2:C+O2CO2不完全燃烧(氧气不充足),生成CO:2C+O22CO3、还原性:C+2CuO2Cu+CO2↑(置换反应)现象:黑色粉末逐渐变成光亮红色,产生的的气体能使澄清的石灰水变浑浊。
C在反应中得到氧元素,发生氧化反应,是还原剂,具有还原性。
CuO在反应中失去氧元素,发生还原反应,是氧化剂。
具有氧化性。
小结:还原剂:夺去氧元素的物质,具有还原性。
得到氧元素,发生氧化反应。
氧化剂:提供氧元素的物质,具有氧化性。
失去氧元素,发生还原反应。
应用:冶金工业:2Fe2O3+3C4Fe+3CO2↑C+CO22CO。
《金刚石、石墨和碳60》知识总结知识点一:碳的单质1.同一种元素可以组成不同的单质:如金刚石、石墨和C60都是由碳元素组成的单质,但由于碳原子在这些物质里的排列方式不同,即结构不同,导致它们在性质尤其是物理性质上有很大的差异。
由此可知:物质的组成和结构决定物质的性质。
【要点诠释】金刚石和石墨在一定条件下可相互转化,属于化学变化。
同种元素可以组成不同单质。
因此,我们不能说“由同种元素组成的物质叫单质”。
2.金刚石、石墨和C60的性质比较及用途:名称金刚石石墨C60外观无色透明、正八面体形状的固体,有璀璨夺目的光泽深灰色不透明的细鳞片状的固体,有金属光泽C60分子形似足球。
有金属光泽的固体,其微晶粉末呈黄色导电性几乎不导电良好几乎不导电硬度天然存在的最硬的物质质软(最软的矿物之一)质脆导热性很差良好很差用途钻头、刻刀、装饰品等电极、铅笔芯、润滑剂等制备新材料、超导材料、医学应用等(注:人们对C60性质的认识正在不断的深入)【要点诠释】金刚石、石墨和C60都是由碳元素组成的单质,但由于碳原子的排列不同(见图16-1),物理性质有很大的差异,用途也有较大不同。
3.木炭、活性炭的吸附性:木炭、活性炭、焦炭、炭黑等物质都是由石墨的微小晶粒和少量杂质构成的,由于木炭和活性炭均具有疏松多孔的结构,因此它们具有较强的吸附能力,可以吸附毒气、色素以及有异味的物质等。
据此,木炭和活性炭在制糖工业、食品工业、防毒面具制作等方面有重要的应用。
【要点诠释】1.吸附是物理现象,与吸收具有不同的含义。
由于木炭疏松多孔,有很大的表面积,因此它具有吸附性,活性炭的吸附性比木炭更强。
吸附作用是将气体或溶液里的微小粒子吸附在固体表面,没有生成新物质,属于物理变化。
吸收一般为化学变化,如:CO2气体被氢氧化钠溶液吸收的过程中生成了碳酸钠或碳酸氢钠等物质,就是化学变化。
2.“碳”和“炭”的区别:“碳”是元素的名称,是核电荷数为6的一类原子的总称。
金刚石、石墨和C60_九年级化学复习1金刚石、石墨和C60★思路点睛1、碳元素构成的单质 (1)碳的稳定性:常温下,碳的化学性质不活泼,受日光照射或跟空气、水分接触,都不容易起变化。
(2)碳的可燃性:(放热) ①充分燃烧:C +02CO 2 ②不充分燃烧:2C +O 22CO(3)碳的还原性:点燃点燃名称 性质 金刚石石墨成份 游离态碳游离态碳色态 无色透明、正八面体性状的固体 深灰色细鳞片状固体 光泽性 加工后有夺目光泽 有金属光泽硬度 最硬 软、滑,在纸上可留痕迹 熔点 很高 高(耐高温) 导热性 无 良好 导电性不 电易导电用途 钻头、玻璃刀、装饰品 铅笔芯、耐高温的润滑剂、电极结论①结构决定性质:金刚石和石墨由于晶体中碳原子的排列方式不同,致使两物质的物理性质有很大差异。
②一种元素可以组成不同单质。
如:金刚石和石墨;红磷和白磷;氧气和臭氧。
①与金属氧化物(金属冶炼):C+2CuO2Cu+CO2↑;3C+2Fe2O34Fe+3CO2②与非金属氧化物(工业制煤气):C+H2O H2+CO; C+CO22CO2、氧化还原反应(从得氧失氧的角度分析)(1)氧化反应、还原反应物质与氧发生的反应叫氧化反应,含氧化合物里的氧被夺去的反应叫还原反应;(2)氧化剂、还原剂在反应中,供给氧的物质叫氧化剂,夺得氧的物质叫还原剂。
(3)氧化性、还原性在反应中,物质供给氧的性质叫做氧化性,物质夺取氧的性质叫还原性。
小结:★典型试题1.化学上把由同种元素组成的不同单质互称为同素异形体,例如白磷和红磷。
下列各组物质互为同素异形体的是A.一氧化碳和二氧化碳 B.金刚石和石墨C.冰和干冰 D.氧气和液氧【答案】B【解析】试题分析:A.一氧化碳和二氧化碳不是单质。
B.金刚石和石墨都是由碳元素组成的、性质不同的两种单质,符合要求。
C.冰和干冰不是单质。
D.氧气和液氧是同高温高温高温高温金刚石、石墨和C60_九年级化学复习2一种物质。
初中九年级上册化学金刚石、石墨和C60知识点第六单元碳和碳的氧化物
课题1 金刚石、石墨和C60
一、碳单质
⒈金刚石、石墨的物理性质和用途的比较
⒉木炭、活性炭、焦炭、炭黑主要是由石墨的微小晶体和少量杂质构成的。
⑴木炭:有吸附作用,用于吸附一些食品和工业产品里的色素,吸附有异味的物质。
点燃 点燃 高温 ⑵活性炭:有较强的吸附作用,用于防毒面具中除去毒气、制糖业中脱色以制白糖、冰箱的除臭剂。
(3)焦炭:用于冶铁
(4)炭黑:加到橡胶里,能够增加轮胎的耐磨性。
注:木炭、活性炭具有强烈的吸附性是因为具有疏松多孔的结构。
吸附性是活性炭、木炭的物理性质。
3. 同一种元素可以组成不同的单质。
二、单质碳的化学性质
⒈常温下,碳的化学性质不活泼(碳原子最外层有4 个电子)
应用:解释古代字画为什么经历几千年而不变色?档案资料为什么要求用碳素墨水书写?
⒉碳的可燃性(相同的反应物,因反应物的量不同,生成物不同)
充分燃烧 C + O 2 ===== CO 2 碳在氧气中燃烧的现象:燃烧剧烈,发出白光,放热,生成能使 澄清石灰水变浑浊的气体。
不充分燃烧 2C + O 2 ===== 2CO
3. 碳的还原性(以木炭还原CuO 为例)——用于冶炼金属
⑴现象:黑色粉末变红色,澄清的石灰水变浑浊。
⑵化学方程式:C + 2CuO ===== 2Cu + CO 2↑
(3)反应开始的标志:澄清的石灰水变浑浊。
(4)在酒精灯上加网罩的目的:使火焰集中并提高温度。
(5)配制混合物时木炭粉应稍过量的目的:防止已经还原的铜被氧气重新氧化。
(6)实验完毕后先熄灭酒精灯的后果:石灰水倒吸入热的试管中使试管炸裂。
(7)C 在反应中得到氧元素,发生氧化反应,是还原剂,具有还原性。
CuO在反应中失去氧元素,发生还原反应,是氧化剂,具有氧化性。
(8)应用:用于冶金工业。
高温
C + CO2 ===== 2CO
C+2Fe2O34Fe+3CO2↑
三、氧化还原反应(从得氧失氧的角度分析)
1.氧化反应、还原反应:物质与氧发生的反应叫氧化反应,含氧化合物里的氧被夺去的反应叫还原反应。
⒉氧化剂、还原剂:在化学反应中,供给氧的物质叫氧化剂,得氧的物质叫还原剂。
⒊氧化性、还原性:在化学反应中,物质供给氧的性质叫氧化性,物质夺取氧的性质叫还原性。