熔点测定
- 格式:ppt
- 大小:447.50 KB
- 文档页数:9


熔点的测定一、熔点测定的重要意义被测物质的熔点越接近其标准熔点,则该物质就越纯。
因此,测定物质的熔点则可以定性鉴定被测物质的纯度。
二、测定熔点的方法及原理(重点、难点)1.方法:毛细管法2.原理:物质自初熔至全熔的温度范围称为熔点范围,(又称熔距或熔程)。
若将毛细管与温度计的水银球紧密靠在一起,则毛细管内被测物质的温度可从温度计上直接读取,这样就可以测出被测物质初熔和全熔时的温度,从而计算出熔距,再与其标准熔距比较,就能鉴别被测物质的纯度,因为纯净的有机物有固定的熔点,熔距很小,仅为0.5~1.0℃,如被测物质含有少量杂质,熔点一般会下降,熔距显著增大。
三、仪器和药品(略)四、实验步骤(重点)1.样品的填装:用自由落体的方法,使样品在毛细管内均匀、紧密、结实。
2.装置的安装:b 形管用铁架台固定,温度计的水银球位于b形管上、下两侧管口的中间,毛细管内药品用橡皮圈固定在温度计水银球的中间,b形管内甘油液面高出上侧管口0.5cm即可。
3.熔点的测定及记录:(1)初测:用酒精灯加热,粗略观察初熔及全熔时的温度;(2)测定:要控制升温速度A、开始时,5℃/min;B、距熔点10~15℃时,1~2℃/min;C、接近熔点约5℃时,0.5℃/min。
记录初熔和全熔的温度,计算熔距,平行测定两次。
计同步,减少测量误差;B、测第二次时应将甘油冷却至样品的熔点以下约20℃,换新的样品管;C、柠檬酸的熔点为153℃;尿素的熔点为135℃;苯甲酸的熔点为122.4℃;D、测混合物熔点时,至少要测三种比例(1:9,1:1,9:1)的混合物的熔点。
4.装置的拆除和仪器的清洗待甘油冷却后取出温度计,甘油回收,b形管冷却至室温后用水冲洗。
五、注意事项1.样品填装时一定要均匀、紧密、结实;2.安装时注意被测物质(样品)、温度计的水银球以及b形管之间的位置关系,确保受热均匀;3.测定时,加热升温的速度一定得控制好,减少实验误差;4.加热甘油时应注意防火安全。

熔点的测定熔点测定是一项重要的物理性质测定手段,它可以揭示物质的性质和组成。
熔点是指物质在固定的压力下,从固体转变为液体所需的温度,它是衡量物质晶格结构的重要参数。
本文将介绍常见的熔点测定方法和技术要求,以及熔点测定在科学研究和实际应用中的重要作用。
一、熔点测定方法及技术要求1、采用常温水浴加热法常温水浴加热法是最常用的熔点测定方法,它具有灵敏度高、易操作等优点。
在这种测定方法中,将溶解体熔融池加入熔融炉,然后通过水浴将溶解体加热,并观察其在不同温度下的熔融状态,最终能够得出溶解体的熔点。
2、熔点炉法熔点炉法也是一种常用的熔点测定方法,它以电热为能源,采用交流电热或直流电热来加热溶解体。
当溶解体熔点温度达到所需值时,会出现熔融或液化,最终可以得出熔点温度。
3、技术要求熔点测定的精度要求相对较高,在整个测定过程中必须严格控制仪器的误差,特别要注意仪器设定的正确性,控温精度的稳定性;此外,实验室环境的温湿度也有很大影响,所以必须保持室内温湿度稳定。
二、熔点测定在科学研究及实际应用中的重要作用1、科学研究中熔点测定可以有助于研究者快速准确地鉴别物质。
熔点测定可以揭示物质的性质,帮助研究者理解物质的内在机理,进而对提高其品质进行改善。
此外,熔点测定也可以帮助研究者更好地掌握溶解度、反应活力、结构以及其它有关认识。
2、实际应用中熔点测定在实际应用中也是非常重要的,它可以帮助我们找出符合要求的产品,以便在最终的应用中达到最佳的效果。
例如,用熔点测定来检验防火油漆的性能,可以比较准确地控制产品的质量水平。
另外,在汽油、柴油等石油制品中,熔点测定也可以用来检验产品的质量和稳定性。
三、总结熔点测定是一项重要的实验技术,它不仅可以帮助研究者准确确定物质的性质,而且可以用来调节物质的性能。
熔点测定的精度要求较高,需要仔细观察溶解体的熔融状态,并严格控制仪器的误差,确保测定结果的准确性。
熔点测定在实验研究及实际应用中都扮演着关键的作用,是科学研究和产品生产的重要技术手段之一。

测定熔点的方法熔点是一种重要的物理性质,对于确定化学物质的纯度,确认其身份以及研究其结构具有重要意义。
测定熔点的方法有许多种,其中最常用的方法是热差法、热量仪法和显微镜法。
一、热差法热差法是一种常见的测定固体熔点的方法。
该方法基于热量传导的原理,通过记录样品加热以及融化的温度差来测定样品的熔点。
具体操作如下:1. 准备样品:取适量的样品,将其在研钵中加热至液态状态,然后迅速倒入冷却的研钵中,至少重复此步骤三次,使样品充分均匀。
2. 放置样品:准备热差装置,将预备好的样品放置在装置的样品缸中。
3. 开始加热:开启加热源,向样品缸中加热。
使用专业的温度计进行温度监测。
4. 记录温度:当样品开始融化时,记录它的温度。
随着加热的继续,继续记录样品温度,直到样品完全融化。
5. 差值计算:计算样品融化前后的温度差,这个差值即为该样品的熔点。
二、热量仪法热量仪法是一种测定固体或液体熔点的方法,它基于样品吸收或放出热量的原理,通过测量样品的温度变化和吸放热量的大小来测定样品的熔点。
具体操作如下:1. 准备样品:取适量的样品,称重,放入样品室中。
注意样品应该足够纯净。
2. 开始实验:打开热量仪系统并将其预热。
启动系统并选择适当的程序,以便得到准确的热量曲线。
3. 加热样品:使用电热加热系统加热样品,加热速率应该足够慢,使得温度每次提高1-2℃。
4. 记录数据:当样品开始融化时,热量仪系统会显示一个明显的热峰。
记录该峰的时间和温度,以及热量的值。
5. 数据分析:通过分析热量曲线,并计算样品吸放热量的大小,可以精确确定样品的熔点。
三、显微镜法显微镜法是一种测定熔点的标准方法。
该方法利用显微镜来观察样品的熔化过程,并测定其熔点。
具体操作如下:1. 准备样品:取适量的样品,将其以均匀的方式放置在熔点计的平台上。
确保样品呈现连续的片状。
可以使用特定的工具将样品压片,以使其具有符合要求的形态。
2. 启动实验:打开显微镜,并调整它的焦距,以便清楚观察样品的反射性质。

熔点的测定原理
熔点是指物质在加热过程中由固态转变为液态的温度。
测定物质的熔点可以通过观察物质加热过程中的相变现象来进行。
实验中常用的方法有以下几种:
1. 观察熔点管法:将待测物质放入熔点管中,然后将熔点管加热,观察物质的熔化情况。
当温度达到熔点时,物质将从固态转变为液态,产生明显的熔化现象。
通过测定这一温度,即可确定物质的熔点。
2. 热化学法:利用物质在熔化过程中放热的特性,通过测定物质加热过程中的温度变化来确定熔点。
在实验中,将待测物质与已知熔点的参比物质混合,然后将混合物加热。
在物质熔化时,会吸收或放出相应的热量。
通过测定温度变化曲线,可以确定物质的熔点。
3. DTA法:差热分析法(Differential Thermal Analysis,DTA)是一种常用的测定熔点的方法。
该方法通过测定物质与参比物质在加热过程中的温度差异来确定熔点。
当物质发生熔化时,其温度与参比物质的温度会有明显的差异表现出来。
以上的方法都是通过观察物质在加热过程中熔化现象的变化来确定熔点。
这些方法可以根据被测物质的性质和实验条件的不同而选择使用。

熔点的测定熔点是指物质从固态转变为液态所需要升温到达的温度,是衡量物质结构、稳定性和键类型的定量指标之一。
它也是识别物质质谱和结构的基本参数,也是分析特定物质的重要手段,是普遍的化学分析技术的重要组成部分。
熔点测定属于化学分析实验中比较重要的一种,主要用于确定某种物质的熔点。
熔点可以作为物质性质的判断标志和化学物质质谱以及结构的基本参数,可以准确而简便地测定物质的熔点,判断物质的本质性质,识别物质质谱和结构,也可以用于识别物质来源或原料质量等,从而进行更全面的化学分析。
熔点测定的通用方法有色谱法、比色法、吸收法、芳料比色法、热重分析法、等离子体质谱法等。
其中,不同的方法有不同的适用范围,在实验室研究和实际应用中有其不可替代的作用,前述方法在熔点测定实验中主要运用自动熔流仪来进行计算机控制,具有操作简单、快速、准确等优点。
色谱法是一种熔点测定方法,通常采用热重分析仪进行试验检测,它可以准确、精确地测定物质的熔点,并可以根据检测结果准确定性分析物质的本质性质,工作稳定、质量可靠。
比色法也是测定熔点的一种常用方法,即将溶液分解成不同的成份,用不同吸光值检测溶液中的元素,然后根据检测结果来确定物质的熔点,以及判断物质的本质性质。
熔点测定技术可以有效地识别物质的质谱和结构,以及识别物质涉及的其他参数,有助于评估物质的变化状态,找出可能的变化趋势,也有利于对物质的特性和特性进行分析,以及进行更全面的化学分析。
熔点测定在许多领域中具有重要意义,如制药、医药、食品等行业,是质量控制的一个重要环节。
熔点测定是一种综合性实验,受到多种因素的影响,从而影响其结果的准确性,主要有用量不准、温度控制不准确、熔点分析仪器失灵等原因。
要确保实验准确,必须建立可靠的实验流程,恰当挑选和使用实验设备,确保实验操作准确,做到精确控制实验温度,使试验结果准确可靠。
综上所述,熔点的测定是化学分析的重要组成部分,通过熔点测定可以准确识别物质质谱和结构,评估物质的变化状态,并且在质量控制等许多领域中扮演着不可替代的作用,因此,熔点测定在实验室研究和实际应用中具有重要的意义。

熔点的测定一、实验目的1、了解熔点测定的意义:测定固体有机物熔点;鉴定固体有机物及其纯度。
2、掌握测定熔点的操作。
二、基本原理熔点是指物质在大气压力下固态与液态处于平衡时的温度。
将固体物质加热到一定温度,由固态转变为液态,测定此时的温度就是该晶体物质的熔点。
纯净的固体一般有固定的熔点,而且熔点范围(又称熔程)很小,一般不超过0.5-1 o C;若物质不纯时,熔点就会下降,熔程扩大。
测熔点时几个概念:始熔、全熔、熔程、物质纯度与熔程关系。
测定熔点实验关键是:由于毛细管法是间接测熔点方法,所以加热升温速度是本实验的关键,当接近熔点时升温速度一定要慢,应小于1-2 ℃/min;密切观察加热和熔化情况,及时记下温度变化。
三、仪器及药品仪器:提勒(Thiele)熔点管、温度计(200 o C)、酒精灯、毛细管、橡皮圈等药品:液体石腊、未知样品两个四、实验步骤1、热浴的准备与安装:把提勒熔点管(b形管)垂直固定在铁架台上,装入浴液至液面刚到侧管上口沿。
2、样品的装填:选取一根直径约1 mm,长约9-10 cm的毛细管,用灯焰将其一端熔封。
再取待测样品少许放在干净的表面皿上,研细聚成小堆,使毛细管的开口端插入样品粉末堆中数次,至毛细管内样品的高度约为2-3 mm,开口端朝上,将其投入一根直立于实验台面的30-40cm长的玻璃管内,让其自由下落,使样品粉末填入管底,夯实。
填好的毛细管,应是样品柱表面光滑、均匀、紧密,否则会使导热不迅速,不均匀,测定结果有偏差。
3、实验装置的安装:把装填好的毛细管用小橡皮圈固定在温度计的一侧,让样品柱紧贴在温度计水银球的中央部位,然后用开口塞子把温度计固定好,温度计的水银球应处在提勒管两侧口的中间部位,不与浴壁接触,样品柱应面对观察者。
4、加热操作与观测:安装好装置后,把灯焰固定在其侧管外端下方加热,这样浴液因受热发生循环流动而起到传热搅拌作用。
开始可较快加热(约每分钟升温4-6℃),接近熔点约10度时,改用小火加热(约每分钟升温1-2℃),愈接近熔点(约2度)升温速度愈慢(约每分钟0.2—0.3℃)(注意:正确掌握升温速度是准确测定熔点的关键),此期间要特别注意观察样品;当发现样品柱面由光滑变粗糙,出现塌落、凹陷现象,且伴有小液珠出现时,表示样品已开始熔化(初熔),记录此时温度,继续小心加热,直到样品全部转化成为透明液体时(全熔),记录此温度,此即样品的熔点。

熔点测定原理
熔点测定是通过测量物质的熔化温度来确定物质的纯度或者进行物质的鉴定工作。
其基本原理是根据物质的组成和结构特点来确定熔化时物质分子间的相互作用力,进而确定物质的熔点。
熔点测定常用的方法有差热分析法和光学熔点测定法。
差热分析法基于熔化过程中吸收或释放的热量来测定物质的熔点。
它通过将待测物质与参比物质放置在差热仪的样品舱中,加热直至两种物质都熔化。
在熔化过程中,待测物质吸收或放出的热量与参比物质相比,就可以确定待测物质的熔点。
光学熔点测定法则是利用人眼或者显微镜观察物质在加热过程中的变化情况来测定熔点。
通常情况下,在白色背景下观察待测物质的熔化过程,在物质渐渐熔化后,出现透明液滴的瞬间即为物质的熔点。
通过熔点测定可以判断物质的纯度,一般来说,纯度较高的物质其熔点会比较尖锐,熔化温度较高而且范围较窄。
反之,含有杂质的物质,其熔点将会降低,范围较宽。
总的来说,熔点测定原理是基于物质的相互作用力和纯度特征,通过测量和观察物质在熔化过程中的物理变化来确定物质的熔点。
不同的测定方法根据不同的原理进行实验,以获得准确的熔点信息。

熔点测定原理熔点测定是一种常见的物质性质测试方法,通过观察物质在加热过程中熔化的温度来判断其纯度和结晶性。
熔点是物质由固态转变为液态的温度,是物质的重要性质之一。
熔点测定原理是基于物质在熔化过程中吸收或释放热量的特性,通过测量熔化时的温度变化来进行分析。
熔点测定原理基于热力学原理,物质在熔化时吸收的热量与其熔点密切相关。
当物质处于固态时,其分子或离子呈规则排列,而在熔化过程中,这种有序结构被打破,分子或离子开始自由移动,吸收热量,直到达到熔点温度。
因此,熔点测定可以通过观察物质在加热过程中的温度变化来确定其熔点,从而判断其纯度和结晶性。
在实际的熔点测定实验中,通常使用熔点仪进行测试。
熔点仪是一种专门用于测定物质熔点的仪器,通过加热样品并观察其熔化过程来确定其熔点。
在测定过程中,样品被装入熔点管或熔点皿中,然后放入熔点仪中进行加热。
同时,使用显微镜或熔点仪的温度计来观察样品的熔化过程,当样品完全熔化时所显示的温度即为其熔点。
熔点测定原理的应用非常广泛。
在化学领域,熔点测定常用于判断有机化合物的纯度和结晶性,从而确定化合物的质量和性质。
在药物研发和生产中,熔点测定也是一种常见的质量控制方法,用于检测药物的纯度和结晶形态。
此外,熔点测定还可以用于金属和合金材料的测试,以确定其熔化温度和成分。
总之,熔点测定原理是一种简单而有效的物质性质测试方法,通过测量物质在加热过程中的熔化温度来判断其纯度和结晶性。
这种方法在化学、药物和材料领域都有着重要的应用价值,对于研究和生产都具有重要意义。
通过深入理解熔点测定原理,我们可以更好地掌握这一测试方法,并更好地应用于实际工作中。

熔点测定的原理
熔点测定是一种常用的实验方法,用于确定物质的熔点。
其原理基于物质从固态转变为液态的过程中,温度保持稳定,即熔点。
熔点实验通常使用一根称为熔化点管的细玻璃管。
首先,将待测物质装入熔化点管中,然后将熔点管垂直放置在一个设有恒温电炉的实验装置中。
慢慢加热样品,当样品开始融化时,可以观察到熔融物质从熔点管底部散发出的气味或产生的气泡。
在熔融过程中,实验者使用一个被称为温度计的玻璃器皿,将其放在熔点管的熔融物质上方。
随着温度升高,熔融物质会不断上升,直到接触到温度计。
此时,读取温度计显示的温度即为物质的熔点。
这种方法的原理是,当物质的温度达到其熔点时,固态结构开始解离并逐渐转变为液态结构。
在这个温度下,固态和液态之间实际上处于动态平衡状态。
因此,观察到温度的稳定是因为熔融过程的释放热量可以抵消加热的热量,从而使温度保持不变。
通过测定物质的熔点,可以判断其纯度和性质。
纯度相对较高的物质通常具有更尖锐和更准确的熔点。
与此相反,杂质的存在可能会降低熔点或导致熔点范围的增加。
因此,利用熔点测定方法可以帮助确定物质的纯度。
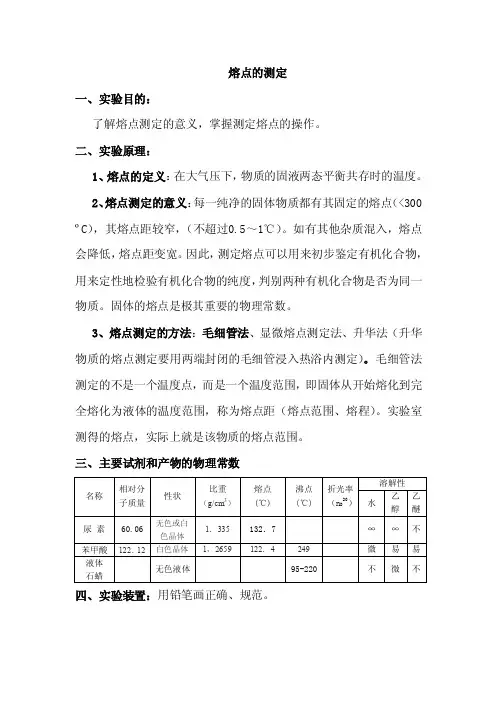
熔点的测定一、实验目的:了解熔点测定的意义,掌握测定熔点的操作。
二、实验原理:1、熔点的定义:在大气压下,物质的固液两态平衡共存时的温度。
2、熔点测定的意义:每一纯净的固体物质都有其固定的熔点(<300ºC),其熔点距较窄,(不超过0.5~1℃)。
如有其他杂质混入,熔点会降低,熔点距变宽。
因此,测定熔点可以用来初步鉴定有机化合物,用来定性地检验有机化合物的纯度,判别两种有机化合物是否为同一物质。
固体的熔点是极其重要的物理常数。
3、熔点测定的方法:毛细管法、显微熔点测定法、升华法(升华物质的熔点测定要用两端封闭的毛细管浸入热浴内测定)。
毛细管法测定的不是一个温度点,而是一个温度范围,即固体从开始熔化到完全熔化为液体的温度范围,称为熔点距(熔点范围、熔程)。
实验室测得的熔点,实际上就是该物质的熔点范围。
三、主要试剂和产物的物理常数四、实验装置:用铅笔画正确、规范。
五、实验步骤:1、仪器的选择和装配:选择梯勒管(b型管)、温度计(所测熔点要在温度计的量程内,否则温度计将被损坏)、熔点管[直径1mm、长度7-8cm的毛细管,已熔封。
将内壁洁净的毛细管在酒精灯的外焰上边烧边转至封口。
但注意不能烧太久,以至熔点管弯向一边,影响测定效果。
封好后可醮水检查是否为漏管(不能用吹气的方法),如进水,弃去,另熔封]、开口橡皮塞、橡皮圈等仪器,按P35图2-13装配好。
2、原料的配比:液体石蜡加至梯勒管上支管口上缘(太多受热易逸出引起火灾;太少又不能形成对流),样品高2-3mm(样品不能装太多太少。
太多,熔程拉大,太少,不便观察,产生熔点偏低)。
3、加料的顺序和方式:1)液体石蜡——直接加入。
2)待测样品——把干燥的样品研细,用角匙在干净表面皿上堆成小堆,将熔点管开口端插入粉末中,样品即被压入管内,然后取一根长约40-50cm的玻管,直立在另一俯放的表面皿上,让熔点管开口向上从玻管中自由落下,重复几次。
熔点的测定注意事项熔点是指物质由固态转变为液态的温度,是物质的重要物性之一。
测定熔点是化学实验中常见的操作,下面是测定熔点时需要注意的几个要点:1. 准备样品:样品应选择纯度高、结晶形态良好的物质。
如果可能,可以通过再结晶纯化来提高样品的纯度。
此外,还应注意避免潮湿、杂质等因素对样品造成影响。
2. 热源选择:熔点常用的热源有熔融点仪和加热板等。
熔融点仪通常具有较高的准确性和稳定性,可以更好地控制加热速率。
如果使用加热板,需要注意及时调整加热功率,避免样品受热过快,导致临界温度无法准确测定。
3. 温度测量:通常熔点测定时使用温度计测量样品的温度。
选择精确度高的温度计,如电子温度计或数码温度计,能够提高测量的准确性。
在测量之前,应先将温度计放置于样品中心位置,等待温度稳定。
4. 加热速率:加热速率对熔点的测定结果有较大影响。
加热速率过快可能导致熔点的准确测定困难,因此一般应采用缓慢加热的方法。
一般来说,加热速率约为1-2°C/min较为合适。
5. 记录观察现象:在样品加热的过程中,需要记录观察现象。
通常,样品加热时会出现融化、融化峰形成、液体透明等现象。
记录这些现象的发生时间和温度变化有助于找到准确的熔点。
6. 实验重复性:为了提高实验结果的可靠性,建议进行多次重复实验,取平均值作为测定结果。
如果多次实验结果差异较大,可能表明样品存在杂质或其他影响因素,需要重新选择样品或改进实验方案。
总之,在测定熔点时,需要准备优质样品,选择合适的热源和温度计,控制加热速率,记录观察现象,并进行多次重复实验。
通过细致认真的操作,可以得到准确可靠的熔点测定结果。
测熔点的方法
测熔点是化学实验中常用的方法之一,该方法可以帮助我们确定一种物质的纯度和性质,从而在实验中更准确地使用它。
以下是常用的几种测熔点的方法:
1. 热台法:将样品放在热台上,加热至熔化点,观察熔化的过程和温度变化,记录下熔点。
该方法适用于低熔点物质。
2. 热管法:将样品填充到玻璃热管中,加热热管,观察样品的熔化和凝固过程,记录下熔点。
3. 毛细管法:将样品装入毛细管中,将毛细管悬挂在恒温水浴中,加热至熔点,观察样品的熔化和凝固过程,记录下熔点。
该方法适用于高熔点物质。
4. 差热分析法:将样品和参比物质同时放入差热分析仪中,加热样品,观察样品和参比物质的热响应,记录下熔点。
该方法适用于高精度测量和自动化控制。
测熔点的方法因物质的性质和实验需求而异,我们可以根据具体情况选择合适的方法进行测量。
- 1 -。
熔点的测定实验报告结果与分析一、实验目的测定未知样品的熔点,了解熔点测定的基本原理和操作方法,掌握温度计的校正方法,学会通过熔点的测定来初步判断样品的纯度。
二、实验原理熔点是指固体物质在一定大气压下,从固态转变为液态时的温度。
纯净的固体有机化合物通常具有固定且敏锐的熔点,而混合物的熔点通常会降低且熔程变宽。
通过测定样品的熔点,可以初步判断样品的纯度。
本次实验采用毛细管法测定熔点。
将样品装入毛细管中,然后置于加热浴中缓慢加热,观察样品在加热过程中的状态变化,当样品开始熔化时记录此时的温度即为初熔温度,当样品完全熔化时记录此时的温度即为终熔温度,熔程即为终熔温度与初熔温度的差值。
三、实验仪器与药品1、仪器提勒管(Thiele tube)温度计(量程 150 300℃,分度值 1℃)酒精灯开口软木塞毛细管(内径 1 2mm,长度 70 80mm)表面皿玻璃管(用于填装样品)2、药品未知样品 A已知熔点的标准样品 B(用于校正温度计)四、实验步骤1、样品的装填取一根干燥洁净的毛细管,将一端在酒精灯上封口,形成一个封闭的毛细管。
取少量未知样品 A 于表面皿上,用玻璃管将其研细成粉末状。
将毛细管开口一端垂直插入样品粉末中,使样品通过毛细作用进入管内,高度约 2 3mm。
然后将装有样品的毛细管在桌面上墩几下,使样品紧密堆积在管底。
2、温度计的校正选择已知熔点的标准样品 B(其熔点准确值已知),按照上述样品装填的方法将标准样品装入另一根毛细管中。
将装有标准样品的毛细管固定在提勒管中,使样品位于温度计水银球的中部。
向提勒管中加入传热液体(如浓硫酸或液体石蜡),液面高度应高于上侧管的上沿。
用酒精灯缓慢加热提勒管,观察标准样品的熔化过程,当样品开始熔化时记录此时温度计的读数 T1,当样品完全熔化时记录此时温度计的读数 T2。
标准样品的准确熔点为 T0,则温度计的校正值ΔT = T0 (T1 +T2) / 2。
3、未知样品熔点的测定将装填好未知样品 A 的毛细管固定在提勒管中,使样品位于温度计水银球的中部。
熔点测定的操作方法
熔点测定是一种常用的化学分析方法,用于确定物质的熔点。
下面是一种常见的熔点测定操作方法:
1. 准备样品:将待测物质制备成适量的小粒状样品或固体物质。
2. 准备测定仪器:将量热仪或熔点仪预热至适当的温度,通常为室温至样品预计熔点的10C范围内。
将试管架或样品支架安装在熔点仪上。
3. 填充试管:在试管中放入一个小块玻璃纱或玻璃管珠,然后将待测样品放入试管中。
4. 熔化试样:将试管放入预热的熔点仪中,以适当速率加热试样,通常每分钟升温速率为1-2C。
观察试样的熔化情况。
5. 测定熔点:当样品完全熔化后,读取温度计的温度即为该物质的熔点。
记录下熔点数值。
6. 清洗:将试管取出,清洗试管和仪器,以备下次使用。
需要注意的是,不同的物质具有不同的熔点范围和特点。
在进行熔点测定之前,需对样品的性质和预期的熔点进行充分了解,并根据样品的特点和压力情况进行
适当的调整。