第二章 化学平衡习题
- 格式:doc
- 大小:77.51 KB
- 文档页数:8

第二章 化学平衡 单元练习第Ⅰ卷(选择题 共46分)一.选择题(本题包括8小题,每小题2分,共16分。
每小题只有一个选项符合题意。
) 1.将SO 2和18O 2充入反应容器,当反应达到平衡时18O 原子将存在于A. 氧气和三氧化硫中B. 只存在于SO 3中C. 三种物质中都有D. 无法判断 2.反应2A(气)B(气)+x C(气)在一定条件下达到平衡,容器内压强增大了p %,测得A 的转化率为p %,则x 值为A. 1B. 2C. 3D. 43.在合成氨反应中,开始充入amolN 2和bmolH 2,在一定条件下,反应达平衡,测得NH 3占混合气体的25%,则平衡时N 2的转化率是A. )%101.0(ab + B. 0.1(a+b) C. 33.3% D. 1010(b +4.在容积固定的2L 密闭容器中,充入X 、Y 各2mol ,发生可逆反应X(g)+2Y(g)2Z(g)衡,以Y 的浓度改变表示的反应速率v 正、v 逆与时间t 的关系如图。
则Y 的平衡浓度表达式正确的是(式中S 指对应区域的面积 A. 2-S aob B. 1- S aob C. 2-S abdo D. 1-S bod 0 d t/s 5.在一定条件下,某容器中充入N 2和H 2合成NH 3,以下叙述中错误的是 A. 开始时,正反应速率最大,逆反应速率为零B. 随反应的进行,逆反应速率逐渐减小,最后正反应速率减小为0C. 随着反应的进行,逆反应速率逐渐增大,最后保持恒定D. 随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等,且都保持恒定 6.在下列四种液体中,加入少量固体二氧化锰能产生气体的是A. 蒸馏水B. 稀盐酸C. 30%双氧水D. 氯酸钾溶液7.100mL6mol/LH 2SO 4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的A. 碳酸钠(s)B. 氢氧化钠(s)C. 硫酸钾溶液D. 硫酸铵(s)8.在温度恒定下,把2mol(a)SO 2和1mol(b)O 2或2mol(c)SO 3,通入一个定容的装有催化剂的密闭容器里反应达到平衡。
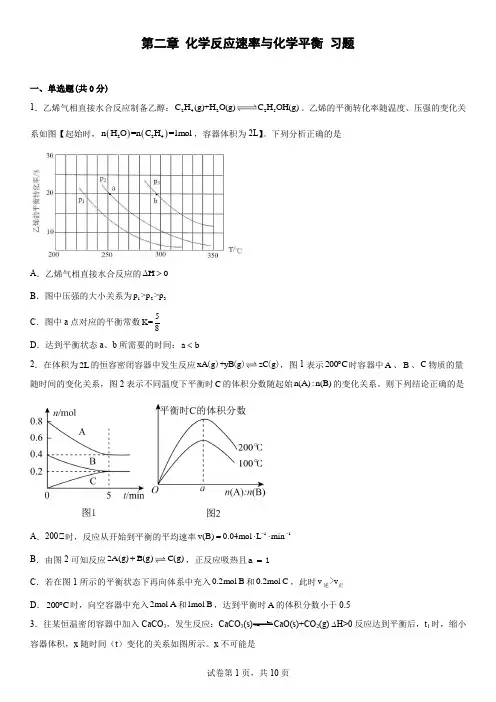
第二章 化学反应速率与化学平衡 习题一、单选题(共0分)1.乙烯气相直接水合反应制备乙醇:24225C H (g)+H O(g)C H OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,()()224n H O =n C H =1mol ,容器体积为2L 】。
下列分析正确的是A .乙烯气相直接水合反应的H 0∆>B .图中压强的大小关系为123p >p >pC .图中a 点对应的平衡常数5K=8D .达到平衡状态a 、b 所需要的时间:a b <2.在体积为2L 的恒容密闭容器中发生反应xA g yB g zC g ()+()(),图1表示200C ︒时容器中A 、B 、C 物质的量随时间的变化关系,图2表示不同温度下平衡时C 的体积分数随起始n(A):n(B)的变化关系。
则下列结论正确的是A .200℃时,反应从开始到平衡的平均速率11v(B)0.04mol L min --=⋅⋅B .由图2可知反应2A(g)B(g)C(g)+,正反应吸热且a 1=C .若在图1所示的平衡状态下再向体系中充入0.2mol B 和0.2mol C ,此时逆正v >vD .200C ︒时,向空容器中充入2mol A 和1mol B ,达到平衡时A 的体积分数小于0.5 3.往某恒温密闭容器中加入CaCO 3,发生反应:CaCO 3(s)CaO(s)+CO 2(g) ∆H>0反应达到平衡后,t 1时,缩小容器体积,x 随时间(t )变化的关系如图所示。
x 不可能是A .v 逆B .c(CO 2)C .∆HD .ρ(容器内气体密度)4.下列叙述及解释正确的是 A .2242NO (g)(红棕色)N O (g)(无色) 0H ∆<,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 B .22H (g)+I (g)2HI(g) 0H ∆<,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 C .22C(s)+O (g)2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动D .223N (g)+3H (g)2NH (g),在达到平衡后,保持压强不变,充入2O ,平衡向左移动5.甲苯(用C 7H 8表示)是一种挥发性的大气污染物。

第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态基础过关练题组一化学平衡状态的理解与应用1.如图是可逆反应X(g)+3Y(g) 2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()A.t2~t3时,各物质的浓度不再发生变化B.t2时,反应未达到限度C.t2~t3时,反应已停止进行D.t1时,反应只向正反应方向进行2.(经典题)(2023黑龙江铁人中学月考)在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是()A.X2为0.2 mol·L-1B.Y2为0.2 mol·L-1C.Z为0.3 mol·L-1D.Z为0.45 mol·L-13.(2024江苏苏州月考)向容积为1 L的密闭容器中通入一定量N2O4和NO2的混合气体,发生反应N2O4(g) 2NO2(g)ΔH>0。
体系中各物质浓度随时间的变化如图所示。
下列有关说法正确的是()A.64 s时,反应达到化学平衡状态B.达到化学平衡前,混合气体的颜色逐渐变深C.容器中气体的总物质的量浓度最多为2.6 mol·L-1D.若该容器与外界无热传递,则反应达到平衡前,容器内气体的温度逐渐升高题组二化学平衡状态的判断4.工业上用化学气相沉积法制备氮化硅,其反应为3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g)。
一定条件下,在恒容密闭容器中,能表示上述反应达到化学平衡状态的是()A.3v(N2)=v(H2)B.v正(HCl)=4v正(SiCl4)C.混合气体密度保持不变D.c(N2)∶c(H2)∶c(HCl)=1∶3∶65.(2023河北省示范高中期中)一定温度下,在恒容密闭容器中发生反应C2H4(g)+H2(g) C2H6(g)ΔH<0。

第二章化学反应速率与化学平衡分层习题含答案2022—2023学年上学期高二化学人教(2019)选择性必修一一、选择题。
(18题)1、在四种不同条件下测得反应2SO2+O22SO3的反应速率如下表所示:编号(1) (2) (3) (4)v(SO2) v(O2) v(SO3) v(O2)0.4 0.25 0.5 0.3其中反应速率最大的是()A.(1)B.(2)C.(3)D.(4)2、A2(g)+B2(g)=2AB(g),ΔH >0。
下列因素能使活化分子百分数增加的是()A. 降温B. 使用催化剂C. 增大反应物浓度D. 增大气体的压强3、下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是( )A. Cu能与浓硝酸反应,但不能与浓盐酸反应B. Fe与浓盐酸反应比与稀盐酸反应快C. N2与O2在常温、常压下不反应,放电时可反应D. Cu与浓硝酸反应比与稀硝酸反应快4、对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是() A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少B.化学反应速率关系是:2v正(NH3)=3v正(H2O)C.达到化学平衡时,4v正(O2)=5v逆(NO)D.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态5、在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其发生反应CO(g)+H2O(g)CO2(g)+H2(g)并达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是()A.平衡后CO的体积分数为40%B.平衡后CO的转化率为25%C.平衡后水的转化率为50%D.平衡后混合气体的平均相对分子质量为246、下列措施或事实不能用勒夏特列原理解释的是()A.H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2+I22HI) B.红棕色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)N2O4 (g)) C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率D.滴加酚酞的氨水中加入氯化铵固体后红色变浅7、配制硫酸铝溶液时,为得到澄清的溶液经常在配制过程中加入少量的()A. H2OB. NaOH溶液C. H2SO4溶液D. Na2SO4溶液8、二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,也是未来实现低碳经济转型的重要环节。
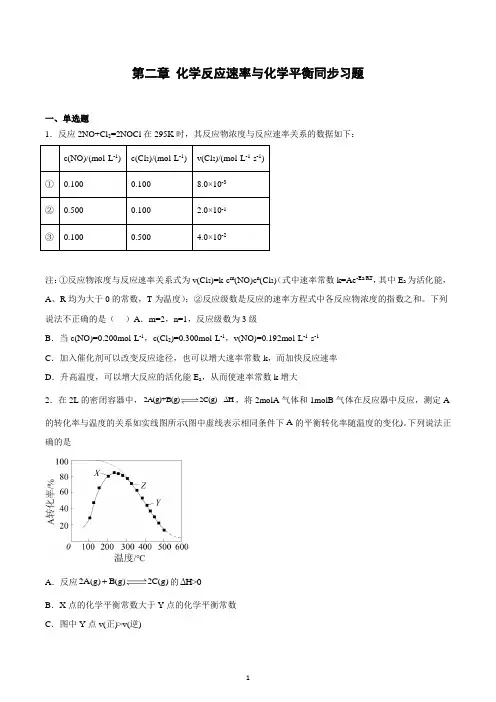
第二章化学反应速率与化学平衡同步习题一、单选题1.反应2NO+Cl2=2NOCl在295K时,其反应物浓度与反应速率关系的数据如下:注:①反应物浓度与反应速率关系式为v(Cl2)=k·c m(NO)c n(Cl2)(式中速率常数k=Ae-Ea/RT,其中E a为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程式中各反应物浓度的指数之和。
下列说法不正确的是()A.m=2,n=1,反应级数为3级B.当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=0.192mol·L-1·s-1C.加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率D.升高温度,可以增大反应的活化能E a,从而使速率常数k增大2.在2L的密闭容器中,2A(g)+B(g)2C(g)ΔH,将2molA气体和1molB气体在反应器中反应,测定A 的转化率与温度的关系如实线图所示(图中虚线表示相同条件下A的平衡转化率随温度的变化)。
下列说法正确的是的ΔH>0A.反应2A(g)B(g)2C(g)B.X点的化学平衡常数大于Y点的化学平衡常数C.图中Y点v(正)>v(逆)D .图中Z 点,增加B 的浓度不能提高A 的转化率3.100mL6mol/LH 2SO 4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量。
可向反应物中加入适量的 A .碳酸钠(固体)B .水C .硫酸铜溶液D .硫酸铵(固体)4.化学反应进行的方向是一个比较复杂的问题。
下列有关说法正确的是 A .反应3224SO (g)H O(1)H SO (l)+=的ΔS>0B .1mol 2CO 在不同状态时的熵值:[][]22S CO (g)<S CO (s)C .反应25222N O (g)4NO (g)O (g)=+H 0∆>能否自发进行与温度有关D .H 0∆<或ΔS>0的反应一定能自发进行 5.合成氨反应为223N (g)+3H (g)2NH (g) 1ΔH=92.4kJ mol --⋅。

第二章 化学平衡习题一.选择题 1. 下列反应Kc 的单位是( ) 2.2X(g)+2Y(g)=3Z(g)A L·mol -1B mol·L -1C L 2·mol 2D mol 2·mol -23.下列哪一个反应的Kc 和Kp 的数值相等( ) A. 3H 2(g)+N 2(g)=2NH 3(g) B. H 2(g)+I 2(g)=2HI(g) C. CaCO 3(s)=CaO(s)+CO 2(g) D. 2F 2(g)+2H 2O(l)=2HF(g)+O 2(g) 4.一定条件下,合成氨反应呈平衡状态, 3H 2+N 2=2NH 3-------K 1 32 H 2+12 N 2=NH 3--------K 2 则K 1与K 2的关系为( ) A. K 1=K 2 B. K 22=K 1 C. K 12 = K 2 D. 无法确定 5.已知: 2SO 2+O 2=2SO 3反应达平衡后,加入V 2O 5催化剂,则SO 2的转化率( ) A. 增大 B. 不变 C. 减小 D. 无法确定6. 正反应能自发进行和反应达平衡的条件分别为( ) A. Qp>Kp ,△G<0 B. Qp>Kp ,△G>0 C. Qp<Kp ,△G<0 D. Qp<Kp ,△G>0 E. Qp=Kp ,△G=07. 醋酸铵在水中存在着如下平衡:NH 3+H 2O NH 4+ + OH - -------K 1 HAc+H 2O Ac - + H 3O + -------K 2 NH 4+ + Ac - HAc + NH 3 -------K 3 2H 2OH 3O + + OH - --------K 4以上四个反应平衡常数之间的关系是( ) A. K 3=K 1K 2K 4 B. K 4=K 1K 2K 38.可逆反应,C(s)+H 2OCO(g)+H 2(g) △H>0,下列说法正确的是( )A. 达到平衡时,反应物的浓度和生成物的浓度相等B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化C. 由于反应前后分子数相等,所以增加压力对平衡没有影响D . 加入正催化剂可以加快反应达到平衡的速度E. 升高温度使V 正增大,V 逆减小,结果平衡向右移动 9.合成氨反应: N 2(g)+3H 2(g)2NH 3(g)的平衡常数3N NH p2H23p p p K =:当体系总压力增大一倍时,同温下重新建立平衡,此时:3H N 2NH p 223'p 'p 'p 'K =, K p 与K p ’ 的关系为( )A. K p =1/4K p ’B. K p =4K p ’C. K p =K p ’D. K p 与K p ’没有如上关系10. 下列因素对转化率无影响的是( )A. 温度B. 浓度C. 压力(对气相反应)D. 催化剂11. 反应物的浓度相同,反应温度相同,反应:(1) mA + nBpC (2) X+2YZ对A 和X 而言,转化率大的是( )A. X>AB. A>XC. X=AD. 无法确定 12. 反应: A(g)+B(s)C(g),在400K 时,平衡常数Kp=0.5.当平衡时,体系总压力为100kPa 时,A的转化率是( )A. 50%B. 33%C. 66%D. 15%13. 已知反应N 2O 4(g)→2NO 2(g)在873K 时,K 1=1.78×104,转化率为a%,改变条件,并在1273K 时,K 2=2.8×104,转化率为b%(b>a),则下列叙述正确的是( ) A. 由于1273K 时的转化率大于873K 时的,所以此反应为吸热反应 B. 由于K 随温度升高而增大,所以此反应的△H>0 C. 由于K 随温度升高而增大,所以此反应的△H<0 D. 由于温度不同,反应机理不同,因而转化率不同 14. 在276K时反应: CO(g)+H 2O(g)CO 2(g)+H 2(g)的Kc=2.6,当CO(g)与H 2O(g)的浓度(mol·L -1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO 的转化率( )15.对于反应: C(S)+H2O(g) = CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是( )A. 升高反应温度B. 降低反应温度C. 增大体系的总压力D. 增大H2O(g)的分压E. 多加入C(S)16.反应: 2SO2(g)+O2(g) 2SO3(g),△H<0,根据勒夏特列原理,和生产的实际要求,在硫酸生产中,下列哪一个条件是不适宜的( )A. 选用V2O5作催化剂B. 空气过量些C. 适当的压力和温度D. 低压,低温17.下列反应处于平衡状态,2SO2(g)+O2(g) 2SO3(g) △H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( )A. 降低温度B. 增大压力C. 加入氧气D. 去掉三氧化硫17.下列叙述正确的是( )A. 在化学平衡体系中加入惰性气体,平衡不发生移动B. 在化学平衡体系中加入惰性气体,平衡发生移动C. 恒压下,在反应之后气体分子数相同的体系中加入惰性气体,化学平衡不发生移动D. 在封闭体系中加入惰性气体,平衡向气体分子数减小的方向移E. 在封闭体系中加入惰性气体,平衡向气体分子数增多的方向移动18.下列关于催化剂作用的叙述中错误的为( )i.可以加速某些反应的进行B. 可以抑制某些反应的进行C. 可以使正逆反应速度以相等的速度加快D. 可以改变反应进行的方向19.勒沙特列原理( )A. 只适用于气体间的反应B. 适用所有化学反应C,只限于平衡时的化学反应 D. 适用于平衡状态下的所有体系a)一定温度下反应: PCl5(g) PCl3(g)+Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( )A. 体积增大一倍B. 保持体积不变,加入氮气使总压力增大一倍C. 保持总压不变,加入氮气使总体积增大一倍D. 增大PCl5的分压E. 降低PCl5的分压20.已知下列反应的平衡常数,H2(g)+S(s) H2S(g) (1) K1S(s)+O2(g) SO2(g) (2) K2则反应: H2(g)+SO2(g) O2(g)+H2S(g) 和反应: SO2S(s)+O2(g)的平衡常数分别为( )A. 1/K1B. 1/K2C. K1-K2D. K2/K1E. K1/K2二.填空题1.已知:(1) H2O(g)=H2(g)+12 O2(g),Kp=8.73×10-11(2) CO2(g)=CO(g)+ 12 2O2(g),Kp=6.33×10-11则反应: CO2(g)+H2(g)=CO(g)+H2O(g)的Kp为_________,Kc为__________2.298K时,HBr(aq)离解反应的△Gø=-58kJ·mol-1,其Ka应为__________由Ka的数值说明_______3.1073K时,反应: CO(g)+H2O(g) CO2(g)+H2(g)的Kc=1,在最初含有1.0molCO(g)和1.0molH2O(g)的混合物经反应达到平衡时,CO的物质的量为___mol,其转化率为________________ 4.已知反应: A(g)+B(g) C(g)+D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________5.下列反应处于平衡状态,X(g)+Y(g) 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将___________,化学平衡将___________.6.反应: (a) C+H2O CO+H2 (b) 3H2+N22NH3,在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________三.问答题1.乙酸和甲醇可按下式反应:CH3COOH+CH3OH CH3COOCH3+H2O298K时K C=4,经过计算,(1)反应物均为1mol,(2)甲醇为1mol,乙酸为3mol时甲醇的转化率?对结果作出解释.2.对反应: mA+nB pC,△H<0 ,升高温度,对反应速度和化学平衡有何影响. 为什么?3.催化剂能影响反应速度,但不能影响化学平衡,为什么?4.简述在合成氨生产中: N2(g)+3H2(g)2NH3(g). △Hø=-92.4KJ·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高?四.计算题1.在某温度下密闭容器中发生如下反应: 2A(g)+B(g) 2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和2.2×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少?2.已知某反应在25℃时,K p=5.0×1017,求此反应的△Gø.3.把3体积H2和1体积N2混合加热,在10Pø条件下,达到平衡,其中NH3含3.85%(体积百分数).计算:当压力为50Pø时NH3占的体积百分数.(Pø=101.3 kPa)4.反应: CO+H2O CO2+H2(均为气体)达到平衡时,Pco=40kPa ,P CO2=40kPa,P H2= 12kPa,P H2O =20kPa,在恒温恒容下通入CO气体,P H2=17 kPa,试计算新平衡下各气体的分压.5.设H2,N2和NH3在达平衡时总压力为500kPa,N2的分压为100kPa,此时H2的物质的量的分数为0.40,试计算下列几种情况的Kp值.1. N2(g)+3H2(g) 2NH3(g) K p12. NH3(g) N2(g)+3H2(g) K p26.已知反应: PCl5(g) PCl3(g)+Cl2(g)523K时在2L容器中的0.7molPCl5有0.5mol分解了,计算:(1) 该温度下反应的K c和K p(2) 若在上述密闭容器中又加入0.1molCl2, PCl5的分解百分率是多少.第二章化学平衡习题答案一.选择题1. A2. B3. B4. B5. C E6. B7. B D8. C9. D 10. D 11. B 12. B 13. C 14. A D 15. D 16. A 17. C D 18. D 19. D 20. A C 二.填空题1.7.25×10-17.25×10-12. 1.46×1010HBr(aq)离解的很完全3.0.5mol 50%4.67% 33.35.加快向左移动6.无影响使平衡右移三.问答题1.答:(1) CH3COOH + CH3OH CH3COOCH3 + H2O始: 1 1 0 0平: 1-X 1-X X XX2(1-X)2= K C = 4 X=0.67α1=0.671×100%=67%(2) y2/(1-y)(3-y)=K c=4,y=0.9 α2=90%α2>α1,是由乙酸的浓度增大,使平衡右移导致甲醇的转化率升高2.答: 升高温度,可以加快正逆反应的反应速度,平衡将逆向移动.因升高温度使速度常数增大,反应速度则加快.(或从活化分子百分数增大,有效碰撞增多,微观角度说明).依据勒夏特列原理,升高温度,平衡向吸热方向移动.给出反应,逆向吸热,正向放热,所以平衡将逆向移动.3.答: 因为催化剂能起到改变反应历程,从而改变反应活化能的作用,所以能影响反应速度,但由于催化剂同时改变正,逆反应的活化能,同等速度的影响正,逆反应速度,而改变反应的始态和终态,所以不影响化学平衡.4. 答: 对于此反应,低温有利于提高反应物的转化率,但低温反应速度慢,使设备利用率低,单位时间合成氨量少,为使其有较高的转化率,和较快的反应速度,单位时间内合成较多的氨,常以催化剂的活性温度为该反应的控制温度.高压对合成氨有利,但压力过高对设备要求高,运转费高,因此,压力不宜过高,为了得到更多的氨,常用加压,冷却合成气的方法,以分离氨,使平衡右移.四.计算题 1.解:2A(g) + B(g)2C(g)始: 2×105 1×105 0平: (2×105-X) (1×105-1/2X) X 有 (2×105-X)+(1×105-1/2X)+X=2.2×105 X=1.6×105(Pa) =1.6×1052×105×100%=80% K=P C 2P A 2P B= 1.6×105(0.4×105)(0.2×105) =8×10-4 2.解:∵ △G ø=-2.30RTlgK p∴ △G ø=-2.30×8.31×(273+25)×lg5.0×1017=100813(J·mol -1) =1.008×102(kJ·mol -1)3.解:平衡时,P(NH 3)=10×3.85%=0.385P ø P(N 2)=10-0.3854 =2.40P øP(H 2) =3P(N 2) = 7.2P ø K p =P(NH 3)/P(H 2)P(N 2) = 0.3857.2×2.4= 1.65×10-4设50P ø时,NH 3占X P=50XP ø P(N 2) =504(1-X)=(12.5-12.5X)P øP(H 2) =(37.5-37.5X)P ø(50X)(37.5-37.5X)3(12.5-12.5X)= 1.65×10-4X=0.15 NH 3占15%. 4.解:K P =OH CO CO H 222p p p p =40×1240×20=0.6 恒容下通入CO 使P(H 2)增大 17-12=5(kPa)P’(CO 2)= 40+5 = 45(kPa) P’(H 2O) = 20-5=15(kPa)K P =OH CO CO H 222p p p pP ’CO =pO H CO H K p p p 222 =17×450.6×15=85(kPa) 5. 解:N 2的物质的量的分数为100500=0.2,则NH 3的为1-0.2-0.4=0.4 则P=500×0.4=200kPa , P(H 2)=500×0.4=200kPa(1) K p1=P(NH 3)/[P(H 2)P(N 2) =200200×100 =5×10-5(2) K p2=1K=1.4×1026.解:(1) PCl 5 PCl 3 + Cl 2平衡:0.7-0.520.5/2 0.5/2 (mol/L) 即: 0.1 0.25 0.25 K c =[PCl 3][Cl 2][PCl 5] = (0.25)0.1= 0.625K p = K c (RT)2 -11= 0.625(0.082×523)1 = 26.8 (2) 设有X mol 转化为PCl 5 PCl 5PCl 3 + Cl 2平衡:0.1+X 2 0.25-X 2 0.25+(0.1-X)20.25-X20.3-X 20.1+X2= 0.625 解,得: X = 0.045 (mol)PCl5的分解百分率为: 0.25-X2×20.70×100% =65%。


第二章第三节化学平衡移动练习题(1)一、选择题1.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动2.在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3.下列说法正确的是() A.可逆反应的特征是正反应速率总是和逆反应速率相等B.其他条件不变时,使用催化剂只改变反应速率,而不能改变化学平衡状态C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态4.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物 B.对平衡体系加压C.升高温度 D.使用催化剂5.对平衡CO 2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压 C.升温减压D.降温增压6.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。
合成氨反应在铁催化剂表面进行时效率显着提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是()A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动B.将氨气从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动C.升高温度可加快反应速率,且有利于平衡向合成氨的方向移动D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动7.关于催化剂的叙述,正确的是()A.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.使用催化剂可以改变反应达到平衡的时间D.催化剂可以提高反应物的转化率8.对于可逆反应2A2(g)+B22B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是()A.升高温度B.降低温度C.增大压强D.减小压强9.在一容积固定的密闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,再通入18O2气体,重新达平衡。

高二化学第二册第二章化学平衡同步练习(带答案)在化学反应条件下,因反应条件的改变,使可逆反应从一种平衡状态转变为另一种平衡状态的过程,叫化学平衡的移动。
以下是第二章化学平衡同步练习,请大家及时练习。
1.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是()A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)解析:速率之比等于方程式的计量系数之比,A项,v(W)=v(Z);B项,3v(X)=2v(Z);C项,2v(X)=v(Y);D项,2v(W)=3v(X)。
答案:C2.已知反应A2(g)+2B2(g) 2AB2(g) 0,下列说法正确的是()A.升高温度正反应速率加快,逆反应速率减慢B.0.1 mol A2和0.2 mol B2反应达到平衡时生成0.2 mol AB2C.达平衡后,升高温度,B的转化率不变D.催化剂可同等程度地改变正、逆反应速率解析:升高温度正、逆反应速率都加快,A不正确;该反应是可逆反应,不可能进行彻底,B不正确;平衡后,升高温度,平衡右移,B的转化率增大,C不正确。
答案:D3.(2019烟台模拟)在密闭的容器中进行如下反应:H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量和时间的关系如图所示,根据图像判断正确的是()A.T1T2,0C.T10D.T1T2,0解析:由图像可知,温度为T2时达到化学平衡所需的时间短,表明温度T2T1,从T1T2表示升温,达到平衡时HI含量降低,表明正反应是放热反应,即0,故选A。
答案:A4.(2019全国卷Ⅱ)在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25 %, 则平衡时的氮气的体积分数接近于()A.5%B.10%C.15%D.20%解析:N2+3H2 2NH3起始量(mol) 2 8 0转化量(mol) 2/3 2 4/3平衡量(mol) 4/3 6 4/3所以平衡时的氮气的体积分数=436+83=15.4%。

高二化学第二册第二章影响化学平衡的条件同步练习(带答案)因反应条件的改变,在化学反应条件下使可逆反应从一种平衡状态转变为另一种平衡状态的过程,叫化学平衡的移动。
以下是第二章影响化学平衡的条件同步练习,请大家及时练习。
一、选择题1.在下列反应中,降低温度和增加压强时都能使平衡向正反应方向移动的是( )。
A.CO+H2O(气)CO2+H2(正反应为放热反应)B.2SO3(气)2SO2+O2(正反应为吸热反应)C.2HCI(气)H2+Cl2(正反应为吸热反应)D.CaO+CO2CaCO3(正反应为放热反应)答案:D2.可逆反应2HI(气)H2(气)+I2(气)(正反应为吸热反应)在一固定容积的密闭容器中进行,当达到平衡时,欲使混合气体的颜色加深,应采取的措施为( )A.减小容器体积B.降低温度C.充入HI气体D.加入催化剂答案:AC3.化学反应C(固)+H2O(气)CO(气)+H2(气)(正反应为吸热反应)达到平衡,下列叙述中正确的是( )。
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动B.加入固体炭,平衡向正反应方向移动C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动D.扩大容器的容积,平衡向正反应方向移动答案:D4.反应mA+nBPC,A、B、C代表气体物质的分子式,m、n、p 为系数,若反应生成物的浓度在温度升高、压强降低时增大,那么下列式子中正确的是( )。
A.m+np(正反应为放热反应)B.m+nC.m+np(正反应为吸热反应)D.m+n答案:B5.不能用勒沙特列原理解释的是( )。
A.棕红色的二氧化氮加压后颜色先变深后变浅B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深C.黄绿色的氯水光照后颜色变浅D.煅烧粉碎的硫铁矿利于SO2的生成答案:BD6.在下列平衡体系中,采用括号内的措施后,平衡向正反应方向移动且反应速率增大的是( )。
A.N2(气)+O2(气)2NO(气)(加压)B.N2(气)+3H2(气)2NH(气)(移出NH3)C.2SO3(气)2SO2(气)+O2(气)(降温)D.2NO2(气)N2O4(气)(加压)答案:D7.在1 000℃以上的高温,存在下列平衡:C+CO22CO(正反应为吸热反应),根据热化学方程式,采取什么手段来抑制CO 的生成?其答案是( )。

高中化学(必修一)第二章 化学平衡状态 练习题(含答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列说法错误的是A .化学反应达到限度时,正、逆反应速率相等B .可以通过延长反应的时间来改变化学反应的限度C .某一条件下,当一个反应达到平衡状态时,反应物的转化率达最大D .同一个化学反应在不同的条件下限度可能不同2.一定温度下,在恒容密闭容器中,将10mol CO 和一定量的2H S 混合加热可得下列平衡22CO(g)H (g)CO (g)H (g)S S ++,已知平衡后CO 物质的量为8mol 且K=0.1。
下列说法正确的是A .CO 的平衡转化率为80%B .通入CO 后,正反应速率逐渐增大C .反应前2H S 物质的量浓度为17mol L -⋅D .升高温度,2H S 浓度增加,表明该反应是放热反应3.一定温度下向容器中加入A 发生反应如下:①A→B ,①A→C ,①B ⇌C 。
反应体系中A 、B 、C 的浓度随时间t 的变化曲线如图所示。
下列说法错误的是A .反应①的活化能大于反应①B .该温度下,反应①的平衡常数大于1C .t 1时,B 的消耗速率大于生成速率D .t 2时,c(C)=c 0-c(B) 4.已知合成氨的反应为N 2+3H 22NH 3,各物质的浓度数据如下表:当用氨气浓度的增加来表示该化学反应的速率时,其速率为A .0.2mol·L -1·s -1 B .0.4mol·L -1·s -1 C .0.6mol·L -1·s -1D .0.8mol·L -1·s -15.在某恒容密闭容器中充入一定量的O 2(g)和O 3(g),发生反应2O 3(g)3O 2(g) △H <0,下列说法正确的是A .若混合气体的密度不再随时间而改变,则该反应达到平衡B .加入合适的催化剂,反应达到平衡后,O 2的体积分数增大C .该反应的生成物的总能量大于反应物的总能量D .若起始时充入少量的稀有气体,则该反应的反应速率保持不变6.一定温度下,在恒容密闭容器中发生反应:CO 2(g) + 3H 2(g)⇌CH 3OH(g) + H 2O(g)。
第3题图 第二章 化学反应速率与化学平衡复习题一、单项选择题:每小题只有一个选项符合题意1.4NH 3g+5O 2g== 4NOg+6H 2Og,该反应在5L 的密闭容器中进行,半分钟后,NO 物质的量增加 了0 . 3mol,则此反应的平均速率为 A. VO 2=L -1s -1 NO= molL -1s -1 H 2O= molL -1s -1 NH 3 = molL -1s -1 2. 把气体和气体混合于2L 容器中, 使它们发生如下反应:3Xg+Yg== n Zg+2Wg; 5min 末已生成,若测知以Z 浓度变化来表示的反应平均速率为 molL -1min -1,则上述反应中Z 气体的反应方程式系数n 的值是 B.2 3.在密闭容器中进行下列反应:Mg + Ng Rg + 2L 此反应符合右图,下列叙述正确的是A .正反应吸热 ,L 是气体B .正反应吸热, L 是固体C .正反应放热 ,L 是气体D .正反应放热 ,L 是固体或液体4.乙酸蒸气能形成二聚分子: 2CH 3COOH 气 CH 3COOH 2气;⊿H<0现欲测定乙酸的相对分子质量,应采用的反应条件是: A.低温高压 B.高温低压 C.低温低压 D.高温高压 5. 一定温度下,反应N 2g+3H 2g2NH 3g 达到化学平衡状态的标志是A. c N 2: c H 2: c NH 3=1:3:2B. N 2、H 2和NH 3的物质的量分数不再改变C. N 2与H 2的物质的量之和是NH 3的物质的量的2倍D. 单位时间里每增加1mol N 2,同时增加3mol H 2 6. 下列体系加压后,对化学反应速率没有影响的是 A. 2SO 2+O 2 2SO 3 B. CO +H 2Og CO 2+H 2C. CO 2+H 2OH 2CO 3 D. OH -+H +=H 2O7. 将1molSO 2和1molO 2通入一体积不变的密闭容器中,在一定温度和催化剂 作用下,反应达到平衡,SO 3为;此时若移走和,则反应达到新的平衡时,SO 3的物质的量为 A . B . C .小于 D .大于,小于8. 如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO 和O 2,且恰好使两容器内气体密度相同,打开活塞,使NO 与O 2充分反应,最终容器内混合气体密度比原来A. 增大B. 减小C. 不变D. 无法确定 二、不定项选择每小题有一个或两个选项符合题意;9. 下列变化过程中,⊿S<0的是 A.干冰的升华 B. NH 3 g+ HCl g =NH 4Cl sC. 氯化钠溶于水中D. CaCO 3 s 分解为CaO s 和CO 2g10. 下列反应在常温下均为非自发反应,在高温下仍为非自发的是: A. 2Ag 2O s == 4 Ag s + O 2 g B. 2Fe 2O 3 s +3C s == 4Fe s + 3CO 2 g C. N 2O 4 g == 2NO 2 g D. 6 C s +6 H 2O l == C 6H 12O 6 s 11.温度一定时, 在密闭容器中发生可逆反应: mA 气 + nB 气pC 气, 达到平衡后, 若将混合气体的体积压缩到原来的1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 . 9 倍, 则下列叙述中正确的是:A. 平衡向逆反应方向移动B. C气体的体积分数增大C. 气体A的转化率升高D. m + n < p12. 一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5g PCl3g+Cl2g反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是>p2的分解率增大>p2的体积分数减小13. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律图中P表示压强,T表示温度,n表示物质的量:根据以上规律判断,下列结论正确的是:A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1>T2C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1D.反应Ⅳ:△H<0,T2>T114.往一体积不变的密闭容器中充入H2和I2,发生反应H2g +I2g 2HI g ⊿H<0,当达到平衡后,t0时改变反应的某一条件混合气体物质的量不变,且造成容器内压强增大,下列说法正确的是A 容器内气体颜色变深,平均相对分子质量不变B 平衡不移动,混合气体密度增大C H2转化率增大,HI平衡浓度变小D 改变条件前后,速率图象为右图15.在体积不变的密闭容器中发生反应2SO2气+O2气2SO2气,起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为A.30mol和20% B.20mol和20% C.20mol和80% D.30mol和80%16. 某恒容密闭容器中, 放入一定量的NO2, 发生下列反应: 2NO2气N2O4气; ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均相对分子质量减小的是A. 通入N2B. 通入NO2C. 升高温度D. 通入N2O417. 在容积一定的密闭容器中,可逆反应A2g+B2g x Cg 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是<P4,Y轴表示A2的转化率<P4,Y轴表示A2的浓度>P4,Y轴表示混合气体的密度>P4,Y轴表示混合气体的平均摩尔质量18. 用来表示可逆反应2Ag+Bg2Cg;△H<0的正确图象是:三、填空题:19. A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L;反应进行2min时恰好达平衡,此时A的浓度为L,B的浓度为L,C的浓度为L;则2min内反应的平均速率vA=_________,反应的化学方程式为______________________________________________20. 有A、B、C、D 四个反应:反应 A B C D△H/kJmin-116 23 -120 -13⊿S/Jmol-1K-140 -110 88 -65则在任何温度都能自发进行的反应是_________;任何温度都不能自发进行的反应是__________;另两个反应中,在温度高于__________℃时可自发进行的反应是_______;在温度低于_________℃时可自发进行的反应是__________;21. 在密闭容器中,保持一定温度进行如下反应:N2g+3H2g 2NH3g,已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3见下表中编号①的一行;若相同条件下,达到平衡时混合物中各组分的百分含量不变;回答下列问题:1写出该反应的化学平衡常数表达式:K=___________;2平衡常数K值越大,表明建立平衡时___________填序号A. N2的转化率越高B. NH3的产量越大C. 正反应进行得越彻底D. 化学反应速度越快3a与b的关系是:a ____ b填>、<、=4填写下表:状态条件起始时物质的物质的量mol 平衡时NH3的物质的量mol编号XN2YH2ZNH3恒容① 1 3 0 b②0 0 b③ b22. 在5L的密闭容器中充入2mol A气体和1molB气体,在一定条件下发生反应:2Ag+Bg 2Cg,达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的5/6,求A的转化率.23. 在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应;各物质的起始加入量如下:A、B和C均为mol、D为mol、F为mol,设E为x mol;当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置;请填写以下空白:①.若x=,则右侧反应在起始时向填“正反应”或“逆反应”方向进行;欲使起始反应维持向该方向进行,则x的最大取值应小于;②.若x分别为和,则在这两种情况下,当反应达平衡时,A的物质的量是否相等填“相等”、“不相等”或“不能确定”;其理由是:24.如右图所示,当关闭阀门K时,向甲中充入mol A、mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L;在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3Ag+2Bg Cg+2Dg;ΔH<0达到平衡Ⅰ时,V乙= L请回答:1乙中B的转化率为;2甲中D和乙中C的物质的量比较:填“相等”、“前者大”、“后者大”;3打开K,过一段时间重新达平衡Ⅱ时,乙的体积为用含V的代数式表示,连通管中气体体积忽略不计;25.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 g + 3 H2g2NH3g1若反应在某时刻t时,n t N2 = 13mol,n t NH3 = 6mol,计算a的值2反应达平衡时,混合气体的体积为标况下,其中NH3的含量体积分数为25%;计算平衡时NH3的物质的量; 3原混合气体与平衡混合气体的总物质的量之比,n始∶n平= ;最简整数比4原混合气体中,a∶b = ;5达到平衡时,N2和H2的转化率之比,αN2∶α H2= ;参考答案一、二、选择题题号 1 2 3 4 5 6 7 8答案 C A C B B D C C题号9 10 11 12 13 14 15 16 17 18答案 B D AD AD BC AD AC AC D AB19. 0.1 molL-1min-1 A +2 B 3 C20. C , B , 127 , A , -73 , D21. 1[][][]NHN H32223,2AC ,3>,422. αA =50 %23、1正反应提示:设达平衡时E的消耗量为2a mol D +2E 2F起始时: x平衡时:-a x-2a +2a因左侧反应混和物总的物质的量为12 mol,所以达平衡时,右侧反应需满足:-a+x-2a++2a=12x-2a>0x=+ax>2a2不相等, 因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同;24.1 20% 2 后者大 3 V L25.⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol;则x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16解法二:N2 + 3H22NH3开始时a b0t时13 6在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16⑵n平NH3 = /×25% = 32mol×25% = 8mol⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2。
第二章化学反应速率与化学平衡第二节化学平衡练习题一、单选题(共16题)1.可逆反应223N +3H 2NH 的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到最大限度(即化学平衡)的是A .N 2将完全转化为NH 3B .N 2、H 2和NH 3的物质的量浓度相等C .N 2、H 2和NH 3的物质的量浓度不再变化D .正反应和逆反应的速率都为零2.一定温度下,在恒容密闭容器中发生反应:2NO 2(g)+O 3(g)N 2O 5(g)+O 2(g)。
当NO 2、O 3、N 2O 5、O 2的浓度不再变化时,下列说法正确的是A .该反应已达到化学平衡状态B .正、逆反应速率相等且等于零C .NO 2和O 3全部转化为N 2O 5和O 2D .NO 2、O 3、N 2O 5、O 2的浓度一定相等3.化学反应()()()223O g 2SO g 2SO g +在硫酸工业中有重要应用。
关于该反应的叙述正确的是A .无限延长化学反应的时间能改变化学反应的限度B .2O 、2SO 、3SO 的物质的量比1:2:2时达到平衡状态C .该反应达到化学平衡状态时,正反应速率和逆反应速率相等且等于零D .若开始加入2SO 和182O ,达到化学平衡时核素18O 存在于三种物质中4.t ℃ 时,反应 N 2+3H 2 催化剂高温高压2NH 3在容积固定的密闭容器中进行,达到平衡状态的标志是A .v(NH 3)= 2v(N 2)B .H 2的物质的量浓度不再发生变化C .单位时间内消耗2 mol NH 3的同时生成1mol N 2D .1molN 2和3molH 2完全转化为2molNH 35.一定温度下,在2L 恒容密闭容器中放入0.2mol NO 和0.2mol CO ,在催化剂存在条件下发生反应:2NO(g)+2CO(g)2CO 2(g)+N 2(g)。
测得NO 的物质的量变化如表:下列说法正确的是A.15min时,反应恰好达到平衡状态B.0~5min,NO的平均速率为0.016mol•L-1•min-1C.其他条件不变,升高反应温度,平衡时NO的物质的量小于0.06molD.20min时压缩容器的容积,正逆反应速率均加快,正反应速率加快幅度更大6.在一定条件下,在容积不变的密闭容器中,1molN2和3molH2发生反应N2(g)+3H2(g)2NH3(g)。
一、化学平衡常数的含义1.关于化学平衡常数的叙述正确的是( )A .温度一定,一个化学反应的平衡常数不是一个常数B .两种物质反应,不管怎样书写化学方程式,平衡常数不变C .温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数D .浓度商Q c <K 时,v 正<v 逆2.化学平衡常数可以用K 来表示,下列关于化学平衡常数的说法中正确的是( ) A .K 越大,反应物的转化率越小 B .K 与反应物的浓度有关 C .K 与生成物的浓度有关 D .K 与温度有关 3.某温度下,可逆反应m A(g)+n B(g)p C(g)的平衡常数为K ,下列对K 的说法正确的是( )A .K 值越大,表明该反应越有利于C 的生成,反应物的转化率越大B .若缩小反应器的容积,能使平衡正向移动,则K 增大C .温度越高,K 一定越大D .如果m +n =p ,则K =1 4.当把晶体N2O 4放入密闭容器中气化,并建立了N 2O 4(g)2NO 2(g)平衡后,保持温度不变,再通入若干N 2O 4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其c 2(NO 2)c (N 2O 4)值( )A .变大B .不变C .变小D .无法确定二、化学平衡常数的计算5.将4 mol SO 2与2 mol O 2放入4 L 的密闭容器中,在一定条件下反应达到平衡:2SO 2+O 22SO 3,测得平衡时SO 3的浓度为0.5 mol·L -1。
则此条件下的平衡常数K 为( )A .4B .0.25C .0.4D .0.26.在一定温度下,反应12H 2(g)+12X 2(g) HX(g)的平衡常数为10。
若将1.0 mol 的HX(g)通入体积为1.0 L 的密闭容器中,在该温度时HX(g)的最大分解率接近于( )A .5%B .17%C .25%D .33%三、化学平衡常数的综合应用7.在淀粉-KI 溶液中存在下列平衡:I2(aq)+I -(aq)I -3(aq)。
一、选择题1.在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是A.是熵减反应B.是熵增效应大于能量效应C.是吸热反应D.是放热反应答案:B【详解】-<反应才能自发进行, 2N2O5(g)=4NO2(g)+O2(g) Δ0Δ0H T SΔΔ0>>、,298K和H S101KPa时,能自发进行的原因是熵增效应大于能量效应,故选B。
2.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g) △H=a kJ/mol(a>0)。
然后在恒定温度下缩小容器体积,重新达到平衡。
下列分析正确的是A.重新达到平衡后,密闭容器中氨气的体积分数不变B.两次平衡时的CO2的浓度相等C.若2v(NH3)=v(CO2),则该反应达到平衡状态D.若开始时向容器中加入2 mol NH3和1 mol CO2,达到平衡时放出a kJ热量答案:A【详解】A.该反应只有生成物是气体,且反应产生NH3(g)、CO2(g)体积比始终是2:1,因此重新达到平衡后,密闭容器中氨气的体积分数不变,A正确;B.增大压强,化学平衡逆向移动,导致CO2浓度减小,因此两次平衡时的CO2的浓度不相等,B错误;C.未指明反应速率的正、逆,因此不能确定反应是否达到平衡状态,C错误;D.该反应是可逆反应,反应物不能完全转化为生成物,因此开始时向容器中加入2 mol NH3和1 mol CO2,不能完全转化为NH2COONH4(s),则达到平衡时放出热量小于a kJ,D 错误;故合理选项是A。
3.T1时,10 L的恒容密团容器中充入一定量的M(g)和N(g),发生反应:M(g)+N(g)⇌2P(g)+Q(g) △H>0.反应过程中的部分数据如表所示:A.该反应在第8min时,v(正)>v(逆)B.0-5min内,用M表示的平均反应速率为0.04 mol/(L·s)C.其他条件不变,温度变为T2时,平衡时测得N的浓度为0.08 mol/L,则T1>T2D.当该反应达到平衡状态时,M、N的转化率相等答案:B【详解】A.根据表格所给数据,反应在5min时已经达到平衡状态,第8min时也是平衡状态,所以正逆反应速率相等,A项不符合题意;B.(6-4)molv(M)==0.04mol/(L s)10L?5min,B项符合题意;C.T1→T2时,N的平衡浓度由1mol=0.1mol/L10L降低到0.08mol/L,说明N消耗的更多,则平衡正向移动,正反应为吸热反应,则T2>T1,C项不符合题意;D.6-41α(M)==63,3-12α(N)==33,两者转化率不相同,D项不符合题意;故正确选项为B4.在一定温度不同压强(P1<P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是A.B.C.D.答案:B解析:一定温度下,增大压强,反应速率增大,到达平衡的时间缩短,该反应正反应是体积增大的反应,平衡向逆反应移动,平衡时Z的物质的量减小,据此结合选项解答。
人教版高二上学期化学(必修一)《2.2化学平衡》练习题(含解析) 学校:___________班级:___________姓名:___________考号:___________一、选择题1.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,则下列说法正确的是A .该反应是吸热反应B .反应体系中加入催化剂对反应热有影响C .当反应达到平衡后,升高温度,A 的转化率增大D .改变压强与加催化剂,都不会使平衡发生移动2.下列有关平衡常数的说法中,正确的是A .改变条件,反应物的转化率增大,平衡常数一定增大B .反应:2NO 2(g)⇌N 2O 4(g) ΔH<0,升高温度该反应的平衡常数增大C .对于给定的可逆反应,温度一定时,其正、逆反应的平衡常数相等D .平衡常数为K=22c(CO )c(NO)c(CO)c(NO )的反应,化学方程式为CO(g)+NO 2(g)⇌CO 2(g)+NO(g) 3.可逆反应达到化学平衡的标志是A .正逆反应的速率均为零B .正逆反应的速率相等C .反应混合物中各组分的浓度相等D .正逆反应都还在继续进行4.下列事实中,能用勒夏特列原理解释的是A .工业合成NH 3反应,为提高NH 3的产率,采取较高的温度B .SO 2催化氧化制SO 3的过程中使用过量的氧气,以提高二氧化硫的转化率C .CO(g)+NO 2(g) CO 2(g)+NO(g)达平衡后,缩小容器体积可使颜色变深D .使用FeCl 3可以加快H 2O 2的分解5.在一个密闭容器中发生反应:()()()23225N O g O g N O g +,反应过程中某一时刻23N O 和2O 和25N O 的浓度分别为0.2mol/L 、0.1mol/L 和0.2mol/L ,当反应达到平衡时可能的数据是 A .()25N O 0.3mol /L c =B .()()2325N O N O 0.25mol /L c c ==C .()2O 0.3mo /L c =D .()23N O 0.3mol /L c =6.一定条件下,合成氨反应N 2(g) + 3H 2(g)2NH 3(g)中,NH 3浓度变化如图5所示;已知1 mol N 2与3 mol H 2的总能量比2 mol NH 3的能量大92 kJ 。
第二章 化学反应速率和化学平衡1) 根据实验,在一定范围内,下列反应符合质量作用定律。
2NO(g) + Br 2(g) → 2NOBr(g)① 写出该反应的反应速率表达式。
② 该反应的总级数是多少?③ 其它条件不变,如果将容器的体积增加到原来的2倍,反应速率将怎样变化? ④ 如果容器体积不变,而将NO 的浓度增加到原来的3倍,反应速率又将怎样变化?解: ① 22[][]NO Br v k c c =② 该反应的总级数是3③ 其它条件不变,如果将容器的体积增加到原来的2倍,则浓度降低为原来的1/2, 反应速率将为原来的1/8。
④ 如果容器体积不变,而将NO 的浓度增加到原来的3倍,反应速率将为原来的9倍。
2) 已知某一化学反应的活化能为53.59kJ •mol -1,计算温度自300K 升高到310K 时反应速率 的变化。
解:213a 211253.5910310300ln 0.6938.314310300T T v E T T v R T T ⎛⎫-⨯-⎛⎫=== ⎪ ⎪⨯⎝⎭⎝⎭ 212T T v v ∴= 温度自300K 升高到310K时反应速率增加到原来的两倍。
3) 反应2NOCl(g) → 2NO(g) + Cl 2(g) 的活化能为101kJ •mol -1,已知300K 时的速率常数k为2.80×10-5mol -1• L •s -1。
求400K 时的k 。
解:213a 211210110400300ln 10.1238.314400300T T k E T T k R T T ⎛⎫-⨯-⎛⎫=== ⎪ ⎪⨯⎝⎭⎝⎭2144-1-152.49210 2.49210 2.80100.69m l L s 8o T T k k -∴=⨯⨯=⨯⨯⨯=4) 已知下列反应: Fe(s) + CO 2(g) FeO(s) + CO(g) O 1KFe(s) + H 2O(g)FeO(s) + H 2(g) O2K在不同温度时反应的标准平衡常数值如下:T/K O 1KO2K973 1.47 2.38 1073 1.81 2.00 1173 2.15 1.67 12732.481.49试计算在上述各温度时反应 CO 2(g) + H 2(g) CO(g) + H 2O(g) 的标准平衡常数OK。
第二章 化学平衡习题一.选择题 1. 下列反应Kc 的单位是( ) 2.2X(g)+2Y(g)=3Z(g)A L·mol -1B mol·L -1C L 2·mol 2D mol 2·mol -23.下列哪一个反应的Kc 和Kp 的数值相等( ) A. 3H 2(g)+N 2(g)=2NH 3(g) B. H 2(g)+I 2(g)=2HI(g) C. CaCO 3(s)=CaO(s)+CO 2(g) D. 2F 2(g)+2H 2O(l)=2HF(g)+O 2(g) 4.一定条件下,合成氨反应呈平衡状态, 3H 2+N 2=2NH 3-------K 1 32 H 2+12 N 2=NH 3--------K 2 则K 1与K 2的关系为( ) A. K 1=K 2 B. K 22=K 1 C. K 12 = K 2 D. 无法确定 5.已知: 2SO 2+O 2=2SO 3反应达平衡后,加入V 2O 5催化剂,则SO 2的转化率( ) A. 增大 B. 不变 C. 减小 D. 无法确定6. 正反应能自发进行和反应达平衡的条件分别为( ) A. Qp>Kp ,△G<0 B. Qp>Kp ,△G>0 C. Qp<Kp ,△G<0 D. Qp<Kp ,△G>0 E. Qp=Kp ,△G=07. 醋酸铵在水中存在着如下平衡:NH 3+H 2O NH 4+ + OH - -------K 1 HAc+H 2O Ac - + H 3O + -------K 2 NH 4+ + Ac - HAc + NH 3 -------K 3 2H 2OH 3O + + OH - --------K 4以上四个反应平衡常数之间的关系是( ) A. K 3=K 1K 2K 4 B. K 4=K 1K 2K 38.可逆反应,C(s)+H 2OCO(g)+H 2(g) △H>0,下列说法正确的是( )A. 达到平衡时,反应物的浓度和生成物的浓度相等B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化C. 由于反应前后分子数相等,所以增加压力对平衡没有影响D . 加入正催化剂可以加快反应达到平衡的速度E. 升高温度使V 正增大,V 逆减小,结果平衡向右移动 9.合成氨反应: N 2(g)+3H 2(g)2NH 3(g)的平衡常数3N NH p2H23p p p K =:当体系总压力增大一倍时,同温下重新建立平衡,此时:3H N 2NH p 223'p 'p 'p 'K =, K p 与K p ’ 的关系为( )A. K p =1/4K p ’B. K p =4K p ’C. K p =K p ’D. K p 与K p ’没有如上关系10. 下列因素对转化率无影响的是( )A. 温度B. 浓度C. 压力(对气相反应)D. 催化剂11. 反应物的浓度相同,反应温度相同,反应:(1) mA + nBpC (2) X+2YZ对A 和X 而言,转化率大的是( )A. X>AB. A>XC. X=AD. 无法确定 12. 反应: A(g)+B(s)C(g),在400K 时,平衡常数Kp=.当平衡时,体系总压力为100kPa 时,A 的转化率是( )A. 50%B. 33%C. 66%D. 15%13. 已知反应N 2O 4(g)→2NO 2(g)在873K 时,K 1=×104,转化率为a%,改变条件,并在1273K 时,K 2=×104,转化率为b%(b>a),则下列叙述正确的是( )A. 由于1273K 时的转化率大于873K 时的,所以此反应为吸热反应B. 由于K 随温度升高而增大,所以此反应的△H>0C. 由于K 随温度升高而增大,所以此反应的△H<0D. 由于温度不同,反应机理不同,因而转化率不同 14. 在276K时反应: CO(g)+H 2O(g)CO 2(g)+H 2(g)的Kc=,当CO(g)与H 2O(g)的浓度(mol·L -1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO 的转化率( )15.对于反应: C(S)+H2O(g) = CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是( )A. 升高反应温度B. 降低反应温度C. 增大体系的总压力D. 增大H2O(g)的分压E. 多加入C(S)16.反应: 2SO2(g)+O2(g) 2SO3(g),△H<0,根据勒夏特列原理,和生产的实际要求,在硫酸生产中,下列哪一个条件是不适宜的( )A. 选用V2O5作催化剂B. 空气过量些C. 适当的压力和温度D. 低压,低温17.下列反应处于平衡状态,2SO2(g)+O2(g) 2SO3(g) △H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( )A. 降低温度B. 增大压力C. 加入氧气D. 去掉三氧化硫17.下列叙述正确的是( )A. 在化学平衡体系中加入惰性气体,平衡不发生移动B. 在化学平衡体系中加入惰性气体,平衡发生移动C. 恒压下,在反应之后气体分子数相同的体系中加入惰性气体,化学平衡不发生移动D. 在封闭体系中加入惰性气体,平衡向气体分子数减小的方向移E. 在封闭体系中加入惰性气体,平衡向气体分子数增多的方向移动18.下列关于催化剂作用的叙述中错误的为( )i.可以加速某些反应的进行B. 可以抑制某些反应的进行C. 可以使正逆反应速度以相等的速度加快D. 可以改变反应进行的方向19.勒沙特列原理( )A. 只适用于气体间的反应B. 适用所有化学反应C,只限于平衡时的化学反应 D. 适用于平衡状态下的所有体系a)一定温度下反应: PCl5(g) PCl3(g)+Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( )A. 体积增大一倍B. 保持体积不变,加入氮气使总压力增大一倍C. 保持总压不变,加入氮气使总体积增大一倍D. 增大PCl5的分压E. 降低PCl5的分压20.已知下列反应的平衡常数,H2(g)+S(s) H2S(g) (1) K1S(s)+O2(g) SO2(g) (2) K2则反应: H2(g)+SO2(g) O2(g)+H2S(g) 和反应: SO2S(s)+O2(g)的平衡常数分别为( )A. 1/K1B. 1/K2C. K1-K2D. K2/K1E. K1/K2二.填空题1.已知:(1) H2O(g)=H2(g)+12 O2(g),Kp=×10-11(2) CO2(g)=CO(g)+ 12 2O2(g),Kp=×10-11则反应: CO2(g)+H2(g)=CO(g)+H2O(g)的Kp为_________,Kc为__________2.298K时,HBr(aq)离解反应的△Gø=-58kJ·mol-1,其Ka应为__________由Ka的数值说明_______3.1073K时,反应: CO(g)+H2O(g) CO2(g)+H2(g)的Kc=1,在最初含有(g)和(g)的混合物经反应达到平衡时,CO的物质的量为___mol,其转化率为________________4.已知反应: A(g)+B(g) C(g)+D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________5.下列反应处于平衡状态,X(g)+Y(g) 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将___________,化学平衡将___________.6.反应: (a) C+H2O CO+H2 (b) 3H2+N22NH3,在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________三.问答题1.乙酸和甲醇可按下式反应:CH3COOH+CH3OH CH3COOCH3+H2O298K时K C=4,经过计算,(1)反应物均为1mol,(2)甲醇为1mol,乙酸为3mol时甲醇的转化率?对结果作出解释.2.对反应: mA+nB pC,△H<0 ,升高温度,对反应速度和化学平衡有何影响. 为什么?3.催化剂能影响反应速度,但不能影响化学平衡,为什么?4.简述在合成氨生产中: N2(g)+3H2(g)2NH3(g). △Hø=·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高?四.计算题1.在某温度下密闭容器中发生如下反应: 2A(g)+B(g) 2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少?2.已知某反应在25℃时,K p=×1017,求此反应的△Gø.3.把3体积H2和1体积N2混合加热,在10Pø条件下,达到平衡,其中NH3含%(体积百分数).计算:当压力为50Pø时NH3占的体积百分数.(Pø= kPa)4.反应: CO+H2O CO2+H2(均为气体)达到平衡时,Pco=40kPa ,P CO2=40kPa,P H2= 12kPa,P H2O =20kPa,在恒温恒容下通入CO气体,P H2=17 kPa,试计算新平衡下各气体的分压.5.设H2,N2和NH3在达平衡时总压力为500kPa,N2的分压为100kPa,此时H2的物质的量的分数为,试计算下列几种情况的Kp值.1. N2(g)+3H2(g) 2NH3(g) K p12. NH3(g) N2(g)+3H2(g) K p26.已知反应: PCl5(g) PCl3(g)+Cl2(g)523K时在2L容器中的有分解了,计算:(1) 该温度下反应的K c和K p(2) 若在上述密闭容器中又加入, PCl5的分解百分率是多少.第二章化学平衡习题答案一.选择题1. A2. B3. B4. B5. C E6. B7. B D8. C9. D 10. D 11. B 12. B13. C 14. A D 15. D 16. A17. C D 18. D 19. D 20. A C二.填空题1.×10-1×10-12.×1010HBr(aq)离解的很完全3.50%4.67%5.加快向左移动6.无影响使平衡右移三.问答题1.答:(1) CH3COOH + CH3OH CH3COOCH3 + H2O始: 1 1 0 0平: 1-X 1-X X XX2(1-X)2= K C = 4 X=α1=错误!×100%=67%(2) y2/(1-y)(3-y)=K c=4,y= α2=90%α2>α1,是由乙酸的浓度增大,使平衡右移导致甲醇的转化率升高2.答: 升高温度,可以加快正逆反应的反应速度,平衡将逆向移动.因升高温度使速度常数增大,反应速度则加快.(或从活化分子百分数增大,有效碰撞增多,微观角度说明).依据勒夏特列原理,升高温度,平衡向吸热方向移动.给出反应,逆向吸热,正向放热,所以平衡将逆向移动.3.答: 因为催化剂能起到改变反应历程,从而改变反应活化能的作用,所以能影响反应速度,但由于催化剂同时改变正,逆反应的活化能,同等速度的影响正,逆反应速度,而改变反应的始态和终态,所以不影响化学平衡.4.答: 对于此反应,低温有利于提高反应物的转化率,但低温反应速度慢,使设备利用率低,单位时间合成氨量少,为使其有较高的转化率,和较快的反应速度,单位时间内合成较多的氨,常以催化剂的活性温度为该反应的控制温度.高压对合成氨有利,但压力过高对设备要求高,运转费高,因此,压力不宜过高,为了得到更多的氨,常用加压,冷却合成气的方法,以分离氨,使平衡右移. 四.计算题 1.解:2A(g) + B(g)2C(g)始: 2×105 1×105 0平: (2×105-X) (1×105-1/2X) X 有 (2×105-X)+(1×105-1/2X)+X=×105 X=×105(Pa)=错误!×100%=80% K=P C 2P A 2P B=错误!=8×10-4 2.解:∵ △G ø= ∴ △G ø=××(273+25)××1017=100813(J·mol -1) =×102(kJ·mol -1)3.解:平衡时,P(NH 3)=10×%=ø P(N 2)=错误!=ø P(H 2) =3P(N 2) = øK p =P(NH 3)/P(H 2)P(N 2) = 错误! = ×10-4 设50P ø时,NH 3占X P=50XP ø P(N 2) =504(1-X)= =错误! = ×10-4X= NH 3占15%. 4.解:K P =OH CO CO H 222p p p p =40×1240×20= 恒容下通入CO 使P(H 2)增大 17-12=5(kPa)P’(CO 2)= 40+5 = 45(kPa) P’(H 2O) = 20-5=15(kPa)K P =OH CO CO H 222p p p pP ’CO =pO H CO H K p p p 222 =17×45×15=85(kPa) 5. 解:N 2的物质的量的分数为100500=,则NH 3的为则P =500×=200kPa , P(H 2)=500×=200kPa(1) K p1=P(NH 3)/[P(H 2)P(N 2) =200200×100 =5×10-5(2) K p2=1K=×1026.解:(1) PCl 5PCl 3 + Cl 2平衡: 错误! 2 2 (mol/L) 即: K c =[PCl 3][Cl 2][PCl 5]= 错误! =K p = K c (RT)2 -11= ×523)1 =(2) 设有X mol 转化为PCl 5 PCl 5PCl 3 + Cl 2平衡: 错误! 错误! 错误! 错误!= 解,得: X = (mol)PCl 5的分解百分率为: 错误!×100% =65%。