邢其毅《基础有机化学》(第3版)(上册)课后习题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应(
- 格式:pdf
- 大小:2.09 MB
- 文档页数:22


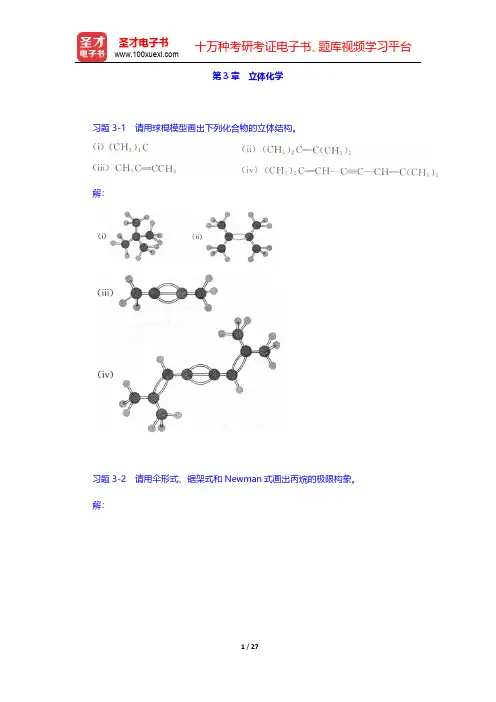
十万种考研考证电子书、题库视频学习平台圣才电子书第3章立体化学习题3-1请用球棍模型画出下列化合物的立体结构。
解:习题3-2请用伞形式、锯架式和Newman 式画出丙烷的极限构象。
解:习题3-3用锯架式画出下列分子的优势构象式:(i)异丁烷(ii)新戊烷(iii)3-甲基戊烷(iv)2,4-二甲基己烷解:习题3-4用Newman式画出下列分子的优势构象式:(i)2-氟乙醇(ii)2-羟基乙醛解:习题3-5用伞形式画出(2R,3S)-3-甲基-1,4-二氯-2-丁醇的优势构象式(只考虑C2-C3键的旋转)。
解:习题3-6画出以异丁烷分子中某根C-C键为轴旋转360°时各种构象的势能关系图。
解:由丁烷重叠型的能垒为14.6kJ·mol-1,可知,异丁烷的重叠型的能垒也为14.6kJ·mol-1。
故以某根C—C键为轴旋转360°时各构象的势能关系图如图3-1所示:图3-1习题3-7请分析:环丙烷内能升高是由哪几种因素造成的?解:(1)环丙烷中C—C—C的键角不能保持正常的109°,故环内存在角张力。
(2)环内六个氢原子都为重叠型,且氢原子间距小于两个原子的范德华半径之和,故存在斥力。
(3)轨道没有按轴向重叠,导致键长缩短,斥力增大。
以上因素都使环丙烷内能升高。
习题3-8写出下列化合物椅型构象的一对构象转换体,计算直键取代与平键取代的平衡常数K及百分含量(25℃)。
(i)乙基环己烷(ii)溴代环己烷(iii)环己醇解:查表知,乙基在环己烷中直键取代与平键取代构象的势能差为-7.5kJ·mol-1,故,查表知,溴在环己烷中直键取代与平键取代构象的势能差为-1.7kJ·mol-1,同理,可计算查表知,羟基在环己烷中直键取代与平键取代构象的势能差为-3.3kJ·mol-1,同理,习题3-9写出下列化合物椅型构象的一对构象转换体,并指出哪一个是优势构象,计算它们的势能差。

基础有机化学第三版答案邢其毅【篇一:基础有机化学第三版邢其毅4-基本慨念四、结构和表达】p class=txt>1乙烷构象的表示方法:乙烷的构象,可用下列几种透视图来表示:伞形式是眼睛垂直于c?c键轴方向看,实线表示键在纸面上,虚线表示键伸向纸面后方,锲形线表示键伸向纸面前方;锯架式是从c?c键轴斜45?方向看,每个碳原子上的其它三根键夹角均为120?。
纽曼式是从c?c键的轴线上看。
(参见书上82页)其它烷烃的表示方法可类推。
2伞形式:实线表示的键在纸面上,虚线表示的键在纸面后,楔形线表示的键在纸面前,这样绘出的立体投影式称为伞形式。
3构造:分子中原子的联结次序和键合性质叫做构造。
4构造式:表示分子构造的化学式叫做构造式。
表示构造式的方法有四种。
5结构简式:为了简化构造式的书写,常常将碳与氢之间的键线省略,或者将碳氢单键和碳碳单键的键线均省略,这两种表达方式统称为结构简式。
6蛛网式:将路易斯构造式中一对共价电子改成一条短线,就得到了蛛网式,因其形似蛛网而得名。
7键线式:还有一种表达方式是只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120?,一根单键和一根三键之间的夹角为180?,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其它杂原子及与杂原子相连的氢原子须保留。
用这种方式表示的结构式为键线式。
8路易斯构造式:用价电子(即共价结合的外层电子)表示的电子结构式称为路易斯构造式。
在路易斯构造式中,用黑点表示电子,两个原子之间的一对电子表示共价单键,两个原子之间的两对或叁对电子表示共价双键或共价叁键。
只属于一个原子的一对电子称为孤电子对。
【篇二:基础有机化学第三版邢其毅4-基本慨念七、理论】lass=txt>1马氏规则:卤化氢等极性试剂与不对称烯烃发生亲电加成反应时,酸中的氢原子加在含氢较多的双键碳原子上,卤素或其它原子及基团加在含氢较少的双键碳原子上。
这一规则称为马氏规则。




第2章有机化合物的分类表示方法命名一、选择题化合物2-氯-5,5-二甲基二环[2.2.1]-2-庚烯的结构式为()。
【答案】B二、填空题写出下列化合物最稳定的构象式。
(1)用Newman投影式表示为:;(2)反式十氢化萘用构象式表示为:;(3)(S)-2-丁醇用Fischer投影式表示为:。
【答案】三、简答题1.用溴处理(Z)-3-己烯,然后在乙醇中与KOH反应可得(Z)-3-溴-3-己烯。
但用同样试剂,相同顺序处理环己烯却不能得到1-溴环己烯。
用反应式表示这两种烯烃在反应中的行为(注意中间体和产物的立体结构)。
答:产物围绕C3~C4旋转的纽曼投影式为:这时,C3的Br与C4的H处于反式,在KOH/EtOH作用下发生消除反应,生成而其构象式为:由于反式双竖键是有利于消除反应的立体位置,因此式中Br只能与相邻亚甲基的竖键H发生消去反应而生成环己二烯。
2.用系统命名法命名下列化合物。
答:(1)N,N-二甲基-4-甲基苯甲酰胺(2)1-甲基-6-羟基异喹啉(3)4,4'-二硝基联苯(4)(S)-2-氯丙酸乙酯(5)6-甲基-3-溴二环[3.2.0]庚烷(6)4-甲氧基苯乙酮缩乙二醇(7)三环癸烷(8)4-甲基-4'-甲氧基二苯甲醇(9)2-巯基苯并噻唑(10)3-(2-呋哺基)-丙烯酸3.写出下列化合物最稳定的构象式。
(1)HOCH2CHF(2)苏式-2-(N,N-二甲氨基)-1,2-二苯乙醇答:4.我国盛产一种植物,称为薄荷草,其茎、叶中富含薄荷醇,它有局部止痛和消炎的功效,内服有安抚胃部及止吐解热的功效,所以是痱子粉、痱子水及某些糖果和清凉饮料等不可缺少的配料。
薄荷醇的化学名和结构式如下:试问:(1)以上结构式(键线式)只表示了薄荷醇分子中的构造关系(分子内原子的连接次序),并未表示构型关系(原子在空间的排列方式),它是饱和脂肪环醇,应该有多少构型异构,即请回答它理论上有多少个手性碳原子?应该有多少几何异构?有多少对映异构?请用三维空间式表示出来。

第14章羧酸衍生物酰基碳上的亲核取代反应一、选择题1.下列化合物发生水解反应,()活性最大。
[大连理工大学2004研]【答案】A【解析】酯羰基碳缺电子程度越高,则越易发生亲核取代反应,水解反应活性越大。
-NO2为吸电子基,使酯基的电子云密度减小,水解反应活性最大。
2.下列反应中,中间体a及反应产物b是()。
[武汉大学2000研]【答案】B【解析】羧酸酰氯化得到酰氯,酰氯用三叔丁基氢化铝锂在低温下还原得到醛。
3.RCOOR在含有的碱性溶液中水解,018存在于所得到的()。
[武汉大学2001研]A.醇中B.羧酸中C.两者都有D.两者没有【答案】B【解析】酯的水解是酰氧键断裂,水解后产生的羧基中的羟基来自于水。
4.如下反应步骤中,反应产物d 的结构式应为()。
[武汉大学2002研]【答案】C【解析】依合成路线逐步推导。
其中,a 为COCl ;b 为CHO ;c 为CHOH CN;故水解后得到d 为H CCOOH OH 。
5.酰氯与下列哪一种试剂反应生成酮()。
[武汉大学2004研]A.DIBAHB.LiAlH 4C.RMgBrD.(CH 3CH 2)2CuLi【答案】D【解析】酰氯与DIBAH(二异丁基氢化铝)、氢化铝锂反应生成一级醇;与格氏试剂反应一般得到叔醇;与二烃基铜锂反应则得到酮。
二、填空题1.下列化合物用氢氧化钠水溶液水解,请按反应速度由快到慢的顺序排列。
[厦门大学2002研]【答案】A>D>C>B【解析】羰基附近的碳上有吸电子基,空间位阻越小,越有利于酯的水解;酯基中与氧相连的烷基碳上的取代基越多,空间位阻越大,水解反应速度越慢。
2.将下列负离子按稳定性大小排列成序。
[华中科技大学2003研]【答案】C>A>B【解析】吸电子基使羧酸根离子上的负电荷分散,电子云密度降低,稳定性增大,相反,给电子基使其稳定性减小。
3.下列化合物与乙醇钠/乙醇溶液发生醇解反应,请按反应活性由高到低的顺序排列。
[厦门大学2004研]【答案】C>D>A>B【解析】羧酸衍生物中,羰基缺电子程度越大,醇解反应越快。
第13章羧酸习题13-1通过查阅资料,列举与人类生活密切相关的一元饱和脂肪酸、一元不饱和脂肪酸、芳香羧酸、二元羧酸、多元羧酸各一种,并简单阐明它们在人们日常生活中的用途。
解:一元饱和羧酸:乙酸,CH 3COOH,食用醋的主要成分,也可用作杀菌剂。
一元不饱和酸:亚油酸,CH 3(CH 2)4CH=CHCH 2CH=CH(CH 2)7COOH,用于制肥皂,在医药上用于治疗动脉硬化症。
芳香羧酸:苯甲酸,COOH ,苯甲酸和它的钠盐是重要的防腐剂。
二元羧酸:草酸,HOOC—COOH,可除去衣物上的墨迹和铁锈。
多元羧酸:柠檬酸,HOOCCH 2CH2CH 2COOH COOHOH ,广泛用于食品工业,如饮料、食品等。
习题13-2将下列化合物按沸点由大至小排列。
讨论相对分子质量、结构和沸点的关系。
解:沸点高低:对于结构相似的化合物,相对分子质量越大,沸点越高;对于同分异构体,叉链化合物的沸点低于直链化合物的沸点;分子中含羟基越多,分子间形成的氢键越多,沸点越高;由于羧酸可形成二缔合体,一元羧酸的沸点高于碳原子数相同的一元醇的沸点。
习题13-3将下列各组化合物,按酸性从强到弱的顺序编号:解:习题13-4将下列各组化合物,按碱性从强到弱的顺序编号:解:负电荷处在电负性大的原子上较稳定,碱性相对较弱。
轨道的杂化状态影响原子的电负性,例如呈不同杂化状态的碳原子电负性大小的顺序为:Csp>Csp2>Csp3。
习题13-5请解释邻、间、对A基苯甲酸的酸性大小顺序(参见表13-4)。
解:邻位取代苯甲酸由于有邻位效应,其酸性一般比间位和对位取代苯甲酸的酸性强,也比苯甲酸的酸性强。
由于氯的吸电子诱导效应大于给电子共轭效应,所以上述三个化合物的酸性均比苯甲酸强。
由于氯原子在邻位时吸电子诱导效应最强,在对位时最弱,所以邻氯苯甲酸酸性最强,对氯苯甲酸酸性最弱。
甲氧基对间位羧基只有吸电子的诱导效应,而对对位羧基主要显示给电子的共轭效应,因此对氯苯甲酸的酸性比间氯苯甲酸的酸性弱。
第13章羧酸13.1 复习笔记一、羧酸的分类根据与羧基相连的烃基的结构不同,羧酸可以分为脂肪酸和芳香酸,而脂肪酸又可分为饱和脂肪酸和不饱和脂肪酸。
根据分子中所含羧基的数目不同,羧酸还可以分为一元酸、二元酸或多元酸。
二、羧酸的物理性质低级脂肪酸是液体,可溶于水,具有刺鼻的气味;中级脂肪酸也是液体,部分地溶于水,具有难闻的气味;高级脂肪酸是蜡状固体,无味,不溶于水。
芳香酸是结晶固体,在水中溶解度不大。
羧酸的沸点比相对分子质量相当的烷烃、卤代烷的沸点要高,甚至比相近相对分子质量的醇的沸点还高,这是因为羧羰基氧的电负性较强,使电子偏向氧,可以与质子形成氢键,两羧酸分子形成二缔合体。
所有二元酸都是结晶化合物,低级的溶于水,随相对分子质量增加,在水中的溶解度减小。
在脂肪二元酸系列中,单数碳原子的二元酸比少一个碳的双数碳原子的二元酸溶解度大、熔点低。
三、羧酸及羧酸盐的结构羧酸中,羧基碳呈sp2杂化,羧基中的两个C-O键不一样。
在羧酸根负离子中,两个氧原子和一个碳原子各提供一个p轨道,形成一个具有4电子三中心的离域π分子轨道,其两个C-O键没有差别。
四、羧酸的化学性质1.酸性多数的羧酸是弱酸。
各种电子效应都将对羧酸的酸性产生影响。
取代基的诱导效应随着距离的增加而迅速下降,在α碳上很明显,β碳上作用就在下降。
二元酸中有两个可解离的氢,因此二元酸有两个解离常数K l及K2,K l比K2大得多,这是由于羧基有强的吸电子效应,能对另一个羧基的解离产生影响,两个羧基越近,影响越大。
第一个羧基解离后,成为羧酸根负离子,有给电子诱导效应,使第二个羧基解离比较困难,因此丙二酸以上的二元酸的p K a2均较乙酸的p K a大。
可以看出,诱导效应相隔一个碳原子后,彼此影响减弱很多。
草酸的p K a2为4.27,比乙酸的p K a小,这是个例外。
草酸盐具有一个平面的八电子的π体系,使草酸根稳定性特别突出。
芳环上的取代基对芳环上的羧基的酸性影响既有诱导效应,又有共轭效应。
第5章紫外光谱红外光谱核磁共振和质谱5.1复习笔记一、紫外光谱(UV)1.紫外光谱的产生紫外光的波长范围是100~400nm,它分为两个区段。
波长在100~200nm称为远紫外区,这种波长能够被空气中的氮、氧、二氧化碳和水所吸收,因此只能在真空中应用,这个区域称为真空紫外区。
目前真空紫外区在有机化学中用途不大。
波长在200~400nm 称为近紫外区,一般的紫外光谱是指这个区域的吸收光谱。
波长在400~800nm范围的称为可见光谱。
常用的分光光度计一般包括紫外及可见两部分,波长在200~800nm(或200~1000nm)。
分子内部的运动有转动、振动和电子运动,相应地,分子具有转动能级、振动能级和电子能级。
电子能级的跃迁所需能量最大,大致在1~20eV(电子伏特)之间。
根据量子理论,相邻能级间的能量差ΔE、电磁辐射的频率ν、波长λ符合下面的关系式ΔE=hν=h×c/λ式中h是普朗克常量,为6.624×10-34J·s=4.136×10-15eV·s;c是光速,为2.998×1010cm·s-1。
2.电子的跃迁有机化合物分子中主要有三种电子:σ电子、π电子和未成键的孤对电子(也称n电子)。
基态时,σ电子、π电子分别处在σ成键轨道和π成键轨道上,n电子处于非键轨道上。
仅从能量的角度看,处于低能态的电子吸收合适的能量后,都可以跃迁到任一个较高能级的反键轨道上。
跃迁时吸收能量的大小顺序为n→π*<π→π*<n→σ*<π→σ*<σ→π*<σ→σ*对于一个非共轭体系来讲,所有这些可能的跃迁中,只有n→π*。
跃迁的能量足够小,相应的吸收光波长落在近紫外-可见光区。
其他的跃迁能量都太大,它们的吸收光波长均在200nm以下,无法观察到紫外光谱。
3.紫外光谱图紫外光谱图是以波长(单位nm)为横坐标,以化合物对电磁辐射的吸收强度或透过率为纵坐标的吸收曲线图。