大学有机方程式总结(完美)
- 格式:doc
- 大小:207.50 KB
- 文档页数:8

有机反应方程式总结(一)烷烃1.甲烷与氯气在光照条件下反应生成氯仿:2.烷烃燃烧通式:(二)烯烃1.乙烯的制取:2.乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应:3.乙烯与溴的四氯化碳溶液反应:4.乙烯的催化加氢:5.乙烯的加聚反应:6. 1,3-丁二烯与溴(1:1)的反应:1,4加成:1,2加成:7.丙烯加聚:8. 2-甲基-1,3-丁二烯加聚:9.丙烯与氯气加热条件下反应(α-H的取代):(三)炔烃1.乙炔的制取:2.乙炔与足量溴的四氯化碳溶液反应:3.乙炔制聚氯乙烯:(四)芳香烃1.甲苯与酸性KMnO4溶液反应:2.苯的催化加氢:3.苯与液溴催化反应:4.苯的硝化反应:5.苯的磺化反应:6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:(五)、卤代烃1.溴乙烷在氢氧化钠水溶液中加热反应:2.溴乙烷在氢氧化钠醇溶液中加热反应:3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴乙烷制备丙酸:(六)、醇类1.乙醇与钠反应:2.乙醇的催化氧化:3.乙醇制乙烯:4.乙醇制乙醚:5.乙醇和浓的氢溴酸加热反应制溴乙烷:(七)、酚类1.苯酚与氢氧化钠溶液反应:2.苯酚钠与CO2反应:3.苯酚与溴水反应:4.制备酚醛树脂:(八)、醛类1.乙醛的催化加氢:2.乙醛的催化氧化:3.乙醛与银氨溶液反应:4.乙醛与新制氢氧化铜反应:5.乙醛与HCN溶液反应:(九)、羧酸1.乙酸与乙醇发生酯化反应:2.乙酸与氨气加热条件下发生反应:3.乙酸发生还原反应生成乙醇:4.乙酸与氯气催化剂条件下反应(α-H被取代):5.两分子乳酸脱去两分子水:(十)、酯类1.乙酸乙酯与H2O混合加入稀硫酸水解:2.乙酸乙酯碱性水解:3.油脂的皂化反应(以硬脂酸甘油酯为例) :(十一)、高分子化合物1.苯乙烯合成聚苯乙烯:2.异戊二烯合成聚异戊二烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.己二酸与己二胺脱水缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分子乳酸成环。

完美基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%)⒉硝化,磺化,氧化(略) 烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则 ⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3 CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−OH 2CH 3CH(OH)CH 3⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH 顺式加成,反马氏取向生成1︒醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等 ⒏高锰酸钾氧化:酸性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH 碱性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑ ⒐臭氧化: R ORRC=CHR’−→−3OC CHR’→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定−−−→−O璈O H 222RCOR+R’COOH−−→−O H -Zn 2RCOR+R’CHO−−→−4LiAlH RRCHOH+R’CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C300-Ag/200CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl ~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应:氯代:CH 2=CHCH 3−−−−→−︒C 600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl(CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
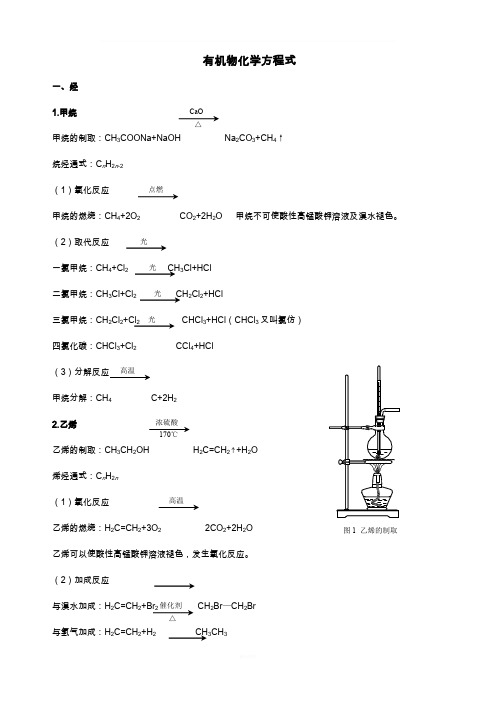
有机物化学方程式一、烃 1.甲烷甲烷的制取:CH 3COONa+NaOH Na 2CO 3+CH 4↑ 烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl (3)分解反应 甲烷分解:CH 4 C+2H 2 2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3CaO △点燃光光光 光 高温浓硫酸 170℃ 高温催化剂 △图1 乙烯的制取与氯化氢加成:H 2C=CH 2+HClCH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH 2 n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2注意:制取乙烯、乙炔均用排水法收集;乙烯、乙炔的加成反应一般都需要催化剂(溴除外)。
炔烃的通式:C n H 2n-2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH n 乙炔加聚,得到聚乙炔:n HC ≡CH n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应2-CH 2点燃图2 乙炔的制取催化剂 △Br 2—CHCl CH=CH点燃苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。

光照 光照 光照 光照 Δ 有机反应方程式总结1、甲烷的燃烧反应:CH 4+2O 2 CO 2+2H 2O2、甲烷与氯气的取代反应:CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+ HCl CH 2Cl 2+Cl 2 CHCl 3+ HCl CHCl 3+Cl 2 CCl 4+ HCl3、乙烯的燃烧反应:CH 2=CH 2+3O 2 2CO 2+2H 2O4、乙烯的加成反应:CH 2=CH 2+Br 2CH 2=CH 2+H 2 CH 3—CH 3 CH 2=CH 2+HClCH 2=CH 2+Cl 2CH 2=CH 2+H —OH CH 3—CH 2—OH 5、乙烯的加聚反应:nCH 2=CH 2 [ CH 2—CH 2 ]n 5、 苯的燃烧反应:2 +15O 2 12CO 2+6H 2O 6、苯的取代反应: +Br 2 +HBr +HO —NO 2 +H 2O 8、苯的加成反应: +3H 29、乙醇的置换反应:2CH 3—CH 2—OH+2Na 2CH 3CH 2ONa+H 2↑ 10、乙醇的燃烧反应:2CH 3—CH 2—OH+3O 2 2CO 2+3H 2O 11、乙醇的催化氧化:2CH 3—CH 2—OH+O 2 2CH 3—C —H+2H 2O12、乙醇的酯化反应:CH 3—C —OH+CH 3—CH 2—OH CH 3—C —OCH 2CH 3+H 2O13、验证乙酸的酸性:CH 3—C —OH+CaCO 3 CO 2↑+H 2O+(CH 3—C —OH)2Ca14、乙酸的中和反应:CH 3—C —OH+NaOH CH 3—C —ONa+H 2O15、乙烷的取代反应:CH 3—CH 3+Cl 2 +H 2 点燃 点燃 点燃 CH 2—CH 2 Br Br Ni Δ 催化剂 CH 2—CH 2 Cl CH 2—CH 2 Cl Cl 催化剂 加热、加压 催化剂 — — 点燃 FeBr 3 —Br Δ 浓H 2SO 4 —NO 2 Δ Ni 点燃 Δ Cu 或Ag ==O ==O Δ 浓H 2SO 4 ==O ==O ==O ==OCH 2—CH 2 Cl Cl。

大学有机化学方程式汇总
有机化学是研究碳化合物及其衍生物的化学性质和反应机理的学科。
在大学有机化学课程中,学生需要掌握各种有机反应的方程式。
本文档汇总了一些常见的有机化学反应方程式,供大家参考和研究。
烷烃的燃烧反应
烷烃是一类只含有碳和氢的有机化合物。
它们在氧气存在下可以发生燃烧反应,生成二氧化碳和水。
例如,甲烷的燃烧反应方程式如下:
CH4 + 2O2 -> CO2 + 2H2O
烷烃的卤代反应
烷烃可以与卤素(如氯、溴、碘)发生卤代反应,生成相应的烷基卤化物。
例如,甲烷与氯气发生卤代反应的方程式如下:
CH4 + Cl2 -> CH3Cl + HCl
醇的脱水反应
醇是含有羟基(OH)的有机化合物。
它们可以通过脱水反应,去除一个或多个水分子,生成烯烃或烷烃。
例如,环戊醇的脱水反应方程式如下:
C5H11OH -> C5H10 + H2O
烯烃的加成反应
烯烃是含有碳碳双键的有机化合物。
它们可以发生加成反应,
通过加入其他物质,形成新的化学键。
例如,乙烯与氢气发生加成反应生成乙烷的方程式如下:
C2H4 + H2 -> C2H6
酮的氧化反应
酮是含有羰基(C=O)的有机化合物。
它们可以发生氧化反应,其中羰基上的氧原子被还原,生成醇。
例如,乙酮的氧化反应方程式如下:
CH3COCH3 + [O] -> CH3COCH2OH
以上是一些大学有机化学中常见的反应方程式。
希望本文档对
您的学习有所帮助。
大学有机化学方程式总结
1. 碳氢化合物的烷烃类反应
1.1 卤代烃和氢化钠的反应
碳氢化合物(卤代烃)与氢化钠反应生成相应的烷烃,并释放出相应的卤化钠。
反应方程式如下:
R-X + NaH -> R-H + NaX
1.2 卤代烃和氢化亚铜的反应
碳氢化合物(卤代烃)与氢化亚铜反应生成相应的烷烃,并释放出相应的卤化铜。
反应方程式如下:
R-X + 2Cu2O + 2Cu -> R-H + 3Cu2X2
2. 醇类的酯化反应
2.1 醇与羧酸的酯化反应
醇与羧酸反应生成相应的酯,并释放出相应的水。
反应方程式如下:
R-OH + R'-COOH -> R'-COOR + H2O
2.2 醇与酸酐的酯化反应
醇与酸酐反应生成相应的酯,并释放出相应的酸。
反应方程式如下:
R-OH + R'-COO-CO-R'' -> R'-COOR + R''-COOH
3. 烯烃的加成反应
3.1 烯烃与卤素的加成反应
烯烃与卤素反应生成相应的二卤代烃。
反应方程式如下:
R-CH=CH2 + X2 -> R-CH2-CHX-CH2-X
3.2 烯烃与负氧化剂的加成反应
烯烃与负氧化剂反应生成相应的环氧化合物。
反应方程式如下:
R-CH=CH2 + [O] -> R-CH2-CH2-O-CH2-CH2-R
以上是一些大学有机化学方程式的总结,希望对您有帮助。
参考文献:
1. 有机化学方程式实验室手册,XX大学化学系,20XX年。
化学竞赛有机方程式总结烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%) ⒉氧化(略)烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 符合马氏规则⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−O H 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH顺式加成,反马氏取向生成1︒醇 ⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 、 HI 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等⒏高锰酸钾氧化:碱性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH酸性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑⒐臭氧化: R O RRC=CHR ′−→−3OC CHR ′→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定′COOH′CHO′CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−→︒C 300-CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应: 氯代:CH 2=CHCH 3−−−−→−︒C600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBS CH 2=CH -CH 2Br ⒓重排:(CH 3)3CCH=CH 2−−→−HCl (CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
完美版)大学有机化学方程式总结有机化学是研究碳化合物的科学领域,是大学化学课程中的重要一砖。
本文将对有机化学方程式进行总结,以便帮助学生更好地掌握这门学科。
烃类方程式烷烃:烷烃是一类只含有碳和氢的有机化合物,通式为CnH2n+2.例如,甲烷的方程式为CH4.烯烃:烯烃是一类含有碳-碳双键的有机化合物,通式为CnH2n。
例如,乙烯的方程式为C2H4.炔烃:炔烃是一类含有碳-碳三键的有机化合物,通式为CnH2n-2.例如,乙炔的方程式为C2H2.功能团方程式烃基:选择一个合适的烃基,取代有机分子的一个或多个氢原子。
例如,苄基(CH2C6H5)。
羟基:羟基是一个氧原子和一个氢原子组成的功能团,通式为-OH。
例如,乙醇的方程式为CH3CH2OH。
羰基:羰基是一个碳氧双键的功能团,通式为-C=O。
例如,乙醛的方程式为CH3CHO。
胺基:胺基是一个氮原子和若干个氢原子组成的功能团,通式为-NH2.例如,甲胺的方程式为CH3NH2.脱水反应脱水反应是一种使有机分子失去水分子的化学反应。
常见的脱水反应方程式为:R-OH -。
R + H2O其中,R代表一个烃基,例如CH3.反应机制取代反应:取代反应是一种将一个原子或一个基团替换为另一个原子或基团的反应。
常见的取代反应有氯代烃的取代反应。
加成反应:加成反应是一种两个或多个分子结合生成一个新分子的反应。
常见的加成反应有烯烃的加成反应。
消除反应:消除反应是一种分子内或分子间发生氢、卤素或其他官能团相互消除形成双键或三键的反应。
常见的消除反应有炔烃的消除反应。
以上是对大学有机化学方程式的简要总结,希望能够为学生们的学习提供帮助。
要深入了解有机化学,还需进一步学习和实践。
有机化学一、烯烃1、卤化氢加成 ( 1)XHXRCHCH 2R CHCH 3【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】H 3 C+X +H 3CCH 3主快CH CH 3XH 3 CCH 2+ H +慢H 3C+X +H 3 CX次CH 2 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子 中间体。
【注】碳正离子的重排( 2)HBrR CHCH 2 R CH 2 CH 2 BrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于 HBr 、对 HCl 、 HI 无效。
【本质】不对称烯烃加成时生成 稳定的自由基 中间体。
【例】BrH 3 C CH CH 2 BrH 3CHBrCH2+H+H 3CCH CH 3HBrCH 3 CH 2 CH 2 BrBrH 3C CH CH 3 Br2、硼氢化 —氧化1)B 2 H 6R CHCH 2R CH 2 CH 2 OH2)H O /OH -2 2【特点】不对称烯烃经硼氢化 —氧化得一 反马氏加成 的醇,加成是 顺式 的,并且不 重排 。
【机理】H 3CH 3CH 3CCHCH 2CHCH 3CHCH 3HBH 2HBH 2HBH 2H 3CCH 3CH=CH 2-CH 2CH 2CH 3O OH-CH CH 2(CH 3 CH 2 CH 2 )3BH 3 CH 2CH 2C BO OHHBH 2CH 2CH 2CH 3CH 2CH 2CH 3CH 2 CH 2 CH 3+-H 3 CH 2 CH 2 C BOHOH 3CH 2CH 2 C -OCH 2CH 2CH 3B-CH CH CH3OOHHO O22CH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3BOCH 2 CH 2CH 3OCH 2CH 2CH 3B(OCH 2 CH 2 CH 3 )3+3NaOH 3NaOH3HOCH 2CH2CH33+Na 3BO3【例】1)BH 3OH H2)H 2O 2/OH -CH3HCH33、 X 2 加成BrBr 2 /CCl 4CCCC Br【机理】Br BrBrBr -Br+C +C BrCCC CC CBrBr H 2OBr +BrC+C C-HCC C+2【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
大学有机方程式总结(完美) -标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII2完美基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%)⒉硝化,磺化,氧化(略)烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−O H 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH 顺式加成,反马氏取向生成1︒醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3BrHCl 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等⒏高锰酸钾氧化:酸性:CH 3CH=CH 2+KMnO 4−−→−-OHCH 3CH(OH)CH 2OH+MnO 2+KOH 碱性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑ ⒐臭氧化:R ORRC=CHR’−→−3O C CHR’→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定−−−→−O 璈O H 222RCOR+R’COOH−−→−O H -Zn 2RCOR+R’CHO−−→−4LiAlH RRCHOH+R’CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C 300-Ag/200CH 2-CH 23 OCH 2=CH 2+O 2−−−−→−22CuCl ~PdCl CH 3CHO 多用于工业生产⒒α-取代反应:氯代:CH 2=CHCH 3−−−−→−︒C 600-/400Cl 2CH 2=CH -CH 2Cl溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl (CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
⒔聚合反应:含二聚和多聚(略)共轭双烯的反应:⒈1,2-加成和1,4-加成:CH=CH -CH=CH −→−2Br BrCH 2CH=CHCH 2Br+BrCH 2-CHBr -CH=CH 21,4-产物 1,2-产物不同反应条件下主要产物不同室温以上或极性溶剂: CH=CH -CH=CH+Br 2→BrCH 2CH=CHCH 2Br (1,4)0℃以下或非极性溶剂CH=CH -CH=CH+Br 2→BrCH 2-CHBr -CH=CH 2 (1,2)⒉与等摩尔的H 2加成:CH=CH -CH=CH −−−→−+Na EfOHCH 3CH=CHCH 3 (1,4) CH=CH -CH=CH −−→−/Pd H 2CH 3CH 2CH=CH 2 (1,2) ⒊双烯加成(Diels-Alder 反应):合成六元环的良好反应炔烃的反应:⒈加氢①催化加氢:CH 3C ≡CH −−→−/Pd H 2CH 3CH 2CH 3 ②部分加氢:CH 3C ≡CCH 3−−−−→−-Pd BaSO H42/ CH 3CH=CHCH 3(顺式) CH 3C ≡CCH 3−−−→−-)(3l NH Na CH 3CH=CHCH 3(反式) ⒉亲电加成:① 加卤素:CH 3C ≡CH −−→−2)(Br A CH 3CBr=CHBr −−→−)(2B Br CH 3CBr 2-CHBr 2反应B 远难于A ,故可停留在第一步产物阶段②双键优先于叁键加成: CH 2=CH -CH 2-C ≡CH −→−2Br BrCH 2-CHBr-CH 2C ≡CH4③加氢卤酸:CH 3C ≡CH+HBr →(A)CH 3CBr=CH 2+HBr →(B)CH 3CBr 2CH 3反应亦可停留在A 阶段⒊与亲核试剂加成:①与水加成:CH 3C ≡CH+H 2O −−→−4HgSO [CH 3C(OH)=CH 2]−−→−重排CH 3COCH 3中间步骤称为烯醇式重排②加HCN :CH ≡CH+HCN −−−−−→−-Cl NH Cl Cu 422CH 2=CH -CN产物为制取聚丙烯腈的原料③与其他亲核试剂的加成:CH ≡CH+ROH →CH 2=CH -ORCH ≡CH+NH 3→CH 2=CH -NH 2 CH ≡CH+CH 3COOH →CH 2=CH -OOCCH 3⒋作为酸的反应:① 与碱金属反应:CH 3C ≡CH+Na[NH 3(l)]→CH 3C ≡C -Na ② 与重金属(盐)反应:CH 3C ≡CH +Ag/NH 3-H 2O →CH 3C ≡C -Ag ↓CH 3C ≡CH+Cu/NH 3-H 2O →CH 3C ≡C -Cu ↓⒌氧化反应:①高锰酸钾氧化:RC ≡CR’+KMnO 4/H +→RCOOH+R’COOH②臭氧化:RC ≡CR’−−−−−→−B A O H ./CCl O .243RCOOH+R ’COOH⒍聚合反应:① 线型低聚:2CH ≡CH →Cu 2Cl 2-NH 4Cl/H +→CH 2=CH -C ≡CH 产物是制取丁二烯和氯丁二烯的原料② 环型低聚:3CH ≡CH −−−→−︒-C 500400⒎制备高级炔:CH 3C ≡CNa+CH 3CH 2CH 2Br →CH 3C ≡C -CH 2CH 2CH 3 卤代烷的反应:⒈亲核取代反应:RX+NaOH-H 2O →ROHRX+NH 3→RNH 2RX+R’ONa →ROR’RX+NaCN →RCNRX+H 2S →RSHRX+NaC ≡CR’→RC ≡CR’RX+CH 3COONa →CH 3COORRX+NaI-丙酮→RI+NaX ↓ (X:Cl,Br)RX+AgNO 3-C 2H 5OH →RNO 3+AgX ↓后一个反应常用于RX 的鉴别⒉消除反应:5CH 3CH 2CHClCH 3+KOH-ROH →CH 3CH=CHCH 3(主要)+CH 3CH 2CH=CH 2遵守查依采夫规则主要生成含取代基较多的双键产物⒊生成金属有机化合物:RCl+MgEt 2O →RMgCl RCl+Li →RLi⒋被还原:RCl+LiAlH 4,THF →RHRCl+Zn/HCl →RHRCl+Pt/H 2→RH⒌卤素置换:RCl(Br)+NaI-丙酮→RI+NaCl醇的性质:⒈醇的酸性:与活泼金属反应CH 3CH 2OH+Na →CH 3CH 2ONa+H 2↑ 酸性ROH(3︒<2︒<1︒<CH 3OH)<HOH<RCOOH碱性RO -(3︒>2︒>1︒>CH 3O -)>OH ->RCOO -⒉成酯反应:① 与硫酸成酯:CH 3OH+H 2SO 4→(CH 3O)2SO 2+H 2O产物(CH 3O)2SO 2是常用的甲基化试剂② 与硝酸成酯:CH 2OHCHOHCH 2OH+HNO 3−→−+H CH 2ONO 2CHONO 2CH 2ONO 2 产物称硝酸甘油可作为炸药或用于医药③与有机酸成酯:CH 3CH 2OH+CH 3COOH −→−+H CH 3COOCH 2CH 3⒊卤代反应:① 与氢卤酸反应:ROH+HX →RX+H 2O产物亦可视为氢卤酸的酯HX:HI>HBr>HClCH 3CH 2OH+HCl/ZnCl 2→CH 3CH 2Cl+H 2O试剂HCl/ZnCl 2称Lucas 试剂,用于鉴别醇的级别ROH 反应活性:烯醇式~3︒>2︒>1︒② 重排反应:(CH 3)3C -CH 2OH+HCl →(CH 3)2CClCH 2CH 3 ③ 与卤化磷反应:ROX+PX 3→RX+H 3PO 4 (PBr 3.PCl 3)ROH+I 2−→−P RI ⒋消除反应:与硫酸共热CH 3CH 2CHOHCH 3−−−→−∆/SO H 42CH 3CH=CHCH 3(主要)+CH 3CH 2CH=CH 2 ROH 的反应活性:3︒>2︒>1︒(CH 3)3C -OH −−−−→−︒C /87SO H 42(CH 3)2C=CH 2 CH 3CH 2CHOHCH 3−−−−−→−︒C /100SO ?60%H42CH 3CH=CHCH 3 CH 3CH 2CH 2CH 2OH −−−−−→−︒C /140SO ?75%H42CH 3CH 2CH=CH 2 ⒌氧化反应:① CrO 3-H 2SO 4氧化:RCHOH −−−−→−423SO H -CrO RCH=OROH62︒ROH 氧化成酮 3︒ROH 不易氧化② HIO 4氧化:RRCOH -CHOHR’ −−→−4IO H RRC=O+R’CH=O ⒍醇制法①烯烃的硼氢化:CH 3CH=CH 2−−−−−−→−B A -2262OH -O .H H .B CH 3CH 2CH 2OH ③ 格氏试剂法:是合成指定结构的醇的最好方法RCH=O+CH 3CH 2MgBr →RCHOMgBrCH 2CH 3+H 2O(H +)→RCHOHCH 2CH 3④ 羰基化合物还原法:RCH=O →RCH 2OH羰基化合物还可以是 醛 酮 酯 酰卤 羧酸还原剂可以是LiAlH 4 √ √ √ √ √NaBH 4 √ √ × √ ×H 2/Ni √ √ √ √ ×羰基化合物的反应:亲核加成反应:⒈NaHSO 3加成:RCH=O+NaHSO 3→RCHOH -SO 3Na ↓产物为结晶状,反应物不同结晶不同,可用于鉴别⒉HCN 加成:RCH=O+HCN/OH -→RCHOHCN +H 2O/H +→RCHOH -COOH⒊格氏试剂加成:RCH=O+R’MgX →RCHOHR’使用不同的羰基化合物可分别得到1︒,2︒,3︒醇⒋胺的加成:RCH=O+NH 2R’→RCHOHNHR’→RCH=NR’产物可水解(H 2O-H +)复原,故可用于保护羰基,亦可经还原制取1︒,2︒胺 ⒌胲(羟胺)的加成:RCH=O+NH 2-OH →RCH=N -OH(肟)产物可发生重排,工业上用于尼龙-6单体生产 =O → =N -OH → =O⒍肼的加成:RCH=O+H 2N -NH 2→RCH=NH 2(腙)⒎醇的加成:RCH=O+CH 3OH −−−−−→←O H HCl 2/)(无水RCH< −−−−→←O H OH CH 23/RCH< 生成半缩醛(酮)及缩醛(酮),可用于羰基保护⒏炔的加成:RCH=O+ CH ≡CH/Na-NH 3(l)→RCHOH -C ≡CH ⒐Wittig 加成:RCH=O+Ph 3P=CHR’→RCH=CHR’⒑Michael 加成:CH 2=CHCH=O+HCN →[CH 2CNCH=CH -O -H]→CH 2CNCH 2CH=O 羰基α-H 引起的反应:⒈羰醛缩合反应:2RCH 2CH=O −−→−-OH RCH 2CHOH -CHRCH=O −−→−-O H 2RCH 2CH=CRCH=O 接长碳链的重要反应,用途广泛① Claisen-Sehmidt 反应:芳醛和含α-H 的醛缩合7 -CH=O+CH 3CH=O/OH -→ -CH=CHCH=O② Perkin 反应:芳醛和酸酐缩合-CH=O+(CH 3CO)2O/AcONa → -CH=CHCOOH③ Tollen’s 反应,可以制取一个有趣的化合物3H 2C=O+CH 3CH=O →⒉碘仿反应:RCOCH 3+I 2-NaOH →[RCOCI 3]→RCOOH+CHI 3凡含有RCO -结构,或经氧化后可生成此结构的化合物均可发生此反应,它既可用于该结构的鉴定,也可在合成过程中作切断碳链用.醛酮的氧化还原反应:⒈氧化反应:①银镜反应:RCH=O+2[Ag(NH 3)2]++2OH -→2Ag ↓+RCOO -NH 4++3NH 3+HOHTollen 也称反应,适用于醛,但α-羟基酮有时也给出正反应,类似的反应还有与新制氢氧化铜的反应。