热力学四大定律第零定律热平衡Thezerolawofthermodynamics
- 格式:doc
- 大小:47.00 KB
- 文档页数:3

热力学4大定律
热力学是研究物质热现象和能量转化的学科,其基础是热力学定律。
其中,热力学的4大定律是热力学的基石,下面一一介绍:第一定律:能量守恒定律
能量无法被创造或毁灭,只能被转化形式。
在系统内,能量的增加等于吸收的热量与对外做功的代数和。
这就是热力学第一定律,也被称为能量守恒定律。
第二定律:熵增定律
热能总是从高温物体流向低温物体,不可能自行流动反向。
这是热力学第二定律,也被称为熵增定律。
熵是一个系统的无序程度,它总是在不断增加。
热力学第二定律告诉我们,任何封闭系统中,熵不可能减少,只能增加或保持不变。
第三定律:绝对零度定律
绝对零度是温度的最低限度,等于绝对零度时,物质的分子运动完全停止。
热力学第三定律规定,任何物体都无法达到绝对零度,但可以接近于零度。
第四定律:热力学定量关系定律
热力学第四定律描述了热力学量之间的定量关系,例如温度、熵、热容等。
这些关系可以用来预测系统中的热力学性质和行为。
这些热力学定律是理解能量和热力学系统运作的基础。
了解这些定律可以帮助我们更好地理解自然规律和技术应用。
- 1 -。


第零定律:熱平衡The zero law of thermodynamics T1=T2=T3=T4第一定律:The first Law of thermodynamics能量守恆定律(The Law of conservation of energy)△E=Q-WQ=-W= Pdv = -nRTln v2/v1Q=+nRT ln V2/V1代入S= dnRT ln V2/V1T第二定律:每一自發性的變化均伴隨著熵的增加宇宙趨向最大亂度S>0熵entropy S :熱力學函數(thermodynamic function),熵可解釋為一種物系「亂度」或不規律的一種量度。
熵可視為一機率函數S宇宙= S系統+ S週邊>0判斷自發的方法:S>0(不可逆)S= 0(可逆),S<0(不發生)S 表示熵的改變。
宇宙上能量傳遞有方向性的,總是由高能量傳到低能量。
第三定律:在OK時,一完全結晶物體之熵會等於零,S=0所有物體都呈現靜止狀態。
海水轉變成淡水化工程要生產出1噸淡水,需要抽取2.5噸海水作為“原水”。
海水被抽出後,首先通過加藥-混凝沉澱環節除去海水大顆粒懸浮物,然後進入氣浮池進行預處理,後經過超濾、反滲透兩個主要環節,充分去除海水中的鹽分、懸浮物、有機物和藻類物質等,最後進入後礦化環節調節水的硬度和pH值,苦澀的海水就變成能夠直飲的淡水了自然科學:1543年─哥白尼:(天體運行論)以太陽為中心(日心論)1.伽利略:望遠鏡→h=1/2gt22.刻卜勒:行星三大運動定律第一定律:「軌道定律」─所有的行星繞著太陽運行第二定律:等面積定律─T=T2-T1=T4-T3第三定律:週期定律R13= R23=KT12T22第一定律:慣性定律─靜者恒靜,動者恒動。
第二定律:加速度定律速度= s/t =V 公尺/秒F一定:m與a成反比mx1/aF=mxa m一定:Fxa成正比a一定:Fxm成正比第三定律:作用力與反作用力定律複色光分解為單色光的現象叫光的色散.牛顿在1666年最先利用三棱鏡觀察到光的色散,把白光分解為彩色光帶(光譜).色散現象説明光在媒質中的''速度''溯因法的推理步驟:觀察現象形成假設(猜測原因)- -解釋假設-- 最佳解釋-- 檢驗強調;猜測與假設的區別。


热力学中的热力学四律和定律推导热力学是自然科学中的一门重要学科,研究的是热和其它形式的能量的转化和相互关系。
在研究热力学时,我们需要遵守一些热力学法则,也就是热力学四律和定律。
这些法则告诉我们在物质世界中能量是怎样流动的,同时也是指引我们分析和解决热学问题的有力工具。
本文将通过推导来说明这些定律的基本原理和应用。
热力学四律热力学四律是热力学的基本定律,表述了热力学系统中能量的转化和传递过程。
四律分别是能量守恒定律、熵增定律、热力学第一定律和热力学第二定律。
能量守恒定律能量守恒定律是热力学四律中最基本的原则,它指出能量在任何转化或传递过程中都不会消失或增加,只会从一种形式转换成另一种形式。
在一个封闭系统中,能量的总量是恒定的,且无法被永久地摧毁或产生。
根据能量守恒定律,热力学系统中的能量可以以很多不同的方式表达,例如内能、势能、动能、电能等。
而热力学四律的其它三条定律就是特定形式下的能量转化和转移的结果。
熵增定律熵增定律又称热力学第二定律的熵增原理,它描述了自然界中的一个普遍趋势,即熵总是朝着增加的方向发展。
熵是一个用来描述系统混乱程度的物理量,熵增原理要求在任何系统发生变化时,系统的熵都应该增加。
熵增原理可以通过考虑热能传导、发电机以及化学反应中的一系列过程得出。
热力学第一定律热力学第一定律也称能量守恒定律,它指出能量不会凭空消失或产生,只会从一种形式转化为另一种形式。
这个定律是基于能量守恒原理的,告诉我们在一个封闭系统中的能量总量是恒定的。
这个定律可以用来描述系统中的热量、工作和内能之间的关系。
热力学第二定律热力学第二定律是热力学中最重要的定律之一,它提供了关于自然界不可逆性和封闭系统热量转换无法达到百分百效率的重要信息。
这个定律表明热量不可能自发地从低温物体传递到高温物体中。
除非有外部能量源或热泵,否则温度差会导致热量在系统中自行流动。
定律的运用热力学四律和定律虽然看起来十分简单,但在实践中有极其广泛的应用。

热力学四大定律:第零定律——若A与B热平衡,B与C热平衡时,A与C也同时热平衡第一定律——能量守恒定律(包含了热能)第二定律——机械能可全部转换成热能,但是热能却不能以有限次的试验操作全部转换成功(热能不能完全转化为功)第三定律——绝对零度不可达成性热力学定律的发现及理论化学反应不是一个孤立的变化过程,温度、压力、质量及催化剂都直接影响反应的方向和速度。
1901年,范霍夫因发现化学动力学定律和渗透压,提出了化学反应热力学动态平衡原理,获第一个化学奖。
1906年能斯特提出了热力学第三定律,认为通过任何有限个步骤都不可能达到绝对零度。
这个理论在生产实践中得到广泛应用,因此获1920年化学奖。
1931年翁萨格发表论文“不可逆过程的倒数关系”,阐明了关于不可逆反应过程中电压与热量之间的关系。
对热力学理论作出了突破性贡献。
这一重要发现放置了20年,后又重新被认识。
1968年获化学奖。
1950年代,普利戈金提出了著名的耗散结构理论。
1977年,他因此获化学奖。
这一理论是当代热力学理论发展上具有重要意义的大事。
它的影响涉及化学、物理、生物学等广泛领域,为我们理解生命过程等复杂现象提供了新的启示。
热力学第零定律如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
热力学中以热平衡概念为基础对温度作出定义的定律。
通常表述为:与第三个系统处于热平衡状态的两个系统之间,必定处于热平衡状态。

热力学第零定律内容和意义热力学第零定律,又称熵定律,是热力学的一个基本定律。
由于它是热力学的基础,因此也被称为“热力学第零定律”。
热力学第零定律内容是:在一定温度条件下,同种物质当量的两个热力系统,其熵相等。
简单地说,就是在不考虑其他因素的情况下,保持温度不变的情况下,两个热力系统的熵相等。
熵是物理学中的一个重要概念,指的是一个热力系统的无序程度。
它是热量的函数,可以衡量热力系统的热量分布、温度分布和熵的大小。
热力学第零定律强调了热力系统的熵的不变性。
热力学第零定律的意义在于,它提供了一种新的方法来描述热力系统的变化,即考虑熵的变化。
它明确表明,保持温度不变的情况下,两个热力系统的熵相等,这意味着熵是一个不变量,这是热力学第零定律最重要的意义。
热力学第零定律的另一个重要意义在于:它可以作为一种把热力系统物理量转化为熵的方法,是热力学的基础,也是发展热力学的基础。
熵的概念被广泛应用于传热学、流体力学和物理化学等领域,也是构成热力学的基本概念。
热力学第零定律还能够解释物质的热力行为,以及它们之间的相互作用。
它能够揭示物质的真实物理性质,使人们能够深入研究物质的性质和物质的变化,从而更好地理解和控制物质的变化和变化过程。
热力学第零定律还能够帮助我们更好地理解物质的本质,因为热力学第零定律揭示了物质的热力性质和变化,从而使我们能够更好地把握其本质。
此外,它还可以帮助我们更好地研究物质的变化规律,以及物质之间的相互作用,从而更好地掌握物质的性质和变化。
热力学第零定律提供了一种新的视角,使人们可以更好地理解物质的本质,以及物质之间的变化规律。
它为研究物质的性质提供了一个重要的基础,为热力学和物理学的发展提供了重要的基础,使我们更好地理解物质的本质,开发有效的技术手段,从而更好地掌握物质的变化,更有效地利用物质的能量,从而有效控制物质的变化。
综上所述,热力学第零定律内容是:在一定温度条件下,同种物质当量的两个热力系统,其熵相等。

热力学第零定律的理解热力学第零定律是热力学的基本定律之一,对于理解和研究热力学现象具有重要意义。
热力学第零定律的正确表述应为:热平衡具有传递性。
这意味着,如果两个热力学系统均与第三个系统处于热平衡状态,那么这两个系统之间也必定处于热平衡状态。
为了更好地理解热力学第零定律,我们可以从以下几个方面进行阐述:1.热平衡的概念热平衡是指一个热力学系统内,所有微观粒子的热运动状态均达到均匀、无序、无规则的状态。
在热平衡状态下,系统的温度、压力、化学势等宏观性质不再发生变化。
2.热平衡的传递性根据热力学第零定律,如果两个热力学系统A和B分别与第三个系统C处于热平衡状态,那么可以推断出A和B之间也必定处于热平衡状态。
这意味着,如果我们知道A和C、B和C分别处于热平衡状态,那么可以断定A和B之间也处于热平衡状态。
3.温度的定义根据热力学第零定律,处于同一热平衡状态的系统具有一个数值上相等的共同的状态参数,这个参数就是温度。
温度是描述物体热力学状态的重要参数,它表示物体分子热运动的平均动能。
温度的概念对于热力学的研究具有重要意义,因为它将热力学系统中各种复杂的现象简化为一个单一的参数,使得我们可以通过分析温度来研究热力学问题。
4.温度的特性温度具有以下特性:(1)温度的单位:温度的单位是开尔文(K),绝对零度是温度的最低极限,而高温的极限则可能达到5109K。
(2)温度的传递性:根据热力学第零定律,如果两个物体分别与第三个物体处于热平衡状态,那么这两个物体之间也必定处于热平衡状态。
(3)温度的测量:我们通常所说的测量温度,实际上是在测量物体的热力学性质,而不是直接测量温度本身。
5.热力学第零定律的意义热力学第零定律是热力学的基础,它揭示了热平衡现象的基本规律,对于我们理解和研究热力学问题具有重要意义。
热力学第零定律的提出,为后续热力学理论的建立和发展奠定了基础。
6.热力学第零定律的应用热力学第零定律在实际应用中具有广泛的应用,例如:(1)在工业生产中,热力学第零定律被应用于恒温控制、热交换器的设计等方面。

热力学共有四大定律第零定律:热平衡定律(zeroth law of thermodynamics )第一定律:能量守恒定律,“热”是一种能量。
第二定律:熵函数的引出及过程变化方向的熵判据在一个封闭系统(closed system)里操作,总熵量有增无减:只能不变或增加,不能减少。
第三定律:决对零度达不到,在绝对温度0K(相当于-273.15摄氏度)下,所有物质的熵都等于0。
热力学第零定律如果两个热力系的每一个都与第三个热力系处于热平衡,则它们彼此也处于热平衡。
热力学第零定律于1930年由福勒(R.H.Fowler)正式提出,比热力学第一定律和热力学第二定律晚了80余年。
虽然这么晚才建立热力学第零定律,但实际上之前人们已经开始应用它了。
因为它是后面几个定律的基础,在逻辑上应该排在最前面,所以叫做热力学第零定律。
如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
热力学中以热平衡概念为基础对温度作出定义的定律。
通常表述为:与第三个系统处于热平衡状态的两个系统之间,必定处于热平衡状态。
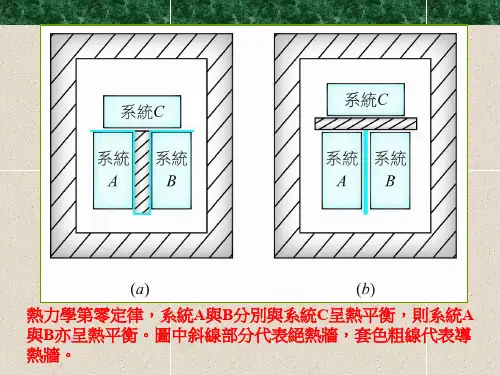
图中A热力学第零定律示意图、B热力学第零定律示意图、C 热力学第零定律示意图为3个质量和组成固定,且与外界完全隔绝的热力系统。
将其中的B、C用绝热壁隔开,同时使它们分别与A发生热接触。
待A与B和A与C都达到热平衡时,再使B与C发生热接触。
这时B和C的热力状态不再变化,这表明它们之间在热性质方面也已达到平衡。

热力学第零定律——热平衡定律,为什么不是热力学第四定律呢?热力学第一定律提出于1850年左右。
热力学第二定律提出于1850-1851年之间。
热力学第三定律提出于1905年。
而热力写第零定律却是在1931年提出的。
如果按提出的先后顺序来讲,应该被称为第四定律才对,可为什么被定义为第零定律呢?其实主要的原因是因为第零定律是第一、二、三定律的基础,所以它排在最前面。
如果它在1850年前提出的话,它就应该是排在第一位了,其他三定律依次为二、三、四定律。
那到底第零定律讲了什么呢?“若两个热力学系统均与第三个系统处于热平衡状态,此两个系统也必互相处于热平衡。
”这好像是显而易见的。
所以虽然人们早就觉察到这种现象,但直到二十世纪三十年代前一直都未有人们想把它以定律的形式表达出来。
1931年,英国物理学家拉尔夫·福勒正式提出热力学第零定律,比热力学第一定律和热力学第二定律晚了整整80余年。
为什么说它是基础呢?因为在热力学的研究过程中,温度给出了热力学状态的定量数据,是研究的基础。
而测量的温度采用的温度计,恰恰使用了热力学第零定律。
测量液体的温度为了测量系统A的热力学状态,我们把温度计和它接触在一起,当温度计的指数不再变化时,系统A与温度计达到热力学平衡,温度计的数字也就是系统A的温度t;然后再去测量系统B,也得出温度t;那么我们就说系统A与B的温度相同。
如上,如果没有热力学第零定律的话,即使测出A、B温度都为t,我们也无法给出A、B的温度相同的结论。
拉尔夫·福勒再来说一下提出热力学第零定律的拉尔夫·福勒,他生于1889年的英国,毕业于剑桥大学。
他还是鼎鼎大名的欧内斯特·卢瑟福(原子核物理学之父)的女婿,他的学生也是极为出名,保罗·狄拉克(量子力学的奠基人)和苏布拉马尼扬·钱德拉塞卡(钱德拉塞卡极限)。
热力学第零定律内容和意义热力学是物理学中一门重要的学科,它主要研究热能和工作之间的转换,拥有重要的理论及实际应用价值。
它的基础是由拉格朗日提出的三项定律,其中包括热力学第一定律、热力学第二定律和热力学第零定律。
以下将着重讨论热力学第零定律的内容和意义。
热力学第零定律是由维克多萨班宁(Victor S.B.)在1961年提出的,它指出,一个热系统的熵增量,等于在这个热系统中加热所发出的热量,除以当时的绝对温度。
由此可以得出热力学第零定律公式:ΔS=Q/T其中,ΔS是热系统熵的增量,Q发出的热量,T是当时的绝对温度。
此定律可以说是热力学的基础定律,它为其他定律提供了支撑,如:热力学第二定律和热力学第一定律。
热力学第一定律是比较了热系统的熵,即热系统可能性的变化,热力学第二定律则把这种变化表示为熵的增量,而而热力学第零定律则提供了这种熵增量计算的具体方法。
热力学第零定律最重要的意义是它可以用来衡量热系统的活性。
它可以让我们在任何情况下计算出热系统中的热量,从而衡量活性的变化,从而推进微观热力学、熵温度曲线及热工程的应用。
而在某些情况下,如制备冷却剂等,热力学第零定律也可以用来衡量不同密度的工质的活性。
热力学第零定律还可以应用在经济方面,特别是在热机设备如蒸汽机等发电设备和冷却设备等工业加工行业中有着重要的应用。
它可以帮助我们计算出不同工质和不同形式下的热量存储量,从而控制发电机和冷却器的工作性能,并提高系统的经济效率。
总之,热力学第零定律是热力学学科中一项重要的基础定律,它可以计算出热系统的活性,衡量不同的热量存储量,为工业加工提供参考,提高系统的经济效率,是物理学中一门重要的学科,也是热力学学科中重要的定律。
热力学第零定律热力学第零定律:如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
热力学中以热平衡概念为基础对温度作出定义的定律。
通常表述为:与第三个系统处于热平衡状态的两个系统之间,必定处于热平衡状态。
图中A热力学第零定律示意图、B热力学第零定律示意图、C热力学第零定律示意图为3个质量和组成固定,且与外界完全隔绝的热力系统。
将其中的B、C用绝热壁隔开,同时使它们分别与A 发生热接触。
待A与B和A与C都达到热平衡时,再使B与C发生热接触。
这时B 和C的热力状态不再变化,这表明它们之间在热性质方面也已达到平衡。
第零定律表明,一切互为热平衡的系统具有一个数值上相等的共同的宏观性质──温度。
温度计所以能够测定物体温度正是依据这个原理。
热力学第一定律thermodynamics,first law of基本内容:热可以转变为功,功也可以转变为热;消耗一定的功必产生一定的热,一定的热消失时,也必产生一定的功。
普遍的能量转化和守恒定律在一切涉及热现象的宏观过程中的具体表现。
热力学的基本定律之一。
热力学第一定律是对能量守恒和转换定律的一种表述方式。
热力学第一定律指出,热能可以从一个物体传递给另一个物体,也可以与机械能或其他能量相互转换,在传递和转换过程中,能量的总值不变。
表征热力学系统能量的是内能。
通过作功和传热,系统与外界交换能量,使内能有所变化。
根据普遍的能量守恒定律,系统由初态Ⅰ经过任意过程到达终态Ⅱ后,内能的增量ΔU应等于在此过程中外界对系统传递的热量Q 和系统对外界作功A之差,即UⅡ-UⅠ=ΔU=Q-A或Q=ΔU+A这就是热力学第一定律的表达式。
【热力学基本定律】通常是将热力学第一定律及第二定律视作热力学的基本定律,但有时增加能斯特定理当作第三定律,又有时将温度存在定律当作第零定律。
一般将这四条热力学规律统称为热力学定律。
热力学是热现象的宏观理论,它是以这四条定律为基础建立起来的理论。
【热力学第零定律】若两个热力学系统中的任何一个系统都和第三个热力学系统处于热平衡状态,那么,这两个热力学系统也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
因此,这一基本物理量实质是反映了系统的某种性质。
【热力学第一定律】是热力学的基本定律之一。
是能的转化与守恒定律在热力学中的表现。
它指出热是物质运动的一种形式,并表明,一个体系内能增加的量值△E(=E2-E1)等于这一体系所吸收的热量Q与外界对它所做的功之和,可表示为△E=E2-E1=Q+W即W+Q=△E。
在这个公式中,突出了做功和热传递是改变系统内能的两种不同形式,可通过做功和被传递的热量来量度系统内能的变化。
在上述公式中,当外界对系统作功时,W为正值;若系统对外作功时,W为负值。
如外界向系统传热,Q即为正值;若系统向外界放热,则Q为负值。
当△E为正值时,表示系统的内能增加;如果△E为负值时,则表现系统的内能在减少。
对热力学第一定律也可以从另一侧面来描述,即外界传递给系统的热量等于系统内能的增量和系统对外所作的功的总和。
如果外界传递给系统的热量为Q,使系统从某一平衡状态到达另一平衡状态,内能的增加为E2-E1,同时对外作功W′,则热力学第一定律可表示为Q=(E2-E1)+ W′即Q=△E+W′。
热力学第四定律
热力学有四大定律
1.热力学第零定律——如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡.
2.热力学第一定律——能量守恒定律在热学形式的表现.
3.热力学第二定律——力学能可全部转换成热能,但是热能却不能以有限次的实验操作全部转换成功 (热机不可得).
4.热力学第三定律——绝对零度不可达到但可以无限趋近.
所以说热力学是有四个定律,从第0定律到第3定律,但是没有第四定律!。
第零定律:熱平衡
The zero law of thermodynamics T1=T2=T3=T4
第一定律:The first Law of thermodynamics
能量守恆定律(The Law of conservation of energy)
△E=Q-W
Q=-W= Pdv = -nRTln v2/v1
Q=+nRT ln V2/V1代入
S= dnRT ln V2/V1
T
第二定律:
每一自發性的變化均伴隨著熵的增加
宇宙趨向最大亂度S>0
熵entropy S :熱力學函數(thermodynamic function),熵可解釋為一種物系「亂度」或不規律的一種量度。
熵可視為一機率函數
S宇宙= S系統+ S週邊>0
判斷自發的方法:S>0(不可逆)
S= 0(可逆),S<0(不發生)S 表示熵的改變。
宇宙上能量傳遞有方向性的,總是由高能量傳到低能量。
第三定律:
在OK時,一完全結晶物體之熵會等於零,
S=0
所有物體都呈現靜止狀態。
海水轉變成淡水化工程
要生產出1噸淡水,需要抽取2.5噸海水作為“原水”。
海水被抽出後,首先通過加藥-混凝沉澱環節除去海水大顆粒懸浮物,然後進入氣浮池進行預處理,後經過超濾、反滲透兩個主要環節,充分去除海水中的鹽分、懸浮物、有機物和藻類物質等,最後進入後礦化環節調節水的硬度和pH值,苦澀的海水就變成能夠直飲的淡水了
自然科學:
1543年─哥白尼:(天體運行論)以太陽為中心(日心論)
1.伽利略:望遠鏡→h=1/2gt2
2.刻卜勒:行星三大運動定律
第一定律:「軌道定律」─所有的行星繞著太陽運行
第二定律:等面積定律─T=T2-T1=T4-T3
第三定律:週期定律R13= R23=K
T12T22
第一定律:慣性定律─靜者恒靜,動者恒動。
第二定律:加速度定律
速度= s/t =V 公尺/秒
F一定:m與a成反比mx1/a
F=mxa m一定:Fxa成正比
a一定:Fxm成正比
第三定律:作用力與反作用力定律
複色光分解為單色光的現象叫光的色散.牛顿在1666年最先利用三棱鏡觀察到光的色散,把白光分解為彩色光帶(光譜).色散現象説明光在媒質中的''速度''
溯因法的推理步驟:
觀察現象
形成假設(猜測原因)- -解釋假設-- 最佳解釋-- 檢驗
強調;猜測與假設的區別。
靜電:
在空氣乾燥的季節裡,衣類會產生靜電。
如以手指頭摸到衣服時,會出現霹哩拍拉的火花與聲音。
此種的靜電也可以稱做摩擦電,當使用乾燥的布摩擦不導電物質(如硬橡膠)時,會非常明顯的產生此種電。
然後將小紙片靠近該物質則吸引過去。
這個現象表示,摩擦後物質帶正電,然後吸引不帶電的物質,但經常在電氣上為負電性的輕量物質。
此為電的正性及負性相吸引作用的結果。
惟帶同一種電的物件則相排斥,因此一旦被吸引後帶正電的輕量物質就不再被吸引而遭偶排斥。
核能發電的優點:
核能發電不像化石燃料發電那樣排放巨量的污染物質到大氣中,因此核能發電不會造成空氣污染。
核能發電不會產生加重地球溫室效應的二氧化碳。
核能發電所使用的鈾燃料,除了發電外,沒有其他的用途。
核燃料能量密度比起化石燃料高上幾百萬倍,故核能電廠所使用的燃料體積小,運輸與儲存都很方便,一座1000百萬瓦的核能電廠一年只需30公噸的鈾燃料,一航次的飛機就可以完成運送。
核能發電的成本中,燃料費用所佔的比例較低,核能發電的成本較不易受到國際經濟情勢影響,故發電成本較其他發電方法為穩定。
核能發電的缺點:
核能電廠會產生高低階放射性廢料,或者是使用過之核燃料,雖然所佔體積不大,但因具有放射線,故必須慎重處理,且需面對相當大的政治困擾。
核能發電廠熱效率較低,因而比一般化石燃料電廠排放更多廢熱到環境裏,故核能電廠的熱污染較嚴重。
核能電廠投資成本太大,電力公司的財務風險較高。
核能電廠較不適宜做尖峰、離峰之隨載運轉。
興建核電廠較易引發政治歧見紛爭。
核電廠的反應器內有大量的放射性物質,如果在事故中釋放到外界環境,會對生態及民眾造成傷害。
乾電池:
Zn→Zn2++2e-
2NH4Cl(s)+2MnO2+2e-→Mn2O3+(NH3)2Cl-2+H2O
Zn+2NH4Cl(s)+2MnO2→Zn(NH3)2Cl2+MnO3+H2O
鉛蓄電池:
陽:Pb+H2SO4→PbSO4+2e-+2H+ 陰:PbO2+H2SO4+2e-→PbSO4+2OH-
全:Pb+PbO2+2H2SO4 2PbSO4+2H2O
積體電路(IC)
在一小塊矽晶片上,同時製作電晶體、二極體、電容器、電阻等元件,並聯結成整體電路,目
前已可在30mm2矽片上作106個各種電路。
電視
分成聲音、圖像、與彩色信號三部份。
聲音的傳送和一般廣播相同,為調頻波。
圖像的傳送係
把圖像分成許多光點,藉光電效應轉換成電流。
彩色電視:光的三原色分為紅、綠、藍三色
電算機
俗稱為電腦,它是二十世紀人類最智慧的產品。
具備輸入、處理、記憶、和輸出四大主要部份。
1.中央處理單元:是電算機的心臟,可分為三個部份:主儲存部分、算數邏輯部份、和控制部份。
2.記憶單元:記憶器用以儲存所運算和操作的程式指令、資料、結果。
(1)內部處理記憶器(2)主記憶器(3)輔助記憶器
3.輸入及輸出:總稱為週邊設備,往往輸入與輸出使用同一裝置,有磁碟機、磁帶機、鍵盤、滑
鼠、螢幕、感應筆、引表機、繪圖機等。
這些都是人與電腦解釋和溝通的工具。
浮力:
排開液體體積*液體密度=V下xD液稱為阿基米德原理
動態流體:
P+1/2xdV2+dgh=定值
P:壓力d:密度v:速度g:重力加速度h:高度
宇宙四大因素:
物質-具有質量,佔有空間
能量-由物質變化而成E=mc2
時間-主宰物質的變化
空間-位置
電量
質量電性
電子9.1*10-31 kg ─ -1.6*10-19 質子 1.67*10-27kg + +1.6*10-19 中子 1.675*10-27 kg x x
值量大小:中子>質子>電子質量數:質子+中子原子序:電子數或質子數
同位素-中子數不同,電子、質子相同
Solid(固):一定體積,一定形狀Liquid(液):一定體積,無一定形狀Gas(氣):都沒有
光合作用:CO2+H2O葉綠素1/n(CH2O)n+O2
光合。