第八章 沉淀滴定法
- 格式:pdf
- 大小:225.40 KB
- 文档页数:8









第八章沉淀滴定法第一节概述沉淀滴定法又称容量滴定法,是以沉淀反应为基础的滴定分析方法沉淀反应很多,但是用作滴定法的沉淀反应必须满足下列条件:(1)沉淀的溶解度必须很小(2)反应迅速、定量(3)有适当的指示终点的方法(4)沉淀的吸附现象不能影响终点的确定用于沉淀滴定法的反应,主要是生成难溶性银盐的反应银量法:利用生成难溶性银盐的滴定法,习惯上称为~本法可以用来测定含氯离子、溴离子、碘离子、硫氰酸根离子以及银离子等离子的化合物沉淀滴定法,除了银量法以外,还有利用其他沉淀反应的方法第二节银量法一、基本原理(一)滴定曲线1 滴定开始前溶液中氯离子浓度为溶液的原始浓度2 滴定至化学计量点前溶液中氯离子浓度,取决于剩余的氯化钠的浓度3 化学计量点时溶液是AgCl的饱和浓度4 化学计量点后溶液的银离子浓度由过量的硝酸银浓度决定滴定曲线说明的问题:(1)pX与pAg两条曲线以化学计量点对称随着滴定的进行,溶液中银离子浓度增加时,卤离子以相同的比例减小;而化学计量点时,两种离子浓度相等,及两条曲线在化学计量点相交(二)分布滴定溶液中同时含有氯离子、溴离子和碘离子时,由于AgI,AgBr,AgCl的溶度积差别较大,当浓度差别不太大时,可利用分步沉淀的原理,用硝酸银溶液连续滴定,测出它们各自的含量溶度积最小的AgI将最先沉淀,AgCl最后析出,在滴定曲线上显示三个突跃二、指示终点的方法银量法,根据确定终点所用指示剂不同有三种:铬酸钾指示剂法(Mohr法)、铁铵矾指示剂法(V olhard法)以及吸附指示剂法(Fajan法)(一)铬酸钾指示剂法铬酸钾指示剂法:用硝酸银标准溶液滴定氯化物或溴化物时,采用铬酸钾为指示剂用铬酸钾指示终点的优点:一.因为铬酸银沉淀具有砖红色,能明显地显示滴定终点二.铬酸钾的溶度积常数Ksp=1.1*10-12,使其刚过化学计量点,即银离子稍有过量立刻产生铬酸银沉淀,而定量地指示出银离子与氯离子的化学计量点。
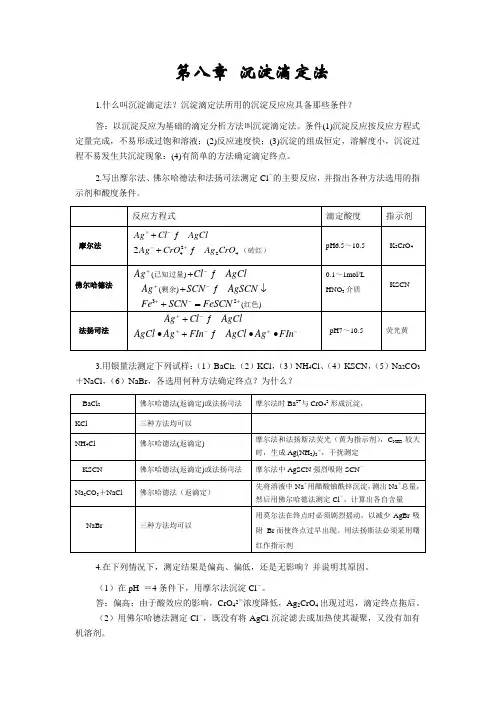
第八章 沉淀滴定法1.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应应具备那些条件?答:以沉淀反应为基础的滴定分析方法叫沉淀滴定法。
条件(1)沉淀反应按反应方程式定量完成,不易形成过饱和溶液;(2)反应速度快;(3)沉淀的组成恒定,溶解度小,沉淀过程不易发生共沉淀现象:(4)有简单的方法确定滴定终点。
2.写出摩尔法、佛尔哈德法和法扬司法测定Cl -的主要反应,并指出各种方法选用的指示剂和酸度条件。
AgCl242CrO Ag CrO +已知过量)Cl AgCl -+ SCN AgSCN -2FeSCN +(红色AgClAgCl -∙3.用银量法测定下列试样:(1)BaCl 2,(2)KCl ,(3)NH 4Cl 、(4)KSCN ,(5)Na 2CO 3+NaCl ,(6)NaBr ,各选用何种方法确定终点?为什么?4.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH =4条件下,用摩尔法沉淀Cl -。
答:偏高;由于酸效应的影响,CrO 42=浓度降低,Ag 2CrO 4出现过迟,滴定终点拖后。
(2)用佛尔哈德法测定Cl -,既没有将AgCl 沉淀滤去或加热使其凝聚,又没有加有机溶剂。
答:偏高;由于AgCl 的溶解度比AgSCN 大,当剩余的Ag +被滴定完毕后,过量的SCN -将与AgCl 发生沉淀转化AgCl +SCN -= AgSCN +Cl -,使本应产生的红色不能及时出现,造成终点拖后。
(3)同(2)的条件下测定Br -。
答:无影响;由于AgBr 的溶解度小于AgSCN ,滴定Br -时,不存在上述情况。
(4)用法扬司法测定Cl -,曙红作指示剂。
答:偏低;由于沉淀对曙红吸附能力大于对Cl -的吸附能力。
曙红离子在化学计量点前即取代被吸附的待测离子而使溶液变色。
终点提前。
(5)用法扬司法测定I -,曙红作指示剂。
答:无影响。
5.称取NaCl 基准试剂0.1173g ,溶解后加入30.00mLAgNO 3标准溶液,过量的Ag +需要3.20mLNH 4SCN 标准溶液滴定至终点,已知20.00mL AgNO 3溶液与21.00mL NH 4SCN 标准溶液完全反应,计算AgNO 3和NH 4SCN 溶液的浓度各为多少?解:加入的AgNO 3与NaCl 反应,剩余的与NH 4SCN 反应3430.020000.11730.0032058.440.021000.03000AgNO NaCl NH SCNAgNO AgNOc n n c V ⨯+⨯+==30.07447/AgNO c mol L =334420.000.074470.07092(/)21.00AgNO AgNO NH SCN NH SCNc V c mol L V ⨯===6.移取NaCl 试液20.00mL ,加入K 2CrO 4指示剂,用0.1023mol/L AgNO 3标准溶液滴定用去27.00mL ,求每升溶液中含有NaCl 若干克?解:题意可知 Cl -+Ag + = AgCl0.10230.0270058.448.071(/)20.001000NaCl g L ⨯⨯==7.称取银合金试样0.3000g ,溶解后加入铁铵矾指示剂,用0.1000mol/L NH 4SCN 标准溶液滴定,用去23.80mL ,计算银的质量分数。

第八章沉淀滴定法第一节概述沉淀滴定法(precipation titration)又称容量沉淀法(volumetric precipation method)是以沉淀反应为基础的滴定方法。
沉淀反应很多,但能用作沉淀滴定的沉淀方法并不多,应用于沉淀滴定的反应必须满足滴定分析反应的基本条件,为使反应定量完成,对沉淀反应而言沉淀的溶解度必须足够小(约10-6g/ml)。
用于沉淀滴定法的反应,主要是生成难溶性银盐的反应。
如:这种利用生成难溶性银盐反应来进行滴定分析的方法,称为银量法(argentometric method)。
本法可用于测定含Cl-、Br-、I-、SCN-及Ag+等离子的化合物。
本章主要讨论银量法的基本原理及应用。
第二节银量法一、基本原理银量法是用硝酸银标准溶液,测定能与Ag+生成沉淀的物质,它的反应是:其中X-代表Cl-、Br-、I-及SCN-等离子。
(一)滴定曲线沉淀滴定法在滴定过程中溶液中离子浓度的变化情况与酸碱滴定法相似,可用滴定曲线表示。
现以AgNO3溶液(0.1000mol/L)滴定20.00ml NaCl溶液(0.1000mol/L)为例。
1.滴定开始前:溶液中氯离子浓度为溶液的原始浓度[Cl-]=0.1000mol/L pCl=-lg1.000×10-1=1.002.滴定至化学计量点前随着硝酸银溶液的不断滴入,溶液中[Cl-]逐渐减小,此时溶液中氯离子浓度,取决于剩余的氯化钠的浓度。
例如加入AgNO3溶液18.00ml时,溶液中Cl-浓度为:而Ag+浓度则因为同理,当加入AgNO3溶液19.98ml时,溶液中剩余的Cl-浓度为(化学计量点前0.1%):[Cl-]=5.0×10-5pCl=4.30 pAg=5.513.化学计量点时溶液是AgCl的饱和溶液:4.化学计量点后当滴入AgNO3溶液20.02ml时(化学计量点后0.1%),溶液的Ag+浓度由过量的AgNO3浓度决定。
表7-1列出不同滴定百分数的pAg值,其滴定曲线如因7-1所示。
图中亦同时作出0.1000mol/L AgNO3滴定同浓度的NaBr的滴定曲线。
由滴定曲线可说明:(1)pX与pAg两条曲线以化学计量点对称。
这表明随着滴定的进行,溶液中Ag+浓度增加时,X-以相同的比例减小;而化学计量点时,两种离子浓度相等,即两条曲线在化学计量点相交。
(2)与酸碱滴定曲线相似,滴定开始时溶液中X-浓度较大,滴入Ag+所引起的X-浓度改变不大,曲线比较平坦,近化学计量点时,溶液中X-浓度已很小,再滴入少量Ag+即引起X-浓度发生很大变化而形成突跃。
(3)滴定突跃的大小与溶液的浓度有关,溶液浓度越大,突跃范围越大(图7-2),若浓度增大(减小)10倍,滴定突跃的pAg范围增加(减小)2个单位;滴定突跃的大小同时更取决于沉淀的溶解度:在浓度均为0.1mol/L时,AgNO3滴定NaCl(Ksp(AgCl)=1.56×10-10)的滴定突跃为 1.2单位(pAg 5.5→4.3);AgNO3滴定NaBr(Ksp(AgBr)=5.0×10-13)的滴定突跃则是3.7单位(pAg 8.0→4.3)。
而AgNO3滴定NaI(Ksp(AgI)=1.5×10-16)的滴定突跃则是7.2单位(pAg=11.5→4.3),所以相同浓度的Cl-、Br-和I-与Ag+的滴定曲线上,突跃范围是I-的最大Cl-的最小,此表明溶度积常数愈小,突跃范围愈大。
(图7-3)(二)分步滴定溶液中如同时含有Cl-、Br-和I-时,由于AgI、AgBr、AgCl的溶度积差别较大,当浓度差别不太大时,可利用分步沉淀的原理,用AgNO3溶液连续滴定,测出它们各自的含量。
溶度积最小的AgI 将最先沉淀,AgCl最后析出。
在滴定曲线上显示三个突跃,但由于卤化银沉淀的吸附和生成混晶的作用,常会引起误差。
二、指示终点的方法沉淀滴定法终点的确定按指示剂作用原理的不同分为三种情况:形成有色沉淀、形成有色配合物、指示剂被吸附而引起沉淀颜色的改变。
根据所用指示剂的不同,按创立者的名字命名,银量法分为三种方法,分别介绍于下。
(一)莫尔法—铬酸钾指示剂法1.基本原理莫尔(Mohr)法是用K2Cr2O4为指示剂,在中性或弱碱性溶液中,用AgNO3标准溶液直接滴定Cl-(或Br-)。
根据分步沉淀的原理,由于AgCl的溶解度(1.8×10-3g/L)小于Ag2CrO4的溶解度(2.3×10-2g/L)故在滴定过程中AgCl首先沉淀出来,而[Ag+]2[CrO42-]<Ksp(Ag2CrO4),不能形成Ag2CrO4沉淀。
随着AgCl析出,溶液中Cl-浓度下降,Ag+浓度上升,当[Ag+]2[CrO42-]>Ksp(Ag2CrO4)时,析出砖红色的Ag2CrO4的沉淀。
当AgCl实际沉淀完全后,稍过量一点硝酸银溶液即与CrO42-反应生成砖红色的铬酸银沉淀,从而指示滴定终点的到达。
其滴定反应为:2.滴定条件(1)指示剂的用量要适当:理论上,在化学计量点时此时若恰能生成Ag2CrO4沉淀,则所需的CrO42-的浓度为:在实际测定时,通常在反应液总体积为50~100ml的溶液中,加入5%(g/ml)铬酸钾指示剂约1~2ml,此时[CrO42-]约为2.6×10-3mol/L~5.2×10-3mol/L。
(2)在中性或弱碱性溶液中进行滴定:若在酸性介质中,CrO42-将与H+作用生成Cr2O72-,溶液中[CrO42-]将减小,Ag2CrO4沉淀出现过迟,甚至不会沉淀。
但若碱度过高,又将出现Ag2O沉淀。
莫尔法测定的最适宜pH范围是6.5~10.5。
若溶液碱性太强,可先用稀HNO3中和至甲基红变橙,再滴加稀NaOH至橙色变黄;若酸性太强,则用NaHCO3、CaCO3或硼砂中和。
(3)滴定溶液中不应含有氨:若溶液中有NH3存在,可使AgCl和Ag2CrO4形成[Ag(NH3)2]+配离子而溶解。
在有NH3存在时应当先用HNO3中和,当有铵盐存在时,滴定的pH范围应控制在6.5~7.2之间。
(4)莫尔法能测Cl-、Br-但不能测定I-和SCN-:因为AgI与AgSCN沉淀有较强的吸附作用,使终点过早出现,且终点变化不明显。
(5)莫尔法的选择性较差:凡能与CrO42-或Ag+生成沉淀的阳、阴离子均干扰滴定,前者如Ba2+、Pb2+、Hg2+、Bi3+等;后者如SO42-、PO43-、AsO43-、S2-、C2O42-、CO32-等。
大量的有色离子Cu2+、Co2+、Ni2+等,以及在中性或碱性溶液中易发生水解的离子,如Fe3+、A13+等干扰测定,应预先分离。
一般氯化物、溴化物的纯度测定以及天然水中氯含量的测定都可采用莫尔法,方法简便、准确。
(二)佛尔哈德法—铁铵矾指示剂法1.基本原理用铁铵矾[NH3Fe(SO4)2]作指示剂的银量法称佛尔哈德(V olhad)法,此法包括直接滴定和回滴法两种方法。
(1)直接滴定法:在HNO3介质中,以铁铵矾为指示剂,用NH4SCN标准溶液滴定Ag+。
当AgSCN 定量沉淀后,稍过量的SCN-与Fe3+生成的红色配合物可指示终点的到达。
其反应是:(2)回滴法:在含有卤素离子的HNO3溶液中,加入一定量过量的AgNO3标准溶液,然后以铁铵矾为指示剂,用NH4SCN标准溶液回滴过量的AgNO3。
滴定反应为:2.滴定条件(1)应当在酸性介质中进行,一般酸度(HNO3)大于0.3mol/L,若酸度过低,Fe3+将水解形成[FeOH]2+……等深色配合物,影响终点观察。
碱度再大还会析出Fe(OH)3沉淀。
由于滴定是在HNO3介质中进行,许多弱酸盐如PO43-、AsO43-、S2-、CO32-等都不干扰卤素离子的测定。
因此,此法选择性较高。
(2)用直接滴定法滴定Ag+时,要充分振荡,使被沉淀吸附的Ag+解吸,防止终点提前。
(3)用回滴法测定氯化物时,需先将已生成的AgCl沉淀滤去,再用NH4SCN标准溶液滴定滤液;或者在回滴前向待测试液中加入1~3ml硝基苯或异戊醇,并用力振摇,使有机溶剂将AgCl沉淀包住,使它与溶液隔开。
这就阻止了SCN-与AgCl发生沉淀转化反应。
由于转化反应使溶液中SCN-浓度降低,促使已生成的FeSCN2+又分解,使红色褪去。
要想得到持久的红色,就必须继续滴加NH4SCN直至达到平衡。
这样在化学计量点后又多消耗一部分标准溶液,因而造成较大的滴定误差。
(4)用回滴法测定碘化物时,必须先加AgNO3后加指示剂,否则会发生如下反应影响结果的准确度:(三)法扬斯法—吸附指示剂法1.基本原理用吸附指示剂指示终点的银量法称为法扬斯(Fajans)法。
吸附指示剂是一些有机染料,它们的阴离子在溶液中容易被带正电荷的胶状沉淀所吸附,吸附后结构变形而引起颜色变化,从而指示滴定终点。
例如,用AgNO3标准溶液滴定Cl-时,用荧光黄作指示剂。
后者是一种有机弱酸(用HFl表示),在溶液中离解为黄绿色的阴离子Fl-。
在化学计量点前,溶液中Cl-过量,这时AgCl沉淀胶粒吸附Cl-而带负电荷,Fl-受排斥而不被吸附,溶液呈黄绿色;而在化学计量点后,加入稍过量的AgNO3,使得AgCl沉淀胶粒吸附Ag+而带正电荷。
这时,溶液中Fl-被吸附,溶液由黄绿变为粉红色,指示终点到达。
此过程可示意如下:终点前,Cl-过量时:终点时,Ag+稍过量时:吸附指示剂种类很多,现将常用的几种列于表7-2中。
2.滴定条件为了使终点颜色变化明显,应用吸附指示剂时要注意以下几点:(1)由于颜色的变化发生在沉淀表面,欲使终点变色明显,应尽量使沉淀的比表面大一些。
为此,在滴定前应将溶液稀释,也可加入一些糊精、淀粉等亲水性高分子物质,使卤化银保持胶体状态,并避免大量中性盐存在,以防止卤化银凝聚。
但应注意溶液太稀时,生成的沉淀少,终点变化不明显,此法不宜使用。
(2)溶液的酸度要适当,常使用的吸附指示剂大多是有机弱酸,而起指示作用的主要是阴离子。
为使指示剂呈阴离子状态,必须控制适当的酸度。
对于K a较小(酸性较弱)的吸附指示剂,滴定溶液的pH要高些;而对于K a较大的吸附指示剂,则滴定溶液可允许有较低的pH值。
例如,荧光黄的K a =10-8,可在pH7~10的中性或弱酸性条件下使用;二氯荧光黄的K a=10-4,可用于pH为4~10的溶液;曙红的K a为10-2,则可用在pH2~10的溶液中。
(3)胶体微粒对指示剂离子的吸附能力应略小于对被测离子的吸附能力。
即滴定稍过化学计量点时,胶位就立即吸附指示剂离子而变色。
否则在计量点之前,指示剂离子取代了被测离子,使终点提前出现。
如果对指示剂离子吸附的能力太弱,则滴定到达化学计量点后不能立即变色。