金属的化学性质(讲义)
- 格式:doc
- 大小:142.50 KB
- 文档页数:7



《金属的化学性质》讲义在我们的日常生活和工业生产中,金属无处不在。
从建筑结构中的钢材,到电子设备中的各种金属元件,再到厨房中的锅碗瓢盆,金属的应用广泛而多样。
要深入理解金属的用途和性能,就必须了解它们的化学性质。
首先,让我们来谈谈金属与氧气的反应。
大多数金属在一定条件下都能与氧气发生反应。
比如,铁在空气中生锈,这是铁与氧气、水分共同作用的结果。
而生锈后的铁制品会变得脆弱,强度下降。
铝是一种比较特殊的金属,它在空气中能迅速与氧气反应,形成一层致密的氧化铝保护膜,阻止内部的铝继续被氧化。
所以,铝制品在空气中具有较好的耐腐蚀性。
金属与酸的反应也是一个重要的化学性质。
活泼金属如锌、镁、铁等能与稀盐酸、稀硫酸发生反应,产生氢气。
例如,锌与稀硫酸反应的化学方程式为:Zn + H₂SO₄= ZnSO₄+ H₂↑。
这个反应在实验室中常用于制取氢气。
但需要注意的是,像铜这样的不活泼金属则不能与稀盐酸、稀硫酸发生反应。
金属与盐溶液的反应同样具有重要意义。
在金属活动性顺序中,位置靠前的金属能够把位于其后的金属从它们的盐溶液中置换出来。
比如,铁能把硫酸铜溶液中的铜置换出来,反应的化学方程式为:Fe +CuSO₄= FeSO₄+ Cu。
这个反应在古代就被用于湿法炼铜。
金属的活动性顺序是判断金属化学性质的重要依据。
常见金属的活动性顺序为:钾、钙、钠、镁、铝、锌、铁、锡、铅、(氢)、铜、汞、银、铂、金。
在这个顺序中,排在氢前面的金属能置换出酸中的氢,而排在后面的则不能。
同时,前面的金属能够置换出后面金属的盐溶液中的金属。
了解金属的化学性质对于金属的冶炼也非常重要。
通过不同的化学反应,可以从金属矿石中提取出纯金属。
例如,用一氧化碳还原氧化铁来冶炼铁,化学方程式为:3CO + Fe₂O₃高温 2Fe + 3CO₂。
在金属的防护方面,利用金属的化学性质能起到很好的效果。
比如,通过在金属表面涂漆、镀上一层不易被氧化的金属等方法,可以防止金属被腐蚀。



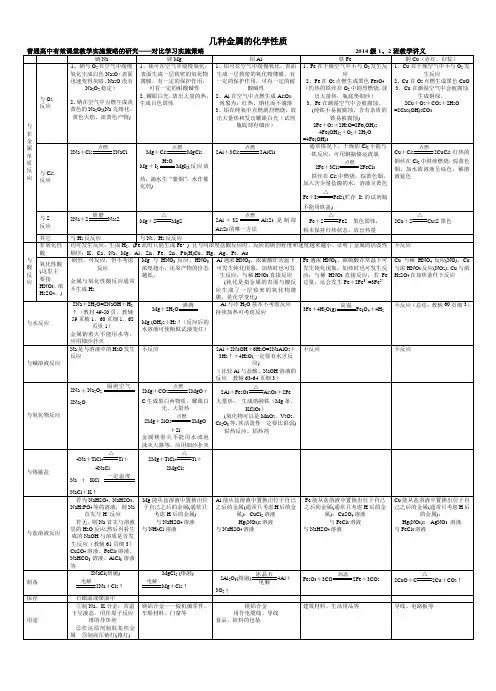
课题2 金属的化学性质(上)知识导航知识精讲一、金属与氧气反应1. 常温下反应金属方程式现象Al银白色的铝的表面逐渐变暗,生成一层致密的薄膜Mg银白色的镁条在空气中表面会逐渐变暗,生成白色固体2. 高温下反应金属方程式现象Fe剧烈燃烧,火星四射,放出大量热,有黑色固体生成Mg发出白光,放出大量的热,生成白色固体Cu生成黑色固体3. 金即使在高温下,也不跟氧气反应。
4. 金属活动性由强到弱的顺序:镁、铝比较活泼,铁、铜次之,金最不活泼。
补充说明二、金属与酸反应金属 与稀盐酸/稀硫酸反应的现象 反应速度 反应方程式镁 剧烈反应,镁逐渐溶解,产生大量气泡 很快 Mg + 2HCl === MgCl 2 + H 2↑ Mg + H 2SO 4=== MgSO 4 + H 2↑ 锌 反应比较剧烈,锌逐渐溶解,产生大量气泡 较快 Zn +2HCl === ZnCl 2 +H 2↑ Zn + H 2SO 4 === ZnSO 4 +H 2↑ 铁 反应缓慢,铁逐渐溶解,有气泡生成,溶液由无色逐渐变为浅绿色较慢Fe+2HCl === FeCl 2+ H 2↑ Fe+ H 2SO 4 === FeSO 4+H 2↑铜不反应【实验结论】①能与稀盐酸、稀硫酸反应的金属有____________,不能与稀盐酸、稀硫酸反应的金属有____________。
②金属的活动性由强到弱的顺序:___________________。
补充说明——金属与酸反应速率快慢的影响因素① 常温下,铝和氧气能发生反应,生成一层致密的氧化铝薄膜,可以阻止铝进一步被氧化,所以铝具有很好的抗腐蚀性。
② 铝能被广泛应用,与它的抗腐蚀性能好有很大的关系。
③ 人类对金属的利用顺序,与其活动性有关。
①金属活动顺序:活动性强的金属和酸反应的速率更快。
(在图像中,斜率越大,反应速率越快,金属活动性越强)②金属的状态:其他条件相同时,粉末状金属比块状金属反应速率更快。



《金属的化学性质》讲义一、金属与氧气的反应在我们日常生活中,金属制品随处可见,从厨房的锅碗瓢盆到建筑中的钢梁铁柱。
而金属与氧气的反应是金属化学性质中一个重要的方面。
许多金属在常温下就能与氧气发生反应。
比如,铝在空气中就能与氧气形成一层致密的氧化铝保护膜,阻止内部的铝进一步被氧化。
这层氧化铝薄膜使得铝具有良好的抗腐蚀性。
铁在潮湿的空气中容易生锈,铁锈的主要成分是氧化铁。
相比之下,铜在空气中加热时,表面会逐渐变黑,生成黑色的氧化铜。
金属与氧气反应的难易程度和剧烈程度,可以反映出金属的活泼性。
一般来说,越活泼的金属,与氧气反应就越容易、越剧烈。
例如,钾、钠等非常活泼的金属,在常温下就能迅速与氧气反应,甚至在空气中就能燃烧。
二、金属与酸的反应金属与酸的反应也是常见的化学现象。
活泼金属如锌、镁、铁等能与稀盐酸或稀硫酸发生反应,产生氢气。
以锌与稀硫酸反应为例,化学方程式为:Zn + H₂SO₄= ZnSO₄+H₂↑ 。
反应过程中,我们会观察到有气泡产生。
但并不是所有的金属都能与酸发生反应。
在金属活动性顺序表中,排在氢后面的金属,如铜、银等,通常不能与稀盐酸或稀硫酸发生反应。
通过金属与酸反应的剧烈程度,我们也可以判断金属的活动性强弱。
反应越剧烈,说明金属越活泼。
三、金属与盐溶液的反应金属与盐溶液之间的反应也是金属化学性质的重要表现。
例如,铁能与硫酸铜溶液发生反应,将铜从硫酸铜溶液中置换出来,化学方程式为:Fe + CuSO₄= FeSO₄+ Cu 。
我们可以观察到溶液颜色的变化以及有红色固体析出。
在金属活动性顺序中,位于前面的金属能够把位于后面的金属从它们的盐溶液中置换出来。
但要注意,钾、钙、钠这三种金属由于性质太过活泼,一般不能直接从盐溶液中置换出其他金属。
四、金属活动性顺序为了更好地比较和总结不同金属的化学性质,我们有了金属活动性顺序:钾、钙、钠、镁、铝、锌、铁、锡、铅、(氢)、铜、汞、银、铂、金。
这个顺序对于我们判断金属之间的置换反应能否发生以及预测金属与其他物质的反应情况非常重要。
金属的化学性质(讲义)
➢知识点睛
1.金属与酸反应
(1)图象问题
①氢气质量与反应时间的关系
a.等质量的镁、铝、锌、铁和足量的酸反应(图1),金属反应完,酸
有剩余,生成氢气的质量不等,产生氢气的质量由多到少为:____、
____、____、____,产生氢气由快到慢为____、____、____、____。
b.足量的镁、铝、锌、铁和等量的酸反应(图2),酸反应完,金属有剩余,生成氢气的质量相等,消耗金属的质量由少到多为:____、
____、____、____,产生氢气由快到慢为____、____、____、____。
注:上述四种金属的产氢能力由强到弱为:____、____、____、____。
✧此类图象重点关注产生氢气的快慢与多少。
②氢气质量与反应物质量的关系
a.向等质量的镁、铝、锌、铁中加入足量酸(图3),最初酸不足,等质量的酸参与反应,产生氢气的质量相等,最终酸过量,金属不足,
产生的氢气质量不等,产生氢气的质量由多到少为:___、___、
___、___。
b.向等质量的酸中加入足量的镁、铝、锌、铁(图4),最初金属不足,等质量的金属参与反应,产生氢气的质量不等,产生氢气的质量由
到多少为:___、___、___、___,最终酸不足,产生的氢气质量相等。
注:通过图象能比较产生氢气的多少,不能比较产生氢气的快慢。
✧此类图象重点关注最初产生氢气的多少与最终产生氢气的多少。
(2)判断混合物组成问题
①平均值法
计算出金属混合物的平均相对原子质量Ar,利用平均值法,推测金
属混合物的成分(将Al的相对原子质量折算成18,氢后金属的相
对原子质量折算成无穷大)。
A r(A)<Ar< A r(B)
②极端假设法
假设金属混合物中只含已知的该金属,计算此时应产生的氢气质量,
比较其与实际产生的氢气质量的大小关系,根据金属产氢能力,推
测金属混合物的成分。
2.金属与盐溶液反应
(1)金属与盐溶液反应后,判断滤渣、滤液成分
①对涉及到的金属进行活动性排序,标出加入的金属,判断反应的先
后顺序。
【注:在金属活动性顺序表中,活动性相差较大的金属之间,
先发生置换反应。
】
②画流程图,根据加入金属的量初步判断滤渣、滤液成分。
③根据题中信息,结合反应先后顺序,再次判断滤渣、滤液成分。
(2)回收废液中的金属和金属化合物
根据待回收的金属和金属化合物,初步判断加入的过量金属(一般为
所涉及金属中最活泼的),再分析各环节的化学反应和物质组成。
➢精讲精练
1.相同质量的Zn和Fe分别与足量等浓度的稀硫酸反应,能正确表示生成氢气
的质量与时间关系的图象是()
A.B.
C.D.
2.相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与加入稀盐
酸的体积关系如下图所示,其中正确的是()
A.B.
C.D.
3.等质量的镁、铁、锌分别放入足量的等质量、等浓度的稀盐酸中,产生氢气
的质量与消耗金属的质量之间的关系正确的是()
A.B.
C.D.
4.相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气质量
(直接用各金属表示)的大小关系有以下几种猜测:①Mg>Al>Zn;
②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;
⑥Al>Mg=Zn。
其中合理的个数为()
A.5个B.4个C.3个D.2个
5.现有
6.5 g由Zn和另一种金属组成的混合物,将其加入足量的稀盐酸中充分
反应得到0.18 g氢气,则另一种金属可能是()
A.Ag B.Al C.Fe D.Mg
6.某不纯的铁2.4 g与足量的盐酸反应,全部溶解,放出氢气0.2 g,则铁中可
能含有的杂质是()
A.铜B.铝C.碳D.镁
7.现有铁和另一种金属组成的混合物,在5.6 g该混合物中加入100 g一定溶质
质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m。
下列说法正确的是()
A.若混合物为Fe、Al,m可能是0.2 g
B.若混合物为Fe、Zn,m可能是0.1 g
C.若混合物为Fe、Cu,则m可能是0.1 g,该混合物中铁的质量分数为50% D.若混合物为Fe、Zn,则稀盐酸中溶质的质量分数一定大于7.3%
8.现有FeSO4和CuSO4的混合溶液,向其中投入一定量的锌粉,充分反应后过
滤,向滤渣中加入适量稀硫酸。
(1)若滤渣中有气泡产生,则滤渣中一定有__________(填化学式,下同),滤液中一定没有__________________。
(2)若滤渣中无气泡产生,则滤渣中一定没有__________,滤液中一定有__________________。
9.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得
到滤渣和浅绿色滤液。
则滤渣中一定含有______(填化学式,下同),可能含有______,滤液中一定含有____________,可能含有____________。
10.某同学向一定量的硝酸银、硝酸铜和硝酸铝的混合溶液中逐渐加入锌粒。
溶
液质量与加入锌的质量关系如图所示。
(1)写出a~b段发生反应的化学方程式。
(2)b点时,溶液中的金属阳离子有____________________(写离子符号)。
(3)写出b~c段发生反应的现象。
11.某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处
理,并绘制出参加反应的铁的质量与溶液中溶质种类的关系图。
请回答:
(1)a点时,混合物中所含的金属单质为___________(填化学式)。
(2)a、b两点,溶液的质量a_____b(填“=”、“<”或“>”)。
(3)请写出c~d段发生反应的化学方程式。
12.某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成
本,回收重要原料硫酸锌和有关金属,设计了下图所示流程。
请回答:
(1)步骤①的操作是________,步骤③使用的方法是_____________(填“物理方法”或“化学方法”)。
(2)固体A的成分是_________,固体B的成分是____________________。
(3)步骤④中反应的化学方程式为_________________________________。
13.为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验。
14.
15.(1)X为________;乙与硝酸钡反应的化学方程式为___________________
_______________________________。
(2)操作I和Ⅱ中都要用到一种玻璃仪器。
该仪器在操作Ⅱ中的作用是什么?
【参考答案】
➢知识点睛
1.(1)①Al、Mg、Fe、Zn Mg、Al、Zn、Fe
Al、Mg、Fe、Zn Mg、Al、Zn、Fe
Al、Mg、Fe、Zn
②Al、Mg、Fe、Zn Al、Mg、Fe、Zn
➢精讲精练
1. D
2. D
3. B
4. C
5. A
6. B
7. C
8.(1)Cu、Fe CuSO4
(2)Fe、Zn ZnSO4、FeSO4
9.Ag Fe Al(NO3)3、Fe(NO3)2AgNO3
10.(1)2AgNO3+Zn Zn(NO3)2+2Ag
(2)Al3+、Zn2+、Cu2+
(3)锌粒表面有红色固体析出,溶液由蓝色逐渐变为无色
11.(1)Ag
(2)>
(3)Cu(NO3)2+Fe Fe(NO3)2+Cu
12.(1)过滤物理方法
(2)ZnSO4Zn、Cu、Fe
(3)Zn+H2SO4ZnSO4+H2↑
13.(1)锌ZnSO4+Ba(NO3)2BaSO4↓+Zn(NO3)2
(2)蒸发时用玻璃棒不断搅拌,防止因局部温度过高造成液滴飞溅。
1.已知:如图,在矩形ABCD中,AB=10,AD=5,将矩形ABCD折叠,使点C
落在边AB上的E处,折痕交DC边于点M,点F在DM上运动,当△AEF 是腰长为5的等腰三角形时,EF的长为_______________.
M F E D C B A
【参考答案】
1.
或5。