化学反应反应热的计算
- 格式:ppt
- 大小:319.50 KB
- 文档页数:42

反应热的计算公式反应物减生成物自古以来,反应热就是许多化学过程的重要参数。
它既可以描述化学反应的活力,也可以预测反应的最终产物。
反应热可以用一个简单的计算公式来表示,其中反应物明确表示出来,而生成物则经过计算获得。
今天,我们着重来讨论这个计算公式如何用来计算反应物中应减少哪些物质以得到反应最终产物。
反应热计算公式说明,可以用反应物减去生成物来计算反应热。
首先,我们必须确定反应物和生成物的分子量,并确定反应的终点温度。
然后,将反应物的分子量乘以反应的最终温度,并减去生成物的分子量乘以反应的最终温度,就可以得到反应的热量。
可以将这个热量乘以反应的物质的总量即可得到反应的热量。
例如,当碱性氰化物反应时,反应物氰化物和氢氧化钠的分子量分别为62.03和40.02,反应的终点温度为25℃。
此时可以计算出反应的热量:62.03×25 - 40.02×25 = 1562.75J/mol。
这就是反应的热量。
这个计算公式也可以用来计算加热的量,如果有足够的反应物,反应的热量将会改变反应的最终产物,反应物中需要减少的物质也就清楚了。
可以将反应物中需要减少的物质乘以反应物的热量来计算需要减去的物质量。
例如,一个反应物中氯氧化钠的分子量为58.44,碱性氰化物的分子量为62.03,反应的最终温度为52℃,根据上述计算公式,可以计算出反应热量为-4381.12J/mol。
那么,如果将此反应中的氯氧化钠减少1 mol,则反应热量将减少58.44×(-4381.12)=-255.99kJ。
这样一来,就可以知道反应物中应减少多少物质以得到反应最终产物。
反应热的计算公式是一个强有力的工具,它能够帮助我们更加准确地预测化学反应的结果,还可以确定反应物中应减少哪些物质以得到反应最终产物。
它对预测反应产物的积极作用,也有助于调节反应的活性。
因此,反应热的计算公式受到化学工程师的高度重视,在许多反应中都得到了广泛的应用,从而让反应过程更加安全、精确、有效。

化学反应的反应热计算与应用化学反应的反应热计算是物理化学领域中的一个重要概念。
它描述了在化学反应中释放或吸收的能量,也被称为反应热或热变化。
反应热的计算对于理解化学反应的性质和应用是至关重要的。
本文将讨论反应热计算的基本原理,应用以及与实际生活中的相关问题。
一、反应热计算的基本原理反应热计算基于热力学第一定律,即能量守恒定律。
根据这一定律,一个化学反应中释放或吸收的能量可以通过测量反应前后系统的热量变化来确定。
反应热可以用以下公式表示:ΔH = q/m其中,ΔH表示反应热,q表示反应中释放或吸收的热量,m表示反应物的摩尔数。
反应热的单位通常是焦耳/摩尔(J/mol)或千焦/摩尔(kJ/mol)。
二、反应热计算的应用1. 确定反应类型反应热的正负值可以帮助我们确定反应类型。
当反应热为正值时,表示反应是吸热反应,即在反应中吸收了能量;当反应热为负值时,表示反应是放热反应,即在反应中释放了能量。
2. 评估燃烧热反应热计算可以用于评估燃烧过程中释放的热量。
许多化学燃料,如煤、油和天然气等,会在燃烧过程中释放能量。
通过测量燃料的反应热,可以确定其单位质量或摩尔质量所释放的能量。
3. 预测反应热反应热计算还可以用于预测尚未进行实验的反应的热量变化。
通过已知反应的热量变化和已知反应物的摩尔数,可以推断出其他反应的热量变化。
这对于研究新材料的合成和化学工艺的改进非常有用。
三、反应热计算的案例分析1. 燃烧反应的反应热计算以甲烷燃烧反应为例,根据反应方程式CH4 + 2O2 → CO2 + 2H2O,我们可以计算反应热。
根据实验数据,甲烷燃烧反应释放的热量为-802.5 kJ/mol。
这意味着每摩尔甲烷在燃烧过程中释放了802.5千焦的热量。
2. 反应热与温度变化的关系反应热与温度变化之间存在一定的关系。
根据热力学第二定律,当温度升高时,放热反应的反应热减小,吸热反应的反应热增加。
根据这一关系,可以通过测量反应的温度变化来估计其反应热。





化学反应热的计算一、盖斯定律1. 内容:不管化学反应是一步完成还是分几步完成,其反应热 是相同的。
如图 1-15所示:12H H H ∆=∆+∆,345H H H H ∆=∆+∆+∆。
盖斯定律是质量守恒定律和能量守恒定律的共同体现。
2.对盖斯定律的理解:① 途径角度;② 能量守恒角度由于在指定的状态下,各种物质的焓值都是确定且唯一的,因此无论经过哪些步骤从反应物变成产物,它们的差值是不会改变的。
说明:能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主。
3.意义:应为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应的反应热造成了困难。
此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来。
说明:利用盖斯定律应注意以下几点:a.一个热化学方程式中分子式前的化学计量数同时扩大一定的倍数时,焓变也相应地扩大相同的倍数。
b.若将一个热化学方程式中的反应物与生成物颠倒,则焓变的正负号也相应地改变。
c.若热化学方程式相加,则焓变也相加;若热化学方程式相减,则焓变也相减。
4.方法技巧拓展常用的有关反应焓变的简答计算的方法归类:⑴ 根据热化学方程式进行计算:焓变(△H)与反应物各物质的物质的量成正比。
⑵ 根据反应物和生成物的能量计算:△H = 生成物的能量之和 — 反应物的能量之和。
⑶ 根据反应物和生成物的键量计算:△H = 生成物的总键量 — 反应物的总键量。
⑷ 根据盖斯定律计算:a.根据盖斯定律的实质,分析给定反应与所求反应物质与焓变关系。
b.运用解题技能,将已知热化学方程式进行变换、加减得到待求反应的热化学方程式。
⑸ 根据比热容和温度差进行计算:21()Q c m T T =-⋅⋅-。
⑹ 根据燃烧热、中和热计算:可燃物完全燃烧放出的热量 = n(可燃物) × 其燃烧热中和反应放出的热量 = n(H 2O) × 中和热5.应用盖斯定律求反应热通常用两种方法:⑴ 虚拟路径法:如:C(s) + O 2(g) ==== CO 2(g)可设计为:⑵ 加减法:确定目标方程式后,以每一步反应的中间产物为桥梁对方程式进行化学计量数调整、加减,消去中间产物,得到目标方程式,H ∆也做相应的调整和加减运算,即得到目标方程式的H ∆。

化学反应热的测定与计算方法化学反应热,指的是在化学反应中释放或吸收的能量。
准确测定和计算化学反应热对于研究化学反应的特性和速率,以及确定热力学参数等具有重要意义。
本文将介绍一些常见的化学反应热测定和计算方法。
一、燃烧法测定燃烧法是测定化学反应热的常用方法之一。
其原理是将待测物质完全燃烧,在封闭的容器中释放的热量与反应物质的燃烧热相等。
具体实验操作中,可以将待测物质与过量的氧气一同放置在一个容器中进行反应,通过测量容器内温度变化来计算反应热。
二、恒温搅拌法测定恒温搅拌法是一种通过测量反应溶液的温度变化来计算化学反应热的方法。
在这种方法中,反应溶液被放置在恒温搅拌器中,反应前后溶液温度的变化被记录下来。
通过根据热容和溶液的质量来计算反应热。
三、量热仪法测定量热仪法是一种非常精确的测定化学反应热的方法。
该方法利用专业的量热仪来测量反应体系的热变化。
量热仪能够精确地测量热量的吸收和释放,通过测量样品与热计的温度变化,并结合热容值和实验组分计算出化学反应的热变化。
这种方法通常被用于测定高温、高压以及危险性较大的反应。
四、计算方法当实验测定不可行时,可以通过计算方法来估算化学反应热。
常见的计算方法包括基于物质的相关物理性质以及反应物阳离子和阴离子键合能力的理论方法。
这些计算方法虽然不太精确,但在无法进行实验测定时提供了一种解决方案。
总的来说,化学反应热的测定与计算方法因反应体系的不同而有所不同。
燃烧法和恒温搅拌法适用于一部分化学反应,而量热仪法则可以应用于更广泛的反应。
当实验不可行时,可以通过计算方法对反应热进行估算。
这些方法的应用使得我们能够更深入地研究化学反应的性质和特性,为我们进一步探索化学世界提供了有力的工具。

第三节 化学反应热的计算[知 识 梳 理]一、盖斯定律 1.内容不论化学反应是一步完成还是分几步完成,其反应热是相同的(填“相同”或“不同”)。
2.特点(1)反应的热效应只与始态、终态有关,与途径无关。
(2)反应热总值一定,如下图表示始态到终态的反应热。
则ΔH =ΔH 1+ΔH 2=ΔH 3+ΔH 4+ΔH 5。
(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
【自主思考】已知H 2(g)+12O 2(g)===H 2O(g) ΔH =-241.8 kJ/mol ,而H 2O(g)―→H 2O(l) ΔH =-44.0 kJ/mol ,请问若1 mol H 2和12 mol O 2反应生成液态水,放出的热量是多少? 提示 Q =(241.8 kJ/mol +44 kJ/mol)×1 mol =285.8 kJ 。
二、反应热的计算 1.主要依据热化学方程式、键能、盖斯定律及燃烧热等数据。
2.主要方法(1)依据热化学方程式:反应热的绝对值与各物质的物质的量成正比,依据热化学方程式中的ΔH求反应热,如(2)依据盖斯定律:根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式,同时反应热也作相应的改变。
(3)依据反应物断键吸收热量Q吸与生成物成键放出热量Q放进行计算:ΔH=Q吸-Q。
放(4)依据反应物的总能量E反应物和生成物的总能量E生成物进行计算:ΔH=E生成物-E。
反应物(5)依据物质的燃烧热ΔH计算:Q放=n可燃物×|ΔH|。
(6)依据比热公式计算:Q=cmΔt。
[效果自测]1.判断正误,正确的画“√”,错误的画“×”。
(1)同温同压下,氢气和氯气分别在光照条件下和点燃的条件下发生反应时的ΔH 不同。
()(2)对于放热反应,放出的热量越多,ΔH就越大。
()(3)2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1,ΔH=-571.6 kJ·mol-1的含义是指每摩尔该反应所放出的热量。

反应热的计算【考点精讲】反应热的计算是化学概念和化学计算的一个结合点。
反应热的大小与反应的条件、反应物、生成物的种类、状态及物质的量有关。
反应热计算的类型及方法:(1)根据热化学方程式计算:反应热与反应物的物质的量成正比。
(2)根据反应物和生成物的能量计算:ΔH=生成物的能量和-反应物的能量和。
(3)根据反应物和生成物的键能计算:通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能,键能通常用E表示,单位为kJ/mol或kJ·mol-1。
方法:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。
如反应H2(g)+Cl2(g)=2HCl(g)ΔH=E(H—H)+E(Cl—Cl)-2E(H—Cl)。
(4)根据盖斯定律计算:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
可以采用虚拟路径法或方程式加合法计算。
(5)根据物质的燃烧热数值计算:Q(放)=n(可燃物)×|ΔH|。
(6)根据比热公式进行计算:Q=cmΔt。
【典例精析】例题1 在一定条件下,甲烷与一氧化碳的燃烧的热化学方程式分别为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H =-890kJ/mol2CO(g)+O2(g)=2CO2(g)△H=-mol一定量的甲烷与一氧化碳的混合气完全燃烧时,放出的热量为kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50g白色沉淀。
求混合气体中甲烷和一氧化碳的体积比。
思路导航:由所给热化学方程式可知,甲烷与一氧化碳的燃烧热分别为890kJ/mol、283kJ/mol。
设混合气体中甲烷与一氧化碳的物质的量分别为x mol和y mol。
50g白色沉淀即的碳酸钙,由碳的守恒可知:x+y=两气体燃烧放出的热量可列等式:890x+283y=解得:x=y=故混合气体中甲烷和一氧化碳的体积比为2:3。
化学反应热的测定与计算方法在化学反应中,反应热是指反应过程中吸收或释放的能量。
测定反应热的准确与否对于研究化学反应的热力学性质、确定化学反应的特性以及工业生产等领域都具有重要意义。
本文将介绍几种常用的化学反应热的测定与计算方法。
一、常压条件下的反应热测定法常压条件下的反应热测定法主要通过观察反应过程中产生或吸收的热量来确定反应热。
其中常见的方法有:1. 定容量热量计法该方法使用热量计测量反应过程中所产生或吸收的热量。
首先,将反应溶液装入热量计中,记录初始温度并观察温度的变化。
然后,观察反应的物质消耗或生成情况,测量反应后的最终温度。
通过计算反应过程中温度的变化,结合物质的量来确定反应的热量。
2. 连续流动热量计法该方法通过将反应物连续引入热量计中,观察反应物混合过程中所释放或吸收的热量。
首先,在热量计中设置反应槽和热电偶温度探头。
然后,将反应物以恒定的流速引入反应槽中,并通过对输出温度信号的记录,计算反应过程中产生的热量。
二、恒压条件下的反应热测定法恒压条件下的反应热测定法主要通过测量化学反应过程中的温度变化和压力变化,来确定反应热。
其中常见的方法有:1. 恒焓法该方法使用燃烧热计测量恒压下的反应热。
首先,在恒压条件下将反应物燃烧,通过测定燃烧过程中产生的热量来计算反应热。
该方法适用于可以燃烧的物质反应的热量测定。
2. 蒸气量法该方法通过测量恒压条件下溶液中溶质的蒸气量的变化来确定反应热。
首先,将溶液注入恒温恒压器中,观察温度和压力的变化。
然后,通过以下公式计算反应热:ΔH = q/Δn其中,ΔH为反应热,q为吸附热,Δn为溶质的摩尔数差值。
三、反应热的计算方法反应热的计算方法主要通过热化学方程式和标准生成焓来计算。
具体步骤如下:1. 根据反应物和生成物,编写平衡化学方程式。
2. 根据平衡化学方程式,确定物质的量比。
3. 根据给定的反应物和生成物的标准生成焓,计算反应物和生成物的生成焓差。
4. 根据生成焓差,计算反应热。
化学反应热的计算【知识要点】利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算【知识回顾】1、计算焓变的两个公式⑴∆H=E(生,总)-E(反,总)⑵∆H=E(反应物断键总吸收能量)-E(生成物成键总放出能量)2、计算燃烧热:101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
3、盖斯定律:不管化学反应是一步完成或分几步完成,其反应热相同。
一、根据比例关系计算ΔH1、【例题1】25℃、101kPa时,使1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求:(1)生成1molNaCl的反应热。
(2)这个反应的热化学方程式。
【练习一】1、已知25℃、101kPa时,16gCH4完全燃烧放出890.3kJ热量,求:(1)燃烧48g CH4的反应热。
(2)这个反应的热化学方程式。
2、已知25℃、101kPa时,4gH2完全燃烧放出571.6kJ热量,求生成1molH2O(l)的反应热。
3、根据图1和图2,写出反应的热化学方程式。
图1 图2【例题2】乙醇的燃烧热ΔH=-1366.8kJ/mol,在25℃、101kPa时,1kg乙醇充分燃烧后放出多少热量?【练习二】1、已知石墨的燃烧热:△H=-393.5kJ/mol(1)写出石墨的完全燃烧的热化学方程式。
(2)在相同气压下,1kg石墨充分燃烧后放出多少热量?2、25℃、101kPa时,12g乙酸完全燃烧放出174.06kJ,写出乙酸燃烧的热化学方程式:3、葡萄糖是人体所需能量的重要来源之一。
葡萄糖燃烧的热化学方程式为:C 6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。
计算 100 g 葡萄糖在人体中完全氧化时所产生的热量。
4、在一定温度下,CO和CH4燃烧的热化学方程式分别为2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ/molCH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ/mol1 molCO和3 mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为()A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ【例题3】已知①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。
反应热标准生成焓
反应热是指化学反应在均压条件下所放出或吸收的热量,通常用ΔH表示。
标准生成焓是指在标准状况下,1摩尔物质生成过程中所放出或吸收的热量,通常用ΔH°f表示。
标准生成焓可以用来计算化学反应的反应热,其计算公式为:
ΔH = ∑nΔH°f(生成物) - ∑nΔH°f(反应物)
其中,n表示反应物和生成物的摩尔数。
标准生成焓的值可以通过实验测定得到,也可以通过估算方法推算得到。
常用的估算方法包括Hess定律和Kirchhoff定律。
Hess定律指出,化学反应的反应热与其反应路径无关,只与反应物和生成物的状态有关。
因此,可以利用已知反应的标准生成焓来计算其他反应的标准生成焓。
Kirchhoff定律则是利用热力学定律来推算标准生成焓的值,其基本思想是通过测量物质在不同温度下的热容变化来计算标准生成焓的变化量。
这种方法适用于无法通过实验测定的物质。
- 1 -。
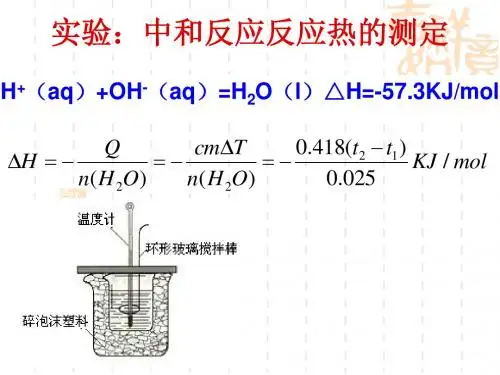
中和反应热的计算公式
(1)化学反应热的计算公式
化学反应热(ΔH)是指在能量守恒条件下反应物吸收(ΔH>0)或释放(ΔH<0)的能量,可以用牛顿热力学第二定律来计算:
ΔH=ΔU+Δ(PV),其中ΔU 是反应的化学变化,Δ(PV) 是反应状态变化
的热力学因子。
(2)中和反应热的计算公式
中和反应热(ΔH)是指在一定环境(如常温常压)下,在酸与碱发生
反应时释放或者吸收的热量。
中和反应热是物质特性及结构变化的表现,不受环境的影响,但受酸碱的性质与结构的影响。
因此,中和反
应热的计算可以用下面的公式:
ΔH=ΔHf (酸) +ΔHf (碱) - ΔHf (中和物),
其中ΔHf (酸)、ΔHf (碱)、ΔHf (中和物)表示酸、碱、中和物的放热值,放热值可通过观测或实验获得;也可以从常用的放热表中查得,综合
各物质的放热值,就可以根据上面公式计算当前中和反应中释放或吸
收的能量值ΔH。