第二章 化学反应的一般原理资料
- 格式:ppt
- 大小:1.75 MB
- 文档页数:148

第二章化学反应的一般原理(The General Principle of Chemical Reaction)学习要求1.理解反应进度ξ、系统与环境、状态与状态函数的概念;2.掌握热与功的概念和计算,掌握热力学第一定律的概念;3.掌握Q p、∆U、∆r H m、∆r H m、∆f H m、∆r S m、∆r S m、S m、∆r G m、∆r G m、∆f G m的概念及有关计算和应用;4.掌握标准平衡常数K 的概念及表达式的书写;掌握∆r G m与K 的关系及有关计算;5.了解反应速率、基元反应、反应级数的概念;理解活化分子、活化能、催化剂的概念;了解影响反应速率的因素及其应用。
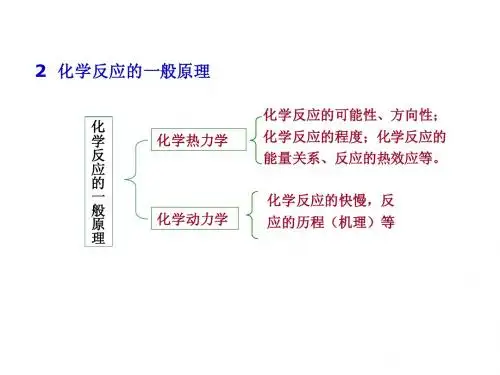
在化学反应的研究中,常涉及到化学反应进行的方向、程度以及反应过程中的能量变化关系和化学反应进行的快慢即化学反应的速率两个问题。
一个化学反应从始态到终态能否发生,反应的完全程度如何,是吸热反应还是放热反应等等,属于化学热力学的研究范畴;而化学反应的速率,反应从始态到终态所经历的途径即化学反应机理等问题则属于化学动力学的研究范畴。
人们总是希望有利的反应进行得快一点、完全一点;而不利的反应进行得慢一点、或尽可能抑制它的进行。
这就必须研究化学热力学和化学动力学的问题。
本章通过化学热力学、化学动力学的一般原理介绍,引出化学反应的焓变、熵变和吉布斯函数变的概念及其与平衡常数的关系,反应速率方程、反应级数、活化能等的概念及有关的计算。
无机及分析化学2.1 基本概念和术语2.1.1 化学反应进度1.化学反应计量方程式在化学中,满足质量守恒定律的化学反应方程式称为化学反应计量方程式。
在化学反应计量方程式中,用规定的化学符号①和相应的化学式将反应物(reactant)与生成物(product)联系起来。
例如,对任一已配平的化学反应方程式,质量守恒定律可用下式表示:0 = B BB ∑ν (2-1) 式中B 为化学反应方程式中任一反应物或生成物的化学式,称物质B ;νB 为物质B 的化学计量数(stoichiometric number)(当B 为具体的物质时也可表示在圆括号内,如ν(NH 3)),是出现在化学反应方程式(2-1)式中的物质B 的化学式前的系数(整数或简分数),是化学反应方程式特有的物理量,其量纲为一,单位为1①。


第二章 化学反应的基本原理知识点一、基本概念:体系和环境;状态和状态函数;过程和途径;热与功;相;化学计量数与反应进度;焓;熵;吉布斯自由能。
① 状态函数的特征:状态一定值一定,途殊回归变化等,周而复始变化零。
② 热和功(非状态函数)符号:体系吸热 Q 为+ 体系放热 Q 为— 体系做功 W 为— 环境做功 W 为+ 体积功 : W=-P 外·ΔV ③ 化学计量数与反应进度:N 2 (g) + 3 H 2 (g) = 2 NH 3 (g)化学计量数 ν(N 2)= -1 ν(H 2) =-3 ν(NH 3) = 2 反应进度1mol :表示1mol N 2与3mol H 2作用生成2mol NH 312N 2 (g) + 32H 2 (g) = NH 3 (g) 化学计量数:ν(N 2)=-12 ν(H 2)=-32 ν(NH 3) = 1反应进度1mol :表示12mol N 2与32mol H 2作用生成1mol NH 3④ 熵:S(g)>S(l)>S(s) ; S (复杂)> S(简单) ; 气体:S(高温) > S (低温); S(低压) > S (高压); 固~液相溶,S 增大; 晶体析出,S 减小;气~液相溶,S 减小; 固体吸附气体,S 减小; 气体等温膨胀,S 增大 二、盖斯定律总反应的反应热等于各分反应的反应热之和。
若反应①+反应②→反应③,则()()()312r mr m r m H H H θθθ∆=∆+∆若反应①×2—反应②→反应③,则()()()3212r mr m r m H H H θθθ∆=∆-∆三、热力学第一定律:U Q W ∆=+ 四、化学反应的方向(298.15)()r m B f m BH k H B θθν∆=∆∑(298.15)()r m B m BS k S B θθν∆=∑(298.15)()r m B f m BG k G B θθν∆=∆∑(注:指定单质通常为稳定单质的()0f m H B θ∆=,()0f m G B θ∆=()()()()T (298k)T 298r m r m r m r m r m G T H T S T H S K θθθθθ∆=∆-∆≈∆-∆ 反应在标准状态下进行:若()0r mG T θ∆<,则反应正向自发进行;若()0r m G T θ∆=,则反应处于平衡状态;若()0r m G T θ∆>,则反应逆向自发进行。







第二章 化学反应的基本原理重要概念1.自发反应:在给定的条件下能自动进行的反应或过程叫做自发反应或自发过程。
自发过程都是热力学的不可逆过程。
2.系统倾向于取得最低的势能。
3.反应的焓变是判断一个反应能否自发进行的重要依据但是不是唯一的依据。
4.过程能自发地向着混乱程度增加的方向进行。
5.熵是系统内物质微观粒子的混乱度(或无序度)的量度。
Ω=kln S ,式中Ω为热力学概率或者称混乱度,k 为波尔兹曼常数。
6.熵的公式表明:熵是系统混乱度的量度,系统的微观状态数越多,热律学概率越大,系统越混流乱,熵就越大。
7.热力学第二定律:在隔离系统中发生的自发反应必伴随着熵的增加,或隔离系统的熵总是趋向于极大值,这就是自发过程热力学的准则,称为熵增加原理。
8.热力学第三定律:在绝对零度时,一切纯物质的完美晶体的熵值都等于零。
表达式为S (0K )=kln1=0;9.依此为基础,若知道某一物质从绝对零度到指定温度下的一些热力学数据如热容等,就可以求出此温度时的熵值,称为这一物质的规定熵。
10.单位物质的量的纯物质在标准状态下的规定熵叫做该物质的标准摩尔熵。
11.规定处于标准状态下水合氢离子的标准熵值为零。
12.(1)对于同一物质而言,气态时的熵大于液态时的,液态时的熵又大于固态时的熵。
(2)同一物质在相同的聚集态时,其熵值随温度的升高而增大;(3)在温度和聚集态相同时,分子或晶体结构较复杂的物质熵值大于分子或晶体结构较为简单的物质的熵值。
(4)混合物或溶液的熵值往往比相应的纯净物的熵值大。
13.对于物理或者化学变化而言,几乎没有例外,一个导致气体分子数增加的过程或反应总伴随着熵值的增大。
14.注意,虽然物质的标准熵随温度的升高而增大,但是只要是没有引起物质聚集状态的改变,其值通常相差不大,可以认为反应的熵变基本不随温度而变,这一点和焓变很类似。
15.自由能:把焓和熵并在一起的热力学函数。
16.吉布斯函数:m r m r m r S T H G TS H G ∆-∆=∆-=或者写成。