碳和碳的氧化物复习课学案
- 格式:doc
- 大小:41.50 KB
- 文档页数:3


第六单元碳和碳的氧化物复习课教案一、教学目标1、对本单元内容进行整理,培养学生的分析、归纳能力;2、巩固本单元所学知识;3、加强学生的社会和环境责任感。
二、教学重点巩固本单元所学知识。
三、教学难点培养学生的分析、归纳能力。
四、教学过程【师】通过以前的学习,同学们对碳单质及碳的氧化物的性质和用途,对二氧化碳的实验室制法都有了一定的认识,希望同学们通过本堂复习课的学习,加深已学知识的理解,巩固所学知识,达到查漏补缺的目的。
【板书】一、碳及其氧化物的性质和用途【学生活动】完成下面的内容(以试卷的形式已经发给学生,让学生课下完成)(一)碳的单质1、金刚石和石墨若在水中先加入紫色石蕊,观察到的现象是:碳酸不稳定,受热易分解:与澄清的石灰水的反应:(3)CO2现象:该反应的用途:应用:用石灰浆抹墙一段时间后变硬的原因是:在刚抹过石灰浆的室内生一盆炭火,墙壁变得更湿的原因:实验室里久置的石灰水上层会有一层白膜的原因:3.二氧化碳的用途现象:(3)毒性:【师】对学生之间的交流进行指导。
【学生活动】讨论:1、初一学生小明想将家中的红糖变成白糖,又不知该怎样才能办到,请你帮助他设计一个将红糖变成白糖的方案。
2、二氧化碳和一氧化碳对环境各有什么影响?【板书】二、实验室制取气体的思路和方法【师】实验室制取气体,首先要选择合适的反应,其次要根据这个反应的特点选择合适的装置,并依据气体的性质选择合适的气体收集装置。
请同学们回忆一下,在选择合适的反应、合适的反应装置和收集装置时,各应考虑哪些因素?【学生活动】考虑并回答老师提出的问题。
并完成下面的内容(一)实验室制取二氧化碳的方法1、原料:和2.原理:3.实验装置(请画图)4.收集方法:5.验满方法:6.检验方法:方法:现象:化学反应方程式:【学生活动】从以下三个方面对氧气和二氧化碳实验室制法进行比较:1、反应原理;2、实验装置图;3、检验方法。
【板书】三、几种无色气体的鉴别方法【师】引导学生完成如下内容:CO的鉴别:2的方法:将该气体通1.鉴定无色无味的气体是否是CO2入中,观察现象。

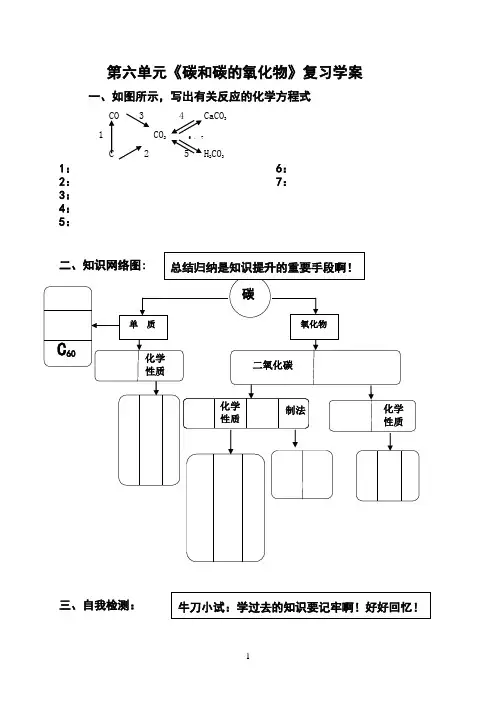
第六单元《碳和碳的氧化物》复习学案一、如图所示,写出有关反应的化学方程式CO 3 4 CaCO 3 1 CO 2 6 、 7C 2 5 H 2CO 31: 6: 2: 7: 3: 4: 5:二、知识网络图:三、自我检测:C 60化学性质化学 性质化学 性质制法碳氧化物单 质总结归纳是知识提升的重要手段啊!牛刀小试:学过去的知识要记牢啊!好好回忆!二氧化碳1、请将下列物质、性质、用途连线。
2、(1)(2009年桂林)有一种无色气体A ,它不能燃烧,也不支持燃烧,A 溶于水生成B ,B 能使紫色石蕊试液变成红色,B 不稳定,能分解出C 和气体A ,A 气体能使澄清的石灰水变浑浊,生成白色成淀D 。
推断:A B C ______D (2)根据知识网及所写的化学方程式,快速判断物质的化学性质。
(填“有”或“无”,“能”或“不能”)可燃性 还原性 与水反应 与石灰水反应毒性 C CO CO 23、如何区分二氧化碳和一氧化碳气体?方法①_________________________________________________________________;方法②_________________________________________________________________;方法③_________________________________________________________________;4、根据你构建的知识网,按要求写出化学方程式。
(1)有CO 2参加的反应:(2)有CO 2生成的反应:金刚石 石 墨活性炭、木炭 铅笔芯、润滑剂 玻璃刀 吸附性强 作电极硬度大 导电性良好 质软、滑腻 除臭剂四、典题精练:1、(2009年盐城)下列有关说法中,正确的是( )A .室内放置一大盆水,就可防止煤气中毒B .室内着火,应立即开窗通风C .夜间室内有煤气泄漏,可立即开灯检查D .久未开启的地窖窖井,不可贸然进入2、(2009年黑龙江)根据初中所学化学知识并结合下图所示回答:(1)写出标号仪器的名称:①____________; ②_________________。







《碳和碳的氧化物》复习导学案一、学习目标:1、知识与技能;(1)、碳单质的性质和用途;(2)、实验室制取二氧化碳的反应原理、装置、收集方法和检验方法;(3)、CO2、CO的性质、用途以及对生活和环境的影响;2、过程与方法:(1)、通过探讨活动,培养学生的动手操作能力;(2)、通过讨论一些实际问题,培养学生分析问题和解决问题的能力;3、情感态度和价值观:(1)、通过探讨活动,培养学生对科学技术的正确认识;(2)、通过收集有关资料,进一步加强对温室效应的认识,培养学生关注社会和人类生存环境的情感;二、教学重点:1、碳单质、CO2、CO的化学性质。
2、实验室制取二氧化碳的方法。
三、教学难点:1、CO2与水、石灰水反应。
2、CO还原CuO的分析。
四、教学方法:提问→讨论→归纳→总结五、教学过程:(一)、单元知识要点归纳小结:2、氧气和二氧化碳的实验室制法比较3、如CO 3 4 CaCO31 CO2 6 、 7C 2 5 H2CO34、为了防止温室效应进一步增强,人类应该采取哪些措施?(二)、强化训练,巩固提高。
1.下列各项实验中,所用试剂及实验操作均正确的是()2.关于一氧化碳燃烧()说法正确的是( )(A)反应过程中吸收大量的热(B)反应前后分子个数不变(C)参加反应的一氧化碳和氧气的质量比为2∶1(D)化学方程式中反应物的化学计量数之比表示为V(CO)∶V(O2)=2∶13.利用图8装置可进行气体性质的探究实验.甲的玻璃管中盛放黑色粉末(CuO或C),乙的洗气瓶中盛放无色溶液(澄清石灰水或NaOH溶液).(1)写出仪器的名称: a______ , b______ .(2)根据要求填表(3)上述两实验中,在导管c的尖嘴处都用火柴点燃,其目的是否完全相同?简述理由.4.根据初中所学化学知识并结合图6所示回答(1)写出标号仪器的名称:①_______;②_______.(2)写出实验室用A装置制取氧气的化学方程式_______;检验氧气已收集满的方法是_______.(3)实验室制取二氧化碳的发生装置应选择_______.若选用C装置干燥二氧化碳,C中应盛放的试剂是_______;若选用C装置检验二氧化碳,C中发生反应的化学方程式为_______。
《碳和碳的氧化物》复习课教案煎茶初中赵倩【复习目标】1、熟练掌握碳、一氧化碳、二氧化碳的性质和用途。
2、熟练书写化学方程式。
3、熟悉知识间的相互联系,懂得是CO2将此单元与酸碱盐知识联系起来。
4、通过一些教师引导,学生总结,进一步提高学生解决实际问题的能力。
5、提高学生提取信息的能力,培养学生的学习兴趣和合作精神,创新精神。
树立关注环境、热爱自然的意识。
【重点难点】利用碳和碳的氧化物的相关知识间的相互联系,解决实际问题。
【教学方法】引导--归纳——运用教学模式【教学过程】(4)什么可以将小精灵从石灰水(或氢氧化钠溶液)中救出来?请写出化学方程式。
能力。
3、品诗词,完善复习内容《石灰吟》于谦千锤万凿出深山,烈火焚烧若等闲。
粉身碎骨浑不怕,要留清白在人间。
欣赏诗词,探讨以下问题:(1)诗人用什么化合物比喻自己坚韧不拔的毅力和高尚的情操?(2)第一句诗发生的是什么变化?后三句呢?用化学方程式表示后三句的变化。
(3)教室墙壁上的白色物质是什么?它是怎样产生的?通过诗词欣赏联系化学知识,有利于学生复习的兴趣培养。
4、师生共同归纳总结碳和碳的氧化物的相关知识间联系。
学生在教师的引导下,分组讨论:(1)碳、一氧化碳、二氧化碳的性质和用途;(2)找出碳和碳的氧化物知识点的相关联系。
通过归纳总结,整合知识点。
5、做练习,巩固知识练习问题:(1)、如何区别CO和CO2?有哪几种方法?并说出区别的理论依据。
学生讨论,得出各种方法激发学生在今后的学习中要勇于地探索和研究(2)、情境:酒吧出售一种特制的冷饮,由服务员在水中加入一种固体物质,该物质放入水中立即产生大量的白雾,营造一种十分浪漫的氛围。
学生探究如何用化学方法检验这种物质的成分。
增强学生的学习兴趣和探究能力。
6、本节课的收获学生回味。
【板书设计】。
初三化学科复习学案课题:碳和碳的氧化物学科化学姓名班级组别使用时间年月日【当堂检测】1.北约曾用“石墨炸弹”使南联盟的高压输变电线路短路,这是利用了石墨的( )A.可燃性B.还原性C.导电性D.润滑性2.1996年诺贝尔化学奖授予发现C60有重大贡献的三位科学家。
现在C70也已制得。
下列对C60和C70这两种物质的叙述中,有错误的是()A.它们都是碳元素组成的单质B.它们是两种新型的化合物C.它们都是由分子构成的D.它们的相对分子质量差是1203.世博“零碳馆”是中国第一座零碳排放的公共建筑。
“零碳”中的“碳”主要指( )A.CO B.CO2 C.CH4D.C4.二氧化碳与人们的生产和生活有着广泛的联系,下列关于二氧化碳的认识中正确的是()①在地窖、枯井内二氧化碳含量会比较高②二氧化碳在水中的溶解量跟压强成反比③绿色植物光合作用时吸收二氧化碳并放出氧气④二氧化碳比一氧化碳多一个氧原子A.①② B.③④ C.①③ D ②④5.合肥晚报讯(节选):合肥市卫生局应急办主任龚仁俊提醒说2013年春节,应急办已接到全市50余起煤气中毒事件报告;2013年2月14日,合肥市第二人民医院等四家医院陆续接收因使用煤球炉不当导致一氧化碳中毒的患者87人,其中3人死亡……据介绍,通过煤气中毒的案例分析,可以发现,煤气中毒者呈现几个共同特点:一是大多中毒者居住空间狭小;二是将煤炉放在屋内;三是通风不够。
请回答:(1)煤气中毒是由气体引起的;使人中毒的原理是。
(2)在煤燃烧过程中,CO是怎样产生的?(用化学方程式表示)(3)人为什么不易察觉到它的存在而发生煤气中毒?冬季取暖如何预防煤气中毒?【拓展升华】为了制取并收集干燥的CO2气体,现有如下实验装置。
(已知浓硫酸可以吸收水蒸气,氢氧化钠溶液可以吸收二氧化碳,浓盐酸有挥发性)①a、b两种仪器的名称是___________、__________;②实验室制取CO2的化学方程式为。
碳和碳的氧化物复习课学案
金刚石、石墨、C60都是由_____________组成的单质,由于碳原子结构相同,所以它们的化学性质相似,但由于____________________________,导致它们的物理性质存在明显的差异。
其中金刚石、石墨是由____________构成的,C60是由____________构成的。
金刚石:是一种_____________、______________形状的固体,是天然存在的_______的物质。
可用来
______________、_________________、___________________、________________________等。
石墨:是一种__________、有________________的_____________状固体,质______、有滑腻感,具有优良的___________,耐高温。
可用来做__________、___________、_________等。
C60:每个C60分子是由_______________组成的,形似足球,是一种很稳定的分子,其广泛应用于超导、催化、材料、医学及生物等领域。
△注:①由碳的几种单质可知:由同种元素组成的物质不一定为纯净物,也可能为混合物。
②金刚石和石墨虽然由同一种元素组成,但属于两种不同的单质,所以石墨和金刚石之间的转化,属于
________变化。
③木炭、焦炭、活性炭和炭黑等我们在日常生活和工农业生产中也经常使用,但它们都属于_________物,其主要成分是_____________。
④木炭和活性炭:黑色,结构___________,________性强。
可作________剂、________剂,用来去除色素和异味,此外活性炭还可用于______________________。
木炭和活性炭吸附这个过程属于_________变化。
二、碳的化学性质
碳的化学性质主要表现在三方面:1、___________;2、___________;3、___________。
常温下碳单质的化学性质_________,原因是________________________________________________,但随着温度的升高,碳的活动性增强,在点燃、加热、高温条件下,碳能跟很多物质发生反应。
在点燃的条件碳可以与氧气反应,同时放出大量的热,因此具有________性,但反应条件不同,产物也不同。
①充分燃烧___________________________;②不充分燃烧_________________________。
在高温的条件下,碳能夺取氧化物中的氧,使氧化物被还原,因此具有_______性,如①炭还原氧化铜___________________________________;②炭还原氧化铁_______________________________________;
③炭还原二氧化碳_____________________________等。
单质碳的还原性可用于__________________。
△注:画出碳还原氧化铜的实验装置图,并写出相应的实验现象以及在该实验中应注意的问题。
实验装置图:实验现象:①__________________________________;
②__________________________________。
注意事项:①_______________________________________________________________________________;
②_______________________________________________________________________________。
三、碳的氧化物
CO:是一种_____色______味______体,密度比空气______,______溶于水。
化学性质表现在①具有__________。
在点燃的条件下,CO可与O2反应,燃烧时火焰呈______色,放出大量的热,反应的化学方程式为__________________________。
②具有___________。
CO也能还原CuO、Fe2O3等金属氧化物,反应的化学方程式分别为________________________、________________________。
③具有_______。
煤气中毒即_________中毒,由于CO极易与血液中的血红蛋白结合,使血红蛋白不能再与氧气结合,从而造成生物体内缺氧。
用途:CO的还原性可用于__________________。
△注:①点燃CO前必须__________。
②水煤气的主要成分是___________。
画出CO还原氧化铜的实验装置图,并写出相应的实验现象以及在该实验中应注意的问题。
实验装置图:实验现象:①__________________________________;
②__________________________________。
注意事项:①_______________________________________________________________________________;
②_______________________________________________________________________________。
CO2:通常状况下,CO2是一种_____色______味______体,密度比空气______,______溶于水。
化学性质表现在①___________________________:向放有阶梯蜡烛的烧杯中倾倒CO2,观察到______蜡烛先熄灭______蜡烛后熄灭,这个实验说明◆CO2的密度______________;◆ ______________________。
②_______________:将CO2通入紫色石蕊溶液中生成___________能使溶液由_____色变为______色,反应的化学方程式为___________________;碳酸不稳定,易分解,反应的化学方程式为__________________。
③____________________:向澄清石灰水里通入CO2,澄清石灰水变__________,这是由于生成了________的缘故,反应的化学方程式为_______________________________,这个反应可用来检验CO2气体。
④不能供给呼吸。
CO2本身没有毒性,但当空气中的CO2超过正常含量时,会对人体健康产生影响。
因此在进入久未开启的菜窖、干涸的深井和深洞底部之前,必须先做_________试验。
用途:用于灭火;作气体肥料;作化工产品的原料(生产尿素、汽水、制纯碱);干冰做制冷剂。
△注:①由于CO2既不燃烧也不支持燃烧,所以可用来灭火。
②固态的CO2俗称________。
干冰在升华时,会______大量的热,因此可作______________;可用于
___________________________。
③CO2是造成温室效应的主要气体,所以CO2又称为温室气体。
④实验室中用NaOH溶液来吸收CO2,用澄清石灰水来检验CO2。
四、CO2的制取
反应原理:工业上利用___________________制取CO2,反应的化学方程式为_________________________。
实验室利用___________或__________和___________反应来制取,反应的化学方程式为_________________
___________________________。
实验装置:
收集和验满方法:收集方法_______________________。
验满:_____________________________________。
检验方法:_________________________________________________________________________________。
干燥方法:在实验室中,通常使用________________对CO2进行干燥。