第一章蛋白质结构基础
- 格式:ppt
- 大小:5.20 MB
- 文档页数:96


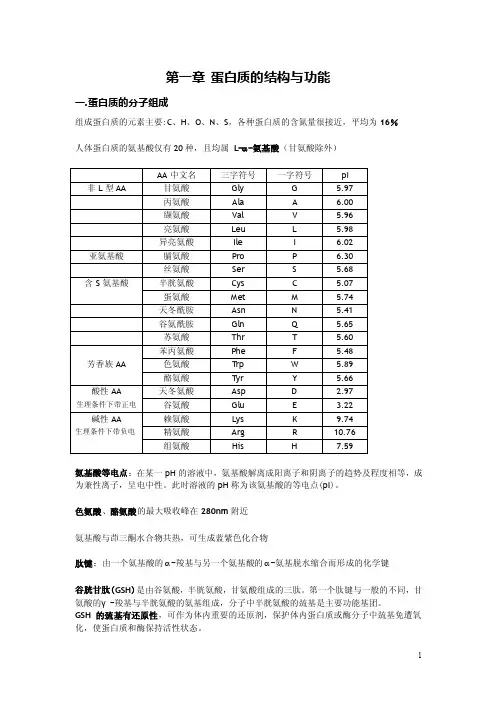
第一章蛋白质的结构与功能一.蛋白质的分子组成组成蛋白质的元素主要:C、H、O、N、S,各种蛋白质的含氮量很接近,平均为16%人体蛋白质的氨基酸仅有20种,且均属L-α-氨基酸(甘氨酸除外)氨基酸等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH称为该氨基酸的等电点(pI)。
色氨酸、酪氨酸的最大吸收峰在280nm附近氨基酸与茚三酮水合物共热,可生成蓝紫色化合物肽键:由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键谷胱甘肽(GSH)是由谷氨酸,半胱氨酸,甘氨酸组成的三肽。
第一个肽键与一般的不同,甘氨酸的γ-羧基与半胱氨酸的氨基组成,分子中半胱氨酸的巯基是主要功能基团。
GSH的巯基有还原性,可作为体内重要的还原剂,保护体内蛋白质或酶分子中巯基免遭氧化,使蛋白质和酶保持活性状态。
二.蛋白质的分子结构α-螺旋的结构特点:1.多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋2.主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合3.相邻两圈螺旋之间借肽键中C=O和NH形成许多链内氢健,这是稳定α-螺旋的主要键4.肽链中氨基酸侧链R分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成基团影响α-螺旋的稳定性包括以下三个方面:1.酸性或碱性氨基酸集中区域(两种电荷相互排斥)2.脯氨酸不利于α-螺旋的形成3.较大R基团侧链集中区域(空间位阻效应)β-折叠要点:1.是肽链相当伸展的结构,肽链平面之间折叠成锯齿状2.依靠两条肽链或一条肽链内的两段肽链间的C=O与H形成氢键,使构象稳定3.氨基酸残基的R侧链伸出在锯齿的上方或下方4.两段肽链可以是平行的,也可以是反平行的超二级结构有三种基本形式:1.α-螺旋组合(αα)2.β-折叠组合(ββ)3.α-螺旋β-折叠组合(βαβ)三.蛋白质结构与功能的关系镰刀形红细胞贫血:血红蛋白有2个α亚基和2个β亚基组成,其中β亚基的第六个氨基酸谷氨酸突变成缬氨酸。


第一节蛋白质的分子组成The Molecular Component of Protein组成蛋白质的元素主要有C、H、O、N和 S。
有些蛋白质含有少量磷或金属元素铁、铜、锌、锰、钴、钼,个别蛋白质还含有碘 。
一、组成人体蛋白质的20种氨基酸均属于L-α-氨基酸存在自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸仅有20种,且均属 L-氨基酸(甘氨酸除外)。
NH3二、氨基酸可根据侧链结构和理化性质进行分类¾非极性脂肪族氨基酸¾极性中性氨基酸¾芳香族氨基酸¾酸性氨基酸¾碱性氨基酸(一)侧链含烃链的氨基酸属于非极性脂肪族氨基酸(二)侧链有极性但不带电荷的氨基酸是极性中性氨基酸(三)侧链含芳香基团的氨基酸是芳香族氨基酸(四)侧链含负性解离基团的氨基酸是酸性氨基酸(五)侧链含正性解离基团的氨基酸属于碱性氨基酸三、20种氨基酸具有共同或特异的理化性质(一)氨基酸的一般物理性质•氨基酸为无色晶体,熔点较高(常在230-300℃之间),在纯水中各种氨基酸的溶解度差异较大。
•氨基酸难溶于乙醚等有机溶剂,加乙醇能使许多氨基酸从水溶液中沉淀析出。
•氨基酸分子中含有手性碳原子,具有旋光性,其旋光度大小取决于R基团的性质,它与D/L型没有直接对应关系。
氨基酸的旋光性可使用旋光仪测定的,左旋者通常用(-)表示,右旋通常用(+)表示。
•每一种氨基酸都有各自不同的等电点,氨基酸pI由其分子中的氨基和羧基的解离程度所决定•氨基酸的pI的计算公式为:pI=1/2(pK1+pK2)pK1代表氨基酸的α-羧基的解离常数的负对数pK2代表氨基酸α-氨基的解离常数的负对数•处于等电点时的氨基酸溶解度最小,极易从溶液中析出。
因此,氨基酸工业生产中可采用等电点沉淀法分离氨基酸。
思考题:(三)含共轭双键的氨基酸具有紫外吸收性质芳香族氨基酸的紫外吸收芳香族氨基酸含有苯环共轭体系,具有紫外吸收特性,在280nm附近有最大吸收值。
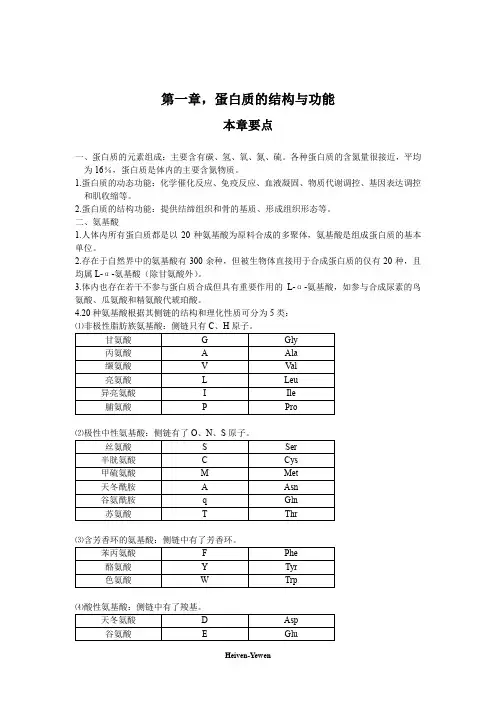
第一章,蛋白质的结构与功能本章要点一、蛋白质的元素组成:主要含有碳、氢、氧、氮、硫。
各种蛋白质的含氮量很接近,平均为16%,蛋白质是体内的主要含氮物质。
1.蛋白质的动态功能:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控和肌收缩等。
2.蛋白质的结构功能:提供结缔组织和骨的基质、形成组织形态等。
二、氨基酸1.人体内所有蛋白质都是以20种氨基酸为原料合成的多聚体,氨基酸是组成蛋白质的基本单位。
2.存在于自然界中的氨基酸有300余种,但被生物体直接用于合成蛋白质的仅有20种,且均属L-α-氨基酸(除甘氨酸外)。
3.体内也存在若干不参与蛋白质合成但具有重要作用的L-α-氨基酸,如参与合成尿素的鸟氨酸、瓜氨酸和精氨酸代琥珀酸。
4.20种氨基酸根据其侧链的结构和理化性质可分为5类:⑴非极性脂肪族氨基酸:侧链只有C、H原子。
⑶含芳香环的氨基酸:侧链中有了芳香环。
⑷酸性氨基酸:侧链中有了羧基。
芳香族氨基酸中苯基的疏水性较强,酚基和吲哚基在一定条件下可解离;酸性氨基酸的侧链都含有羧基;而碱性氨基酸的侧链分别含有氨基、胍基或咪唑基。
5.20种氨基酸具有共同或特异的理化性质:⑴氨基酸具有两性解离的性质。
①所有氨基酸都含有碱性的α-氨基和酸性的α-羧基,可在酸性溶液中与质子(H+)结合呈带正电荷的阳离子(),也可在碱性溶液中与(OH-)结合,失去质子变成带负电荷的阴离子()。
②氨基酸是一种两性电解质,具有两性解离的特性。
③在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
④取兼性离子两边的pK值的平均值,即为此氨基酸的pI值:pI=1/2(pK1+pK2)⑵含共轭双键的氨基酸具有紫外线吸收性质①含有共轭双键的色氨酸、酪氨酸的最大吸收峰在280nm波长附近。
②由于大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。



第一篇蛋白质的结构与功能(第一~四章小结)第一章氨基酸氨基酸是一类同时含有氨基和羧基的有机小分子。
组成多肽和蛋白质的氨基酸除Gly外,都属于L型的α- 氨基酸(Pro为亚氨基酸)。
氨基酸不仅可以作为寡肽、多肽和蛋白质的组成单位或生物活性物质的前体,也可以作为神经递质或糖异生的前体,还能氧化分解产生ATP。
目前已发现蛋白质氨基酸有22种,其中20种最为常见,而硒半胱氨酸和吡咯赖氨酸比较罕见。
非蛋白质氨基酸通常以游离的形式存在,作为代谢的中间物和某些物质的前体,具有特殊的生理功能。
22种标准氨基酸可使用三字母或单字母缩写来表示。
某些标准氨基酸在细胞内会经历一些特殊的修饰成为非标准蛋白质氨基酸。
氨基酸有多种不同的分类方法:根据R基团的化学结构和在pH7时的带电状况,可分为脂肪族氨基酸、不带电荷的极性氨基酸、芳香族氨基酸、带正电荷的极性氨基酸和带负电荷的极性氨基酸;根据R基团对水分子的亲和性,可分为亲水氨基酸和疏水氨基酸;根据对动物的营养价值,可分为必需氨基酸和非必需氨基酸。
氨基酸的性质由其结构决定。
其共性有:缩合反应、手性(Gly除外)、两性解离、具有等电点,以及氨基酸氨基和羧基参与的化学反应,包括与亚硝酸的反应、与甲醛的反应、Sanger反应、与异硫氰酸苯酯的反应和与茚三酮的反应等。
与亚硝酸的反应可用于Van Slyke定氮,与甲醛的反应可用于甲醛滴定,Sanger反应和与异硫氰酸苯酯的反应可用来测定N-端氨基酸。
只有脯氨酸和羟脯氨酸与茚三酮反应产生黄色物质,其余生成蓝紫色物质,利用此反应可对氨基酸进行定性或定量分析。
多数氨基酸的侧链可能发生特殊的反应,可以此鉴定氨基酸。
不同氨基酸在物理、化学性质上的差异可用来分离氨基酸,其中最常见的方法是电泳和层析。
第二章蛋白质的结构肽是氨基酸之间以肽键相连的聚合物,它包括寡肽、多肽和蛋白质。
氨基酸是构成肽的基本单位。
线形肽链都含有N端和C端,书写一条肽链的序列总是从N端到C端。

第一章蛋白质的分子结构(2)点击:429次| 回复:0次| 发布时间:2012-07-19 17:59:39第一章蛋白质的结构与功能第二节蛋白质的分子结构蛋白质是生物大分子,结构比较复杂,人们用4个层次来描述,包括蛋白质的一级、二级、三级和四级结构。
一级结构描述的是蛋白质的线性(或一维)结构,即共价连接的氨基酸残基的序列,又称初级或化学结构。
二级以上的结构称高级结构或构象(conformation)。
一、蛋白质的一级结构(primary structure)蛋白质分子中,从N端到C端的氨基酸排列顺序称为蛋白质的一级结构,主要的化学链是肽键。
二、蛋白质的二级结构(secondary structure)蛋白质的二级结构是指其分子中主链原子的局部空间排列,是主链构象(不包括侧链R基团)。
维持二级结构的化学键主要是氢键。
肽单元(或称肽平面,肽单位等)肽键及其两端的α-C共6个原子处于同一平面上,组成了肽单位(所在的平面称肽键平面)。
肽键有部分双键的性质,不能自由旋转。
蛋白质的主链骨架由许多肽键平面连接而成。
1.α-螺旋(α-helix)α-螺旋是肽键平面通过α-碳原子的相对旋转形成的一种紧密螺旋盘绕,是有周期的一种主链构象。
其特点是:①螺旋每转一圈上升3.6个氨基酸残基,螺距约0.54nm(每个残基上升0.15nm,旋转100O)。
②螺旋的走向绝大部分是右手螺旋,残基侧链伸向外侧。
R基团的大小、荷电状态及形状均对α-螺旋的形成及稳定有影响。
2.β-折叠(β-pleated,β- sheet)β-折叠是一种肽链相当伸展的周期性结构。
①相邻肽键平面间折叠成锯齿状。
②两个以上具β-折叠的肽链或同一肽链内不同肽段相互平行(方向相同)或反平行(方向相反)排列,其稳定因素是肽链间的氢键。
3.β-转角(β-turn)多肽链180度回折成β-转角。
稳定β-转角的作用力是第一个氨基酸残基羰基氧(O)与第四个氨基酸残基的氨基氢(H)之间形成的氢键。

第一章蛋白质的结构与功能蛋白质组成元素的特点;基本结构单位-----氨基酸(识记)P4肽键:(识记)P7是由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的化合键多肽链:(识记)P7肽链分子中的氨基酸相互衍接,形成的长链,称为多肽链一级结构:(识记)P8是指蛋白质多肽链中从N-端至C-端的氨基酸排列顺序.主要化学键为肽键二级结构:(识记)P8是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
主要的化学键是氢键---主要有α-螺旋、β-折叠、β-转角、无规卷曲等多种形式。
三级结构:(识记)P10整条肽链中全部氨基酸残基的相对空间位置。
即肽链中所有原子在三维空间的排布位置。
四级结构:(识记)P11蛋白质的四级结构是指由多条亚基通过非共价键(主要是氢键和离子键)连接起来的结构形式。
蛋白质是生命物质的重要基础、蛋白质的重要生理工功能(领会)P131、作为生物催化剂(酶)2、代谢调节作用3、免疫保护作用4、物质的转运和存储5、运动与支持作用6、参于细胞间的信息传递蛋白质的二级结构:a-螺旋、β-折叠(应用)P9a-螺旋特点:⑴为一右手螺旋;⑵螺旋每圈包含3.6个氨基酸残基,螺距为0.54 nm;⑶螺旋以氢键维系(第1个aa的NH与第4个aa的 CO 形成氢键),氢键是稳定α-螺旋的主要化学键β-折叠特点1、多肽链充分伸展,肽链主链呈锯齿状折叠构象。
2、Cα总是处于折叠的角上(以Cα为旋转点)3、AA的R基团交替处于锯齿状结构的上下方并与之垂直4、氢键是稳定β-折叠的主要化学键空间结构与功能关系(识记)P14空间结构是蛋白质正确发挥生物学功能的基础一级结构与功能关系(应用)P14(一)一级结构是空间构象和功能的基础蛋白质特定的空间结构是以氨基酸顺序为基础的。
(二)一级结构相似的多肽或蛋白质,其空间构象以及功能也相似(三)一级结构可提供重要的生物进化信息(四)重要蛋白质的氨基酸序列改变可引起疾病蛋白质分子中起关键作用的氨基酸残基缺失或被替代,都会严重影响空间构象乃至生理功能,如分子病。
第一章蛋白质·蛋白质(protein)就是由许多氨基酸(amino acids)通过肽键(prpide bond)相连形成得高分子含氮化合物。
·具有复杂空间结构得蛋白质不仅就是生物体得重要结构物质之一,而且承担着各种生物学功能,其动态功能包括:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控与肌收缩等;就其结构功能而言,蛋白质提供结缔组织与骨得基质、形成组织形态等。
·显而易见,普遍存在于生物界得蛋白质就是生物体得重要组成成分与生命活动得基本物质基础,也就是生物体中含量最丰富得生物大分子(biomacromolecule)·蛋白质就是生物体重要组成成分。
分布广:所有器官、组织都含有蛋白质;细胞得各个部分都含有蛋白质含量高:蛋白质就是细胞内最丰富得有机分子,占人体干重得45%,某些组织含量更高,例如:脾、肺及横纹肌等高达80%。
·蛋白质具有重要得生物学功能。
1)作为生物催化剂(酶)2)代谢调节作用3)免疫保护作用4)物质得转运与存储5)运动与支持作用6)参与细胞间信息传递·氧化功能第一节蛋白质得分子组成(The Molecular Structure of Protein)1、组成元素:C(50%-55%)、H(6%-7%)、O(19%-24%)、N(13%-19%)、S(0-4%)。
有些但被指含少量磷、硒或金属元素铁、铜、锌、锰、钴、钼,个别还含碘。
2、各蛋白质含氮量接近,平均为16%。
100g样品中蛋白质得含量(g%)=每克样品含氮克数*6、25*100,即每克样品含氮克数除以16%。
凯氏定氮法:在有催化剂得条件下,用浓硫酸消化样品将有机氮都转化为无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气蒸馏出来并为过量得硼酸液吸收,再以标准盐酸滴定,就可计算出样品中得氮量。
此法就是经典得蛋白质定量方法。
一、氨基酸——组成蛋白质得基本单位存在于自然界得氨基酸有300余种,但组成人体蛋白质得氨基酸仅有20种,且均属L-氨基酸(甘氨酸除外),手性,具有旋光性(甘氨酸除外,甘氨酸R基团为-H)。