不同动物的采血安全及致死量
- 格式:doc
- 大小:25.00 KB
- 文档页数:1


一、实验目的1. 掌握药理实验中动物采血的方法和技巧。
2. 学习不同动物采血点的选择及其适用性。
3. 了解采血过程中的注意事项,确保实验数据的准确性。
二、实验原理药理实验中,动物采血是获取实验数据的重要环节。
通过采血,可以检测动物体内的血液指标,如血糖、血脂、血常规等,从而评估药物对动物的影响。
本实验采用小鼠作为实验动物,分别通过尾静脉采血和眼眶静脉采血两种方法获取血液样本。
三、实验材料1. 实验动物:小鼠(体重18-22g)。
2. 采血器材:采血针、注射器、试管、酒精棉球、止血带等。
3. 实验试剂:生理盐水、抗凝剂等。
四、实验方法1. 尾静脉采血- 将小鼠放入固定盒中,用止血带固定尾部。
- 将尾部毛剪去,用酒精棉球消毒。
- 观察尾静脉,选择较粗的静脉进行采血。
- 用采血针对准静脉,缓慢插入,避免损伤血管。
- 收集血液至试管中,加入适量抗凝剂。
- 采血完毕后,用酒精棉球消毒伤口,压迫止血。
2. 眼眶静脉采血- 将小鼠放入固定盒中,用止血带固定头部。
- 用酒精棉球消毒眼眶周围。
- 用拇指和食指轻轻按压眼球,使眼眶静脉暴露。
- 用采血针对准静脉,缓慢插入,避免损伤血管。
- 收集血液至试管中,加入适量抗凝剂。
- 采血完毕后,用酒精棉球消毒伤口,压迫止血。
五、实验结果1. 尾静脉采血:小鼠体重18-22g,每次采血量约0.1ml,可重复采血3-5次。
2. 眼眶静脉采血:小鼠体重18-22g,每次采血量约0.05ml,可重复采血2-3次。
六、实验讨论1. 尾静脉采血操作简便,采血量充足,适用于一般药理实验。
但反复采血可能导致小鼠尾部损伤,影响实验动物的存活率。
2. 眼眶静脉采血操作相对复杂,采血量较少,但损伤较小,适用于需要多次采血或对动物存活率要求较高的实验。
3. 采血过程中应注意以下几点:- 操作者应熟悉动物解剖结构,避免损伤血管。
- 采血针插入血管后,应缓慢抽拉,避免血液凝固。
- 采血完毕后,应及时对伤口进行消毒和压迫止血。


动物实验●动物的选择选择的原则:一切实验动物应具有个体间的均一性,遗传的稳定性和容易获得三个基本要求。
1.从研究目的和实验要求选择,尽量选择与研究对象的机能,代谢,结构,疾病性质的动物。
2.是否易获得,是否经济,是否容易饲养。
●实验动物本实验室常用的实验动物多为小鼠和家兔1.小鼠(Mus musculus)实验小鼠是目前教学,医学科学研究工作中经常应用的,使用量最大的一种动物。
其性成熟早,产仔多,繁殖快,体型小,便于管理,价格低廉,应用极广,特别使用于需要大量动物进行的实验,如药物筛选,半数致死量,药物的效价比较等。
用人工接种或化学致癌物方法可以导致生长各种响应肿瘤,因此也很适应抗癌药物的研究。
我国医学实验中常用的小鼠是野生鼷鼠的变种,属于哺乳纲,啮齿目,鼠科,鼠属。
小鼠1.5-2 月龄体重达20g以上,可供实验使用。
常用的实验小鼠,尤其是纯品系小鼠,经过人们长期的定向培育与纯化之后,一般具有与野生动物或家畜不同的独有特性(对实验的敏感性和实验结果的一致性,个体动物遗传的均一性),这些都是衡量实验小鼠质量好坏的重要标志。
我国常用的实验小鼠品种有:Balb/c鼠,昆明鼠等。
2.家兔(Oryctolagus cunieulus Rabbits)兔形目,兔科。
常用的家兔为真兔属,由欧洲野生穴兔驯化而成,目前已有五十多个品种。
生物医学研究中常用的家兔均为欧洲兔的后代,使用最多的有新西兰兔,大耳白兔,青紫兰兔,荷兰兔,弗莱密西兔。
●抗原剂量的选择不同抗原的免疫原性强弱不同,取决于其分子量,化学活性基团,立体结构,物理性状和弥散速度等。
抗原的免疫剂量依照给予抗原的种类,免疫次数,注射途径以及受体动物的种类,免疫周期及所要求的抗体特性等而不同。
剂量过低不能形成足够强的免疫刺激,剂量过高,又有可能造成免疫耐受。
在一定范围内,抗体效价随注射抗原的剂量而增高。
蛋白质抗原的免疫剂量比多糖类抗原宽。
一般而言,小鼠首次抗原剂量为50-400μg/次,大鼠为100μg-1mg/次,加强免疫的剂量为首次剂量的1/5-2/5。

动物采血原则
动物采血的总体原则是:
采血体积和频率的选择决定于体循环中的血液体积和红细胞更
新的速度。
过量采血会导致低血容量性休克、生理应激甚至死亡。
为了动物健康考虑,采血体积应该是推荐最大体积的下限。
最大采血体积是针对正常健康动物制定的。
采血过程中,应该最小化采血体积。
多次采血的情况下,应该尽量减少采血量。
此外,根据不同动物和具体实验需求,还应当遵循以下原则:
单次采血:在不补充液体的情况下,单次采血的最大采血量约为全血量的10%,即7.7-8µL/g。
如25g小鼠,大约是193-200μL。
如果补充液体,单次采血的最大量约为血液总量的15%,即12µL/g。
在25g的小鼠中,这大约是300µL。
一般补充体液时,应预热后经皮下注射。
多次采血:如果实验需要多次采血,应尽量减少采血量。
每周最大采血量不超过血液总量的7.5%,为6µL/g。
对于25g的小鼠,每周大约为145-150µL。
放血法:通过放血法收集血液,可以收集血液总体积的一半左右,即40µL/g。
以上信息仅供参考,具体操作应根据实际情况和实验需求进行调整,并遵循相关动物伦理和法律法规。
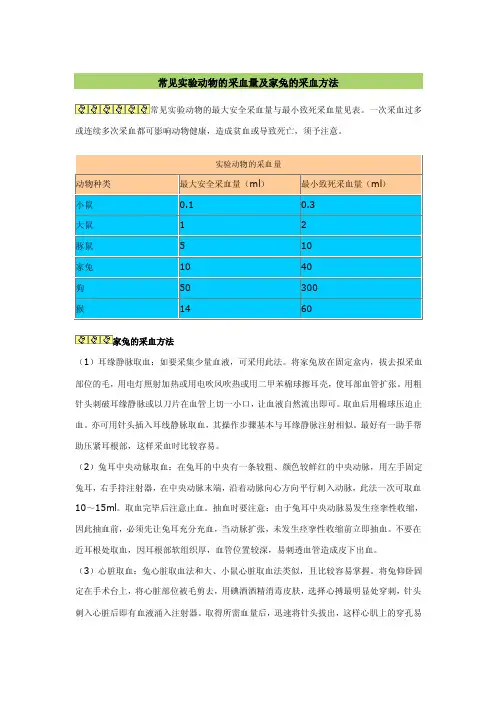
常见实验动物的采血量及家兔的采血方法
常见实验动物的最大安全采血量与最小致死采血量见表。
一次采血过多或连续多次采血都可影响动物健康,造成贫血或导致死亡,须予注意。
家兔的采血方法
(1)耳缘静脉取血:如要采集少量血液,可采用此法。
将家兔放在固定盒内,拔去拟采血部位的毛,用电灯照射加热或用电吹风吹热或用二甲苯棉球擦耳壳,使耳部血管扩张。
用粗针头刺破耳缘静脉或以刀片在血管上切一小口,让血液自然流出即可。
取血后用棉球压迫止血。
亦可用针头插入耳线静脉取血,其操作步骤基本与耳缘静脉注射相似。
最好有一助手帮助压紧耳根部,这样采血时比较容易。
(2)兔耳中央动脉取血:在兔耳的中央有一条较粗、颜色较鲜红的中央动脉,用左手固定兔耳,右手持注射器,在中央动脉末端,沿着动脉向心方向平行刺入动脉,此法一次可取血10~15ml。
取血完毕后注意止血。
抽血时要注意:由于兔耳中央动脉易发生痉挛性收缩,因此抽血前,必须先让兔耳充分充血,当动脉扩张,未发生痉挛性收缩前立即抽血。
不要在近耳根处取血,因耳根部软组织厚,血管位置较深,易刺透血管造成皮下出血。
(3)心脏取血:兔心脏取血法和大、小鼠心脏取血法类似,且比较容易掌握。
将兔仰卧固定在手术台上,将心脏部位被毛剪去,用碘酒酒精消毒皮肤,选择心搏最明显处穿刺,针头刺入心脏后即有血液涌入注射器。
取得所需血量后,迅速将针头拔出,这样心肌上的穿孔易
于闭合。
经6~7天后,可以重复进行心脏采血。
此外,还可以从颈动静脉、股动静脉、眼底(一般不常采用)取血。

1、关于小鼠血液量的问题:小鼠循环血量占体重的6%,或50-70ml/kg,采血占全血量的10%不会对机体造成严重的不良影响。
3-4周后可以重新采集一次。
特别注意的是:老年小鼠血量降低。
疾病会加重不良反应,所以必须考虑这些影响因素。
采血后应补充响应体积的液体,如果需要很短时间反复采血,比如每天一次,每次的采血量不应超过全血的1%。
2、关于取血方法的问题:(1)尾尖取血:当所需血量很少时采用本法。
固定动物并历出鼠尾,将鼠尾在45℃温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管扩张。
将鼠尾擦干,剪去尾尖,血自尾尖流出,让血液滴入盛器或直接用移液器吸取。
如需间隔一定时间,多次采取鼠尾尖部血液,每次采血时,将鼠尾剪去很小一段,取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。
也可采用切割尾静脉的方法采血,三根尾势脉可交替切割,并自尾尖向尾根方向切割,每次可取0.2~0.3ml血,切割后用棉球压迫止血。
这种采血方法在大鼠进行较好,可以较长的间隔时间连续取血,进行血常规检查。
(2)眼眶后静脉丛取血:当需中等量的血液,而又需避免动物死亡时采用此法。
用左手固定鼠,尽量捏紧头部皮肤,使头固定,并轻轻向下压迫颈部两侧,引起头部静脉血液回流困难,使眼球充分外突(示眼眶后静脉丛充血),右手持毛细玻璃管,沿内眦眼眶后壁向喉头方向旋转刺入。
刺入深度小鼠2~3mm,大鼠4~5mm。
当感到有阻力时再稍后退,保持水平位,稍加吸引,由于血压的关系,血液即流人玻璃管中。
得到所需的血量后,拨出毛细管。
若手法恰当,小鼠约可采血0.2~0.3ml,大鼠约可采血0.4~0.6ml。
(3)断头取血:当需要较大量的血液,而又不需继续保存动物生命时采用此法。
左手捉持动物,使其头略向下倾,右手持剪刀猛力剪掉鼠头,让血液滴入盛器。
小鼠可采血0.8~1.0ml,大鼠可采用5~8ml。
(4)眶动脉和眶静脉取血:此法既能采取较大量的血液,又可避免断头取血法中因组织液的混入导致溶血的现象,现常取代断头取血法。

(完整)动物全血量及最大注射量
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)动物全血量及最大注射量)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)动物全血量及最大注射量的全部内容。
表12—22 实验动物全血、血浆、红细胞的容量和静脉血比容[61]
注:Pv=血浆容量 VH=红细胞比积 EV=红细胞容量 BV=全血容量
几种动物不同给药途径的最大注射量(ml)。

给动物采血的小技巧1.选择合适的针头尺寸:针头的大小应根据动物的大小和血管的直径来选择。
过大的针头可能会破坏血细胞,过小的针头则可能导致血样太少。
一般来说,对于小动物如小鼠和小鸟,使用26-30G的针头比较合适;对于大动物如狗和猫,可以选择20-23G的针头。
2.寻找适合的采血部位:动物身体上有多个适合采血的部位,如颈部的颈外静脉、前肢的尺动脉或股动脉等。
选择采血部位时应避免静脉血栓形成、血管损伤或出血过多等情况。
在选择具体部位之前,应该根据实验目的、动物种类和个体情况来决定。
3.确保采血部位清洁:在进行采血之前,应该先用适当的消毒剂清洁采血部位,以减少细菌感染的风险。
对于小鼠和小鸟等小动物,可以使用酒精来清洁;对于大动物,可以使用碘酒或氯己定等消毒剂。
4.适当固定动物:为了确保采血过程中的安全性,可以使用适当的方法来固定动物。
这可以包括使用胶带、手指或专门的动物采血架等。
固定动物有助于提供一个稳定的采血部位,减少意外伤害的风险,并提高采血的成功率。
5.使用适当的采血技术:采血的技术根据不同的动物种类和采血部位会有所不同。
例如,对于小鼠,可以通过尾部静脉或眼眶静脉来采集血液,而对于大动物,可以通过针刺静脉或冠状血管来采血。
6.控制采血的速度和压力:在进行采血时,应尽量减少血管破裂、血栓形成和出血过多的风险。
这可以通过控制采血的速度和压力来实现。
一般来说,采血的速度不应过快,以免血液溢出或血栓形成;同时,采血时应控制采血针的进深度,避免穿透血管。
7.及时止血和处理采血部位:在完成采血后,应及时用纱布或棉球轻轻按压采血部位,以止血。
对于较小的动物,可以将动物放置在适当大小的箱子里,以减少动物活动和创伤。
同时,应及时处理采血部位的消毒和护理工作。
8.给动物提供适当的抚慰和补给:采血是一种压力性刺激,会给动物带来一定的疼痛和不适。
为了缓解动物的不适,可以给动物提供适当的抚慰,如温暖和舒适的环境、适当的体温和水分补给等。

大小鼠各种采血方法与最大采血量1 剪尾采血小鼠每次采血量0.1ml,大鼠每次采血量0.3-0.5ml左手拇指和食指从背部抓住鼠颈部皮肤,将鼠头朝下,鼠保定后将其尾巴置于50℃热水中浸泡数分钟,使尾部血管充盈。
擦干尾部,再用剪刀或刀片剪去尾尖1-2mm,用试管接流出的血液,同时自尾根部向尾尖按摩。
取血后用棉球压迫止血并用6%液体火棉胶涂在伤口处止血。
2 摘除眼球采血小鼠采血量0.6-1ml左手抓住小鼠颈部皮肤,轻压在实验台上,取侧卧位,左手食指尽量将小鼠眼周皮肤往颈后压,使眼球突出。
用眼科弯镊迅速夹去眼球,将鼠倒立,用器皿接住流出的血液。
采血完毕立即用纱布压迫止血。
大鼠少用。
3 心脏采血小鼠采血量0.5-0.6ml,大鼠采血量1-1.5ml鼠仰卧位固定,剪去胸前区被毛,皮肤消毒后,用左手食指在左侧第3-4肋间触摸到心搏处,右手持带有4-5号针头的注射器,选择心搏最强处穿刺,当刺中心脏时,血液会自动进入注射器。
4 断头采血小鼠采血0.8-1.2ml,大鼠采血量5-10ml左手拇指和食指从背部抓住鼠颈部皮肤,将鼠头朝下,右手用剪刀剪断鼠颈部约1/2-4/5,让血液流入试管。
5 眼眶静脉丛采血小鼠采血量为0.2-0.3ml,大鼠采血量为0.4-0.6ml取内径为1.0-1.5mm的玻璃毛细管,临用前折断成1~1.5cm长的毛细管段,浸入1%肝素溶液中,干燥后用。
取血时左手抓住鼠两耳之间的颈背部皮肤以固定头部,轻轻向下压迫颈部两侧,引起头部静脉血液回流困难使眼眶静脉丛充血,右手持毛细管由内眦部插入结膜,再轻轻向眼底部方向推进,轻轻旋转毛细管以划破静脉丛,让血液顺毛细管流出,接收入事先准备的容器中。
采血后纱布轻压眼部止血。
小鼠、大鼠、豚鼠及家兔均可采取此法取血。
刺入深度小鼠为2-3mm,可采血0.2-0.3ml;大鼠为4-5mm,可采血0.4-0.6ml。

猪场常用采血方法及其注意事项第一篇:猪场常用采血方法及其注意事项猪场常用采血方法及其注意事项(1)前腔静脉采血:是血清学检测中最常用的采血方法。
该方法采血速度较快,血液的质量高且不易溶血,适合从仔猪到种猪的采血。
保定方法:公母猪用保定绳固定,要求尽可能吊得高一点,使猪的头颈与水平面呈30度以上角度,这样,即方便采血人员察看采血部位,又使前腔静脉向外突出,静脉血充胀。
20kg以上的中大猪,由1-2个饲养员用保定绳拉住,头昂起,偏向右侧;20kg以下的小猪,可由1个饲养员抓起,后肢着地,双腿夹住头部,两手抓住两前肢,也可用倒立法。
猪的前腔静脉,越往头部越浅,但也越细;越靠胸部越粗,但越深。
一般20kg以下的小猪应采两前肢与气管交汇处,公母猪和20kg以上中大猪可选颈部最低凹处,用针垂直刺入。
当针头扎破静脉壁时,可以感觉得到轻微的”卜”的一声。
采血针头:后备猪及种公(母)猪宜选用12号38mm长的针头;30kg以上的中大猪,宜选用9号34mm针头;10-30kg小猪,可选用9号30-32mm(一次性注射器常配的针头);10kg以下乳猪,应选择7-9号28-30mm针头(一次性注射器所配的针头)。
采血量:每头检测4-5项目,一般采3-5mL血液即可。
(2)耳缘静脉采血:除小猪外,可用耳缘静脉采血,该方法由于血管细、血少且血流速度非常慢,采血速度较慢,操作不熟练容易导致溶血。
方法为猪站立保定,助手用力在耳根捏压静脉的近心端,手指轻弹后,用酒精棉球反复涂擦耳静脉使血管怒张,针头朝着耳尖方向沿着血管刺入,缓慢抽取所需血液量。
用干棉球或棉签按压止血。
采血的注意事项:(1)应选好适合的针头进行采血。
(2)采血前先用75%酒精棉球消毒,采用后用干棉球或棉签按压止血。
(3)前腔静脉采血时,不宜连续多次进针,一般不超过3次进针。
(4)经猪耳静脉、前腔静脉采集血3~5毫升,采好后将采血针的栓轻轻后拉一些,使针管内留有一些空间,置室温30分钟,使血液完全凝固。
动物的采血方法动物的采血方法一、小鼠、大鼠的采血1.眼眶后静脉丛采血左手拇指及食指抓住鼠两耳之间的皮肤使鼠固定,并轻轻压迫颈部两侧,阻碍静脉回流,使眼球充分外凸。
右手持玻璃采血管,将其尖端插入内眼角与眼球之间,轻轻向眼底方向刺入,小鼠刺入2~3mm,大鼠刺入4~5mm,当感觉有阻力时即停止刺入,放置取血管以切开静脉丛,血流即流入取血管。
采血结束后,拔出取血管,放松左手,出血即停止。
本方法在短期内可重复采血。
小鼠一次可采血0.2~0.3ml,大鼠一次可采血0.5~1.01ml。
为防止血液在取血管中凝固,可将取血管进入1%肝素溶液,干燥后使用。
2.摘眼球采血此方法用于鼠类大量采血。
采血时,用左手固定动物,压迫眼球,尽量使眼球凸出,右手用弯头镊子摘除眼球,眼眶内很快流出血液。
二、兔的采血1.耳中央动脉、耳沿静脉采血左手固定兔,并用酒精棉球消毒采血部位,右手持注射器,在兔耳血管的末端,沿着与血管平行的向心方向刺入血管,即可见血液流入针管,注意固定好针头。
采血结束后,拔出注射器,用棉球压迫止血2~3min。
2.颈静脉采血将兔麻醉后,仰卧在固定台上固定,剪去一侧颈部被毛,用碘酒、酒精棉球消毒皮肤,手术刀轻轻划破皮肤,钝性分离静脉,颈静脉暴露后,用注射器针头沿血管平行的远心方向刺入,采血结束后,拔出注射器,缝合切口。
三、狗的采血1.前、后肢皮下静脉血此方法一次可取较多的血,操作可参照相应的静脉注射。
如需采少量血。
则可用5.5号针头直接刺入静脉。
如需采一定量的血,最好用静脉滴注针头与注射器连接,以防狗挣扎时针头刺破血管。
2.股动脉采血将狗仰卧后固定,伸展后肢向外拉直,暴露腹股沟,在腹股沟三角区动脉搏动的部位剪去被毛,用碘酒、酒精消毒。
左手中指、食指探摸股动脉搏动部位并固定好血管,右手区静脉滴注针,针头由动脉搏动处慢慢刺入,当血液流入针头后的朔料管时,固定好针头,连接好注射器可抽到大量血液。
3.心脏采血将狗仰卧固定,前肢向背侧方向固定,暴露胸部,剪去左侧第3~5肋间的被毛,用碘酒、酒精消毒皮肤。
实验动物采血完全指南采血方法的选择,决定于实验的目的所需血量以及动物种类。
凡用血量较少的检验如红、白细胞计数、血红蛋白的测定,血液涂片以及酶活性微量分析法等,可刺破组织取毛细血管的血。
当需血量较多时可作静脉采血。
静脉采血时,若需反复多次,应自远离心脏端开始,以免发生栓塞而影响整条静脉。
例如,研究毒物对肺功能的影响、血液酸碱平衡、水盐代谢紊乱,需要比较动、动脉血氧分压、二氧化碳分压和血液pH值以及K+、Na+、CI-离子浓度,必须采取动脉血液。
采血时要注意:⑴采血场所有充足的光线;室温夏季最好保持在25-28℃,冬季,15-20℃为宜;⑵采血用具有采用部位一般需要进行消毒;⑶采血用的注射器和试管必须保持清洁干燥;⑷若需抗凝全血,在注射器或试管内需预先加入抗凝剂.1.取少量血a.尾静脉大鼠、小鼠b.耳静脉兔、狗、猫、猪、山羊、绵羊c.眼底静脉丛兔、大鼠、小鼠d.舌下静脉兔e.腹壁静脉青蛙、蟾蜍f.冠、脚蹼皮下静脉鸡、鸭、鹅2.取中量血a.后肢外侧皮下小隐静脉狗、猴、猫b.前肢内侧皮下头静脉狗、猴、猫c.耳中央动脉兔d.颈静脉狗、猫、兔e.心脏豚鼠、大鼠、小鼠f.断头大鼠、小鼠g.翼下静脉鸡、鸭、鸽、鹅h.颈动脉鸡、鸭、鸽、鹅3.取大量血a.股动脉、颈动脉狗、猴、猫、兔b.心脏狗、猴、猫、兔c.颈静脉马、牛、山羊、绵羊d.摘眼球大鼠、小鼠采动物品种最大安全采血量(ml) 最小致死采血量(ml)小鼠0.2 0.3大鼠 1 2豚鼠 5 10兔10 40狼狗100 500猎狗50 200猴15 601.割(剪)尾采血当所需血量很少时采用本法。
固定动物并露出鼠尾。
将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。
再将尾擦干,用锐器(刀或剪刀)割去尾尖0.3-0.5cm,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。
也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。
附页:实验动物采血方法的收集及优缺点的比较
参考文献:
1. 李晓晶 刘瑾,实验动物采血优缺点比较,《辽宁中医药大学学报》 第11卷 第11期 2009年11月 P217
2. 杨靖亚 实验一实验动物的捉拿和给药途径 上海海洋大学海洋生物制药实验指导 P90-97
3. 李志祥,实验家兔心脏采血技术,《云南畜牧兽医》CNKI:SUN:YNXM.0.1994-03-021
3. 李志祥,实验家兔心脏采血技术,《云南畜牧兽医》
CNKI:SUN:YNXM.0.1994-03-021
4. 张长在,家兔耳缘静脉采血法,《包头医学院学报》
CNKI:SUN:BTYX.0.1999-02-038
5. 姚建华,家兔颈部4中采血方法和采血量比较 《数理医药学杂志》CNKI:SUN:SLYY.0.2005-02-022
制作者:上海海洋大学食品学院(0834110)
合作者:上海海洋大学 生命学院 08生物技术A组
制作日期:2011-4-21。
实验一常用实验动物技术介绍目的了解并熟悉实验动物实验操作的基本方法和技术。
内容注射方法;麻醉方法;动物编号的方法;采血;动物性别鉴定;动物的致死。
学习打结、缝合、固定动物等。
播放录像《太行山猕猴》、《动物的捉拿和给药途径》。
用品大白鼠、小白鼠、蟾蜍、家兔,常用手术器械、注射器、小木锤、大小鼠固定器,戊巴比妥钠,乙醚、士的宁、乙醚、氯仿、氯化钾、一氧化碳、二氧化碳常用实验动物性别鉴定1、大、小鼠的性别鉴定离乳仔鼠性别鉴定主要以生殖器与肛门之间的距离长短及肛门与生殖器有无被毛为标志。
识别要点是:①雄性的生殖器与肛门之间的距离较远,雌鼠较近;②雄性的生殖器与肛门之间有毛;③雄性的生殖器突起较雌鼠大;④雌鼠乳头较雄鼠明显。
成熟后,雄性可见阴囊,雌性乳头明显而易于区分。
2、豚鼠的性别鉴定豚鼠的性别鉴定主要是通过生殖器形态来判断。
雌性外生殖器阴蒂突起比较小,用拇指按住阴蒂突起,余指拨开大阴唇的皱褶,可见阴道口呈”V”形(注意发情间期的闭锁现象,即一种除了发情和分娩时外,关闭阴道口的细胞结构);雄性外生殖器有包皮覆盖的阴茎小隆起,用拇指按住其基部包皮,可见龟头向外突出。
3、兔子的性别鉴定幼兔的性别鉴定主要以尿道开口部与肛门之间的距离及尿道开口部的形状来判别。
哺乳期仔兔,雄性尿道开口部与肛门之间的距离较远,为雌性的1.5-2倍,雌性较近。
雌性尿道开口扁形,大小与肛门同;雄性圆形,略小于肛门。
1月龄仔兔,雄性生殖孔呈圆形,翻出可见呈圆柱体的突起;雌性生殖孔呈Y形,翻出仅见有裂缝,裂缝及于肛门。
3月龄以上成年兔,雄性阴囊明显而雌性无阴囊;雄性头大短而圆而雌性头小略呈长形。
4、猫的性别鉴定幼猫的性别是根据生殖器与肛门的距离来判断。
距离远者为雄性,距离近者为雌性。
5、猴类的性别鉴定猴类性别的区分较为困难。
首先检查尿道开口,许多雌性动物有较大的阴蒂,其腹侧形成沟状通向尿道口,而雄性动物的尿道开口在阴茎头上。
触摸阴囊内是否有睾丸是确定其雌雄的最可靠办法。
不同动物的采血安全及致死量
1.采动物品种最大安全采血量(ml)最小致死采血量采动物品种最大安全采血量(ml) 最小致死采血量(ml)
小鼠0.2 0.3
大鼠 1 2
豚鼠 5 10
兔10 40
狼狗100 500
猎狗50 200
猴15 60
2.眼眶静脉丛采血
1.采血者的左手拇食两指从背部较紧地握住小鼠或大鼠的颈部(大鼠采血需带上纱手套),应防止动物窒息。
当取血时左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血。
右手持续接7号针头的1ml注射器或长颈(3~4cm)硬质玻璃滴管(毛细管内径0.5-1.0mm),使采血器与鼠面成45℃的夹角,由眼内角刺入,针头斜面先向眼球,刺入后再转180度使斜面对着眼眶后界。
刺入浓度,小鼠约2~3mm,大鼠约4~5mm。
当感到有阻力时即停止推进,同时,将针退出约0.1-0.5mm,边退边抽。
若穿刺适当血液能自然流入毛细管中,当得到所需的血量后,即除去加于颈部的压力,同时,将采血器拔出,以防止术后穿刺孔出血。
若技术熟练,用本法短期内可重复采血均无多大困难。
左右两眼轮换更好。
体重20-25g的小鼠每次可采血0.2-0.3m l;体重200-300g大鼠每次可采血0.5-1.0ml,可适用于某些生物化学项目的检验。