硫及其氧化物
- 格式:doc
- 大小:190.00 KB
- 文档页数:7

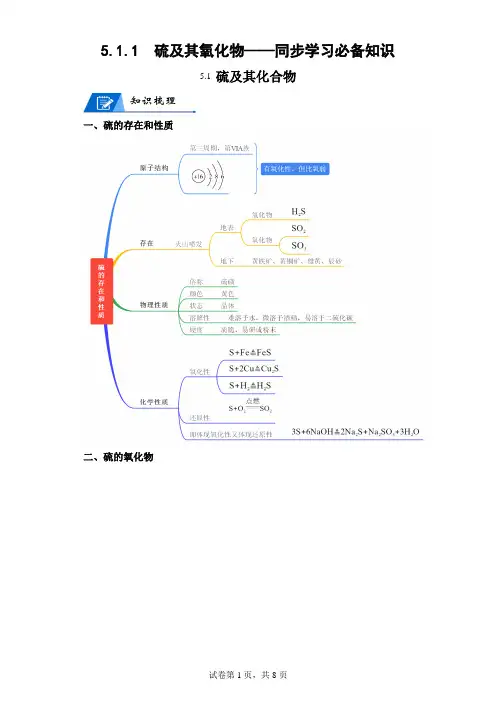
硫及其氧化物一、硫单质【基础知识】1.自然界中硫单质的存在形态游离态:火山喷口附近或地壳的岩层里化合态:主要以氧化物和硫酸盐的形式存在2.硫单质的物理性质硫俗称硫黄,是一种黄色晶体,质脆,易研成粉末,不溶于水,微溶于酒精,易溶于CS2(用于洗涤沾有硫的容器)。
3.硫的同素异形体硫元素有多种同素异形体(由同一种元素组成的不同单质),最常见的是晶状的单斜硫和斜方硫,另外还有S 8、S 6、S 4、S 2等分子存在。
4.硫的结构硫位于第三周期ⅥA 族,最外层有6个电子,在反应中易得到2个电子而呈-2价;硫的最高正价为+6价;单质硫的化合价为0,处于中间价态,故单质硫既有氧化性又有还原性,在反应中既可作氧化剂又可作还原剂。
如 S -2S 0S +4(或 S +6) 5.硫的化学性质 (1)氧化性在加热的条件下,硫能被H 2和绝大多数的金属单质还原。
由于硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。
S+H2H 2S2Na+S Na 2S (易爆炸)(Fe 元素显+2价而不是+3价) 2S (Cu 元素显+1价而不是+2价) (2)还原性在一定条件下,硫可被F 2、O 2、Cl 2等非金属单质以及一些具有氧化性的化合物氧化。
S+O 2SO 2(现象:空气中,淡蓝色火焰;纯氧中,蓝紫色火焰)S+6HNO 3(浓)2SO 4+6NO 2↑+2H 2O S+2H 2SO 4(浓)2↑+2H 2O表现氧化性表现还原性研磨点燃(3)硫在强碱溶液里加热可发生歧化反应(歧化反应:同一种物质中的同一价态的同种元素的原子,在反应中既有升高,又有降低的氧化还原反应;归中反应:同一种元素的不同价态的原子,在反应中,化合价高的降低,化合价低的升高(但是化合价变化互不交叉)的氧化还原反应)SO3+3H2O2S+K2(可用热碱溶液除去试管中残留的硫)(两种方法)(4)特性:Ag、Hg在常温下不跟O2反应,但易跟S反应。


5.1.1 硫及其氧化物——同步学习必备知识5.1硫及其化合物一、硫的存在和性质二、硫的氧化物【例1】1.下列有关硫的性质的叙述正确的是A.淡黄色晶体,不溶于水,易溶于酒精B.质脆易粉碎,易溶于二硫化碳,加热易熔化C.既有氧化性又有还原性,硫与铁粉和铜粉分别反应,都可生成二价金属硫化物D.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3硫单质性质的易错点(1)由于S的氧化性不很强,与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)。
(2)硫单质与O2反应时所得产物与O2的量的多少无关,硫和O2反应不可能直接生成SO3。
2.在一定条件下,下列物质能与硫反应,其中,反应时硫作为还原剂的是A.Cu B.O2C.Fe D.H23.下列物质中,不能由单质直接化合生成的是①CuS ②FeS ③SO 3 ④H 2S ⑤FeCl 2 A .①③⑤B .①②③⑤C .①②④⑤D .全部【例2】4.下列各组两个反应互为可逆反应的是( ) ①2H 2+O 2=点燃2H 2O 与2H 2O =电解2H 2↑+O 2↑ ②H 2SO 4(浓)+2HBr=2H 2O+Br 2+SO 2↑与Br 2+SO 2+2H 2O=2HBr+H 2SO 4 ③2NO 2=N 2O 4与N 2O 4=2NO 2④2SO 2+O 2=∆催化剂2SO 3与2SO 3=∆催化剂2SO 2+O 2A .①②B .②③C .③④D .②④【例3】5.下列说法正确的是A .因为SO 2具有漂白性,所以它能使品红溶液、溴水、KMnO 4(H +)、石蕊溶液褪色B .能使品红溶液褪色的不一定是SO 2C .SO 2、漂白粉、活性炭、Na 2O 2都能使红墨水褪色,其原理相同D .等物质的量的SO 2和Cl 2相遇在溶液中具有漂白能力 【例4】6.为了除去二氧化碳气体中的二氧化硫气体,下列仪器和药品组合合理的是 仪器:①洗气瓶、②干燥管;药品:③固态生石灰、④苏打溶液、⑤饱和小苏打溶液。



硫及其氧化物(一)硫的存在和性质 1.自然界中硫元素的存在2.硫单质俗称硫黄,是一种黄色固体;不溶于水,微溶于酒精,易溶于CS 2;有多种同素异形体,如单斜硫、斜方硫等。
3.从化合价的角度认识硫单质的化学性质(1)S 的氧化性——与变价金属化合为低价硫化物①S 与Fe 、Cu 反应的化学方程式依次为S +Fe=====△FeS 、S +2Cu=====△,Cu 2S 、S +Hg===HgS(此反应适用于除去室内洒落的Hg)。
②S 与H 2化合反应为S +H 2=====△,H 2S 。
(2)S 的还原性①S 与O 2反应的化学方程式为S +O 2=====点燃SO 2,在空气中燃烧火焰为淡蓝色。
②与强氧化剂反应(如浓硫酸)的化学方程式为S +2H 2SO 4(浓)=====△3SO 2↑+2H 2O 。
[注意] ①除去试管内壁黏附的S 可用CS 2溶解除去,也可以用热的NaOH 溶液除去,其反应为3S +6NaOH===2Na 2S +Na 2SO 3+3H 2O 。
①S 燃烧的产物是SO 2,不会生成SO 3。
(二)二氧化硫(SO 2) 1.物理性质二氧化硫是无色、有刺激性气味的有毒气体,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO 2。
2.化学性质按要求完成下列方程式:(1)酸性氧化物的通性⎩⎪⎨⎪⎧与H 2O 反应:SO 2+H 2O H 2SO 3与NaOH (足量)反应:SO 2+2NaOH===Na 2SO 3+H 2O(2)氧化性(如与H 2S 溶液反应):SO 2+2H 2S===3S ↓+2H 2O(4)漂白性:可使品红溶液等有机色质褪色,生成不稳定的化合物。
[注意] ①工业上可利用SO 2来漂白纸浆、毛、丝、草帽辫等,但不能用于食品的增白。
SO 2还用于杀菌、消毒等,可用作干果的防腐剂。
①SO 2不能漂白紫色石蕊溶液,紫色石蕊溶液中通入SO 2变红色。


必修一-第四章-第三节-硫及其氧化物【要点梳理】要点一、硫单质1.硫的存在游离态的硫:存在于火山口附近或地壳的岩层里化合态的硫:主要以硫化物和硫酸盐的形式存在。
如硫铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。
硫还存在于石油、天然气、煤等化石燃料中2.物理性质俗称硫磺,为黄色晶体,质脆,不溶于水,微溶于酒精,易溶于CS23.化学性质由于硫原子最外层有6个电子,是比较活泼的非金属单质,常见化合价为-2、0、+4、+6价。
硫单质处于硫元素的中间价态,既有氧化性又有还原性。
①氧化性:与金属反应:与Fe反应:Fe + S △FeS与Cu反应:2Cu + S △Cu2S (与变价金属生成低价金属)与Na反应:2Na + S = Na2S (研磨会引起轻微爆炸) 与Hg反应:Hg + S = HgS (除去有毒的Hg的方法)与非金属反应(H2):H2 + S △H2S (H2S是一种臭鸡蛋气味的有毒气体,有强还原性)②还原性:与氧气发生反应S + O2点燃SO2(在空气中燃烧淡蓝色的火焰,在氧气中燃烧蓝紫色的火焰)③与碱反应(自身氧化还原反应):3S+6NaOH = 2Na2S+Na2SO3 +3H2O要点二、SO2的性质1.物理性质无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(1:40),易液化(沸点:-10℃)2.化学性质(1)酸性氧化物的通性(与CO2相似)①与H2O反应:SO2 + H2O H2SO3(亚硫酸,二元中强酸,只能存在于水中)②与碱反应:SO2 + 2NaOH = Na2SO3 + H2OSO2 + NaOH = NaHSO3 (SO2 + 2NaOH = Na2SO3 + H2O Na2SO3 + SO2 + H2O = 2NaHSO3) SO2 + Ca(OH)2= CaSO3↓+ H2O (CO2、SO2均可使澄清石灰水变浑浊)SO2 + CaSO3+H2O = Ca(HSO3)2③与碱性氧化物的反应:SO2 + Na2O Na2SO3要点诠释:在煤中加入少量生石灰,用以消除SO2的污染,此方法称为“钙基固硫”,其反应方程式:SO2 + CaO = CaSO3;2CaSO3 + O2△2CaSO4④与酸碱指示剂反应:能使紫色石蕊试液变红色⑤与某些盐反应SO2 + 2NaHCO3= Na2SO3 + H2O + 2CO2↑(亚硫酸酸性强于碳酸)Na2SO3 + SO2 + H2O = 2NaHSO3(2)氧化性和还原性SO2中的S元素化合价为+4价,处于中间价态,既有氧化性、也有还原性,以还原性为主①氧化性:SO2+2H2S = 3S↓+2H2O②还原性:SO2+X2+2H2O = H2SO4+2HX( X2: Cl2 、 Br2 、 I2)5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO42SO2 + O2催化剂加热2SO3SO2 + 2FeCl3 + 2H2O = H2SO4 + 2FeCl2 + 2HClSO2可以被H2O2、Na2O2、HNO3、O3等多种强氧化剂所氧化要点诠释:由于二氧化硫的还原性,在某些反应中,不能完全类比于二氧化碳,例如将二氧化硫通入漂白粉溶液中,反应方程式完全类比于二氧化碳写作SO2 + H2O + Ca(ClO)2= CaSO3↓+2HClO是错误的,因为HClO有强氧化性,CaSO3有强还原性,二者不可能共存(互相伤害)(3)漂白性SO2可以与某些有色的物质(如品红溶液)生成不稳定的无色物质,加热或久置可恢复到原来的颜色3.用途漂白纸浆、毛、丝、草帽辫等,用于杀菌消毒,制取硫酸等要点三、SO2的制备反应原理:Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O说明:此反应是应用强酸制弱酸。
1 / 2
第三讲硫及其氧化物
硫元素在自然界的存在形式
游离态
化合态如:硫铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)
一、硫(硫黄,S)
1. 硫的物理性质
黄色晶体、质脆、易研成粉末
不溶于水、微溶于酒精、易溶于二硫化碳
2. 硫的化学性质
既有氧化性,又有还原性
S + Fe FeS
3Cl2 + 2Fe2FeCl3
S + H2H2S
S + O2SO2
二、二氧化硫(SO2)
1. 二氧化硫的物理性质
无色,有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
2. 二氧化硫的化学性质
(1)酸性氧化物
与H2O反应生成相应的酸:
SO2+H2O
亚硫酸是一种中强酸,不稳定
可逆性: 在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的性质。
可逆反应:可逆性比较显著的化学反应。
【思考】2H2O 2H2 ↑+O2↑与2H2+O2 2H2O 是可逆反应吗?(2)氧化还原反应
Cl2 + SO2 + 2H2O = 2HCl + H2SO4
Cl2 + SO2 + 2H2O = 4H+ + 2Cl- + SO42-
Br2、I2、KMnO4、Fe3+都可以和SO2发生氧化还原反应
2SO2+ O22SO3
SO3 + H2O = H2SO4
2H2SO3 + O2 = 2H2SO4
2CaSO3 + O2 = 2CaSO4
SO2 + 2H2S = 3S↓ + 2H2O
(3)漂白性。
高三硫的氧化物知识点硫的氧化物是指由硫和氧元素组成的化合物,常见的有硫化氢(H2S)、二氧化硫(SO2)和三氧化硫(SO3)。
下面将对这些硫的氧化物的特性、性质以及相关应用进行介绍。
1. 硫化氢(H2S)硫化氢是由硫和氢两个元素组成的化合物,化学式为H2S。
它是一种具有刺激性气味的无色气体,在自然界中存在于一些火山喷发、矿井和一些细菌的代谢过程中。
硫化氢可以被用于工业领域,例如制备化肥、漂白剂等。
此外,由于其具有毒性,硫化氢还被应用于环境保护、污水处理和工业安全领域。
2. 二氧化硫(SO2)二氧化硫是由硫和氧两个元素组成的化合物,化学式为SO2。
它是一种具有刺激性气味的无色气体,在自然界中存在于火山喷发、燃烧和一些工业过程中。
二氧化硫是大气污染的主要来源之一,在工业中主要用于制备硫酸和二硫化碳等化学物质。
此外,它也被用作食品添加剂,例如在葡萄酒生产过程中起到抗氧化和杀菌的作用。
3. 三氧化硫(SO3)三氧化硫是由硫和氧两个元素组成的化合物,化学式为SO3。
它是一种无色液体,可以迅速与水反应生成硫酸。
三氧化硫广泛应用于化工、冶金和制药工业中的硫酸生产过程中。
此外,三氧化硫还可以用于制备硫酸盐和硫酸酯等化学品。
总结:硫的氧化物包括硫化氢、二氧化硫和三氧化硫。
硫化氢是一种具有刺激性气味的无色气体,可应用于化肥制备和环境保护。
二氧化硫是一种具有刺激性气味的无色气体,主要用于硫酸制备和食品添加剂。
三氧化硫是一种无色液体,广泛应用于硫酸生产和制药工业中。
以上是关于高三硫的氧化物知识点的介绍。
通过了解这些知识点,我们可以更好地理解硫的氧化物的特性和应用领域。
在学习化学过程中,深化对硫的氧化物的认识,有助于我们更好地理解化学原理,并能够将其应用于实际生活和工作中。