溶剂限度表
- 格式:pdf
- 大小:327.58 KB
- 文档页数:3

四、附录161、残留溶剂表示方法1.1允许日接触量允许日接触量(permitted daily exposure, PDE)是指某一有机溶剂被允许摄入而不产生毒性的日平均最大剂量,单位为mg/天。
某一具体有机溶剂的PDE值是由不产生反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。
部分有机溶剂的PDE 值见附录。
由于国内目前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。
1.2浓度限度在PDE 表示方法的基础上,为了更加便于计算,引入了浓度限度(%)表示方法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。
部分有机溶剂的浓度限度见附录。
1.3两种表示方法的比较以上两种表示方法在残留溶剂研究中均可行,但需要指出的是,PDE值是绝对值,也就是说无论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;而对于某一具体制剂来说,由于很难确定处方中各活性成分和各辅料的残留溶剂水平,因此以浓度限度来计算更为简便,只要日摄入总量不超过10g,就无需进一步计算。
综合以上情况并考虑目前国内的实际情况,由于大多数药物的日摄入量不会超过10g(包括活性成分和辅料),浓度限度表示方式是目前更为简便可行的。
当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及用法用量计算实际日接触量,并与PDE值比较,如符合限量要求则也属可行。
此外,虽然本指导原则采用浓度限度的表示方式,但由于PDE 值的精确性,药物研发者可采用适当的PDE 值的方式进行残留溶剂研究。

ICHQ3C将残留溶剂分为四类:
1.1类为应避免使用,包括已知的人体致癌物,或者有较大致癌嫌疑,以及环
境危害物,1类溶剂采用浓度限度(ppm)来控制。
2.2类为应限制使用,包括非遗传毒性致癌物质,可能引起神经中毒或畸变等
不可逆毒性的溶剂,可能具有严重但可逆的毒性的溶剂,2类溶剂一般采用PDE(每日允许暴露量)(mg/天)或浓度限度(ppm)控制。
3.3类为低潜在毒性的溶剂,无须制定基于健康的暴露程度,应该由GMP或其
它基于质量的要求进行限度。
4.4类为未知毒性,没有足够毒性资料,使用较少的溶剂,如果使用该类溶剂
需论证合理性。
此外,某些特定的化合物在特定条件下可能被归为更具体的类别。
因此,建议在制定具体的残留溶剂限度时,结合化合物性质和用途,参考最新版残留溶剂指导原则和指导原则附录。

[467]有机挥发性杂质残留溶剂限度根据药典要求,药品中残留溶剂定义:在药物或赋形剂制造或使用过程中,或药物制剂生产过程中残存的有机挥发性物质。
目前制药技术不能完全去除残留溶剂。
药物或赋形剂合成中选择适当的溶剂可提高得率,或获得某些特性如晶型、纯度和溶解性。
因此,合成中所用溶剂有时可能是危险因素。
本章节不包括涉及用于组分的溶剂或溶剂化物。
尽管如此,以上产品仍应标明所含溶剂含量并证明对人体安全。
由于残留溶剂不用于治疗用途,因此应尽可能除去,以符合药物、赋形剂和产品规格要求、GMP或其他质量标准。
药物制剂中所含溶剂不得高于安全性评价规定限度。
众所周知,药物、赋形剂、药物制剂不应含能引起不可逆毒副作用(Ⅰ级,见表1)的残留溶剂,除非证明有很好的风险-效益比。
应对引起次级严重毒副作用的残留溶剂(Ⅱ级,见表2)规定限度,以防止病人发生潜在的不良反应。
理想状态下,应尽可能使用低毒性溶剂(Ⅲ级,见表3)。
本章节所有溶剂列表见附录1。
下述表格及限度并不代表全部。
当医药工业发展需使用其他溶剂情况下,应将新溶剂添加到列表中。
当药物、赋形剂、药物制剂生产和纯化过程中残留已知有机溶剂时,应依法检查溶剂限度。
本限度检查仅检查用于制造和纯化加工所用的溶剂。
虽然制造商可能选择测试药物,我们可采用累积法从制造工艺水平计算产品中残留溶剂。
如残留溶剂计算结果等于或低于本章节规定限度,可不进行残留溶剂检查。
如残留溶剂计算结果高于本章节规定限度,仍需检查残留溶剂限度以确定是否精加工降低了有关溶剂水平至可接受量。
如残留溶剂为制造所用溶剂,必须检查药物制剂残留溶剂限度。
附录2为有关残留溶剂的相关背景资料。
根据安全评估残留溶剂分类国际化学安全机构用术语“可忍受日摄食量”(TDI)描述有毒化学物质残留限度。
世界卫生组织和其他国家和国际卫生机构用术语“可接受日摄食量”(ADI)来描述残留限度。
术语“允许日接触量”(PDE)定义为根据药效学残留溶剂可接受摄入量,避免与ADIs混淆。

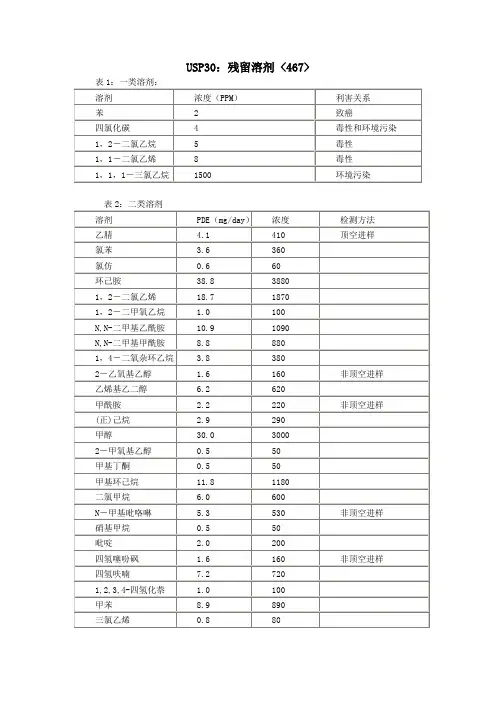
USP30:残留溶剂 <467>一类和二类溶剂(水溶性的物品)程序A:一类残留溶剂标准贮备液:取1.0ml的USP一类残留溶剂混合物RS到100ml的容量瓶中,加入9ml的二甲基亚砜,用水稀释到刻度,混匀。
取1.0ml该溶液到100ml的容量瓶中,用水稀释到刻度,混匀。
取1.0ml该溶液到10ml的容量瓶中,加水稀释到刻度,混匀。
一类残留溶剂标准液:移取1.0ml的一类残留溶剂标准贮备液到合适顶空安瓿瓶中,加5.0ml的水,加塞,加盖,混匀。
二类残留溶剂标准贮备液:取1.0ml的USP二类残留溶剂混合物A(RS)到100ml的容量瓶中,加水稀释到刻度,混匀,制得二类残留溶剂标准储备液A。
取1.0ml的USP二类残留溶剂混合物B(RS)到100ml 的容量瓶中,加水稀释到刻度,混匀,制得二类残留溶剂标准储备液B。
二类残留溶剂A标准液:移取1.0ml的二类残留溶剂标准贮备液A到合适顶空安瓿瓶中,加5.0ml的水,加塞,加盖,混匀。
二类残留溶剂B标准液:移取5.0ml的二类残留溶剂标准贮备液B到合适顶空安瓿瓶中,加1.0ml的水,加塞,加盖,混匀。
测试贮备液:取约250mg的测试品,准确称量,加入25ml的容量瓶中,加水溶解并稀释到刻度,混匀。
测试液:取测试贮备液5.0ml到合适顶空安瓿瓶中,加1.0ml的水,加塞,加盖,混匀。
一类系统适用性溶液:取1.0ml的一类残留溶剂标准贮备液到合适顶空安瓿瓶中,加入5.0ml的测试贮备液,加塞加盖,混匀。
色谱系统<见色谱621>:气相色谱,配制:FID检测器,0.32mm×30mm的炭化硅胶柱,涂布1.8µm厚的G43或0.53mm×30m的广口柱,涂布3µm厚的G43。
载气为氮气或氢气,线速约为35cm/秒,分流比为1:5。
柱温:40℃保持20分钟,然后以10℃/分钟的速度升温至240℃,保持20分钟;进样口和检测器的温度分别为140℃和250℃。
一类溶剂:已知可致癌且对人和环境有害的溶剂,尽可能避免使用(事实上很多大公司如罗氏等已将这些甚至包括某些二类溶剂打入“黑名单”),如果实在无法避免,残留量必须控制在规定限度:苯(2ppm)四氯化碳(4ppm)1,2-二氯乙烷(5ppm)(我注意到隆莱还有使用)1,1-二氯乙烯(8ppm)1,1,1-三氯乙烷(1500ppm)二类溶剂:有动物致癌性的溶剂,按每日允许接触量计算的规定限度如下:乙腈(410ppm)氯苯(360ppm)氯仿(60ppm)(罗氏禁用)环己烷(3880ppm)1,2-二氯乙烯(1870ppm)二氯甲烷(600ppm)1,2-二甲氧乙烷(100ppm)N,N-二甲基乙酰胺(1090ppm)DMF(880ppm)二氧六环(380ppm)2-乙氧基乙醇(160ppm)乙二醇(620ppm)甲酰胺(220ppm)正己烷(290ppm)甲醇(3000ppm)乙二醇甲醚(50ppm)甲丁酮(50ppm)甲基环己烷(1180ppm)N-甲基吡咯烷酮(4840ppm)硝基甲烷(50ppm)吡啶(200ppm)环丁砜(160ppm)1,2,3,4-四氢化萘(100ppm)甲苯(890ppm)1,1,2-三氯乙烯(80ppm)二甲苯(2170ppm)三类溶剂:低毒溶剂,限度为≤0.5%,即5000ppm,如我们常用的乙醇、EA、TBME、丙酮、THF、庚烷、异丙醇等除上述三类溶剂外,还有一些溶剂如我们用过的石油醚、甲基四氢呋喃等尚无毒理资料,必须证明其残留量的合理性。
尤其石油醚,建议今后避免使用,尤其在后道反应最好避免,由于其成分复杂,无法测定准确残留量。
总之,在工艺开发阶段应优先选择三类溶剂,控制二类溶剂,尽量避免一类溶剂的使用。
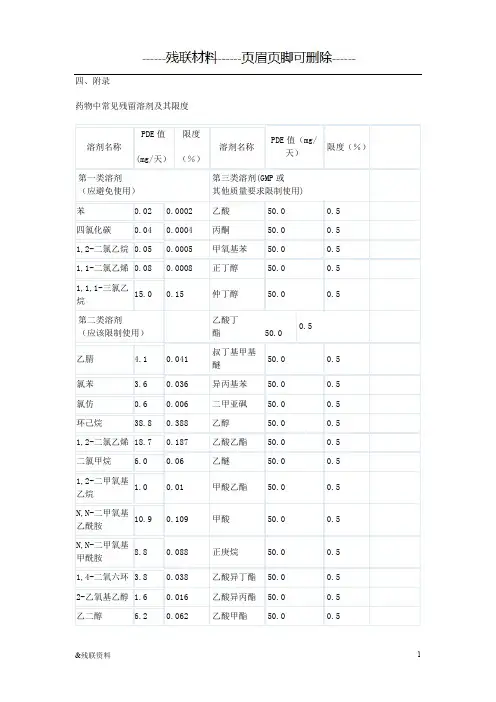
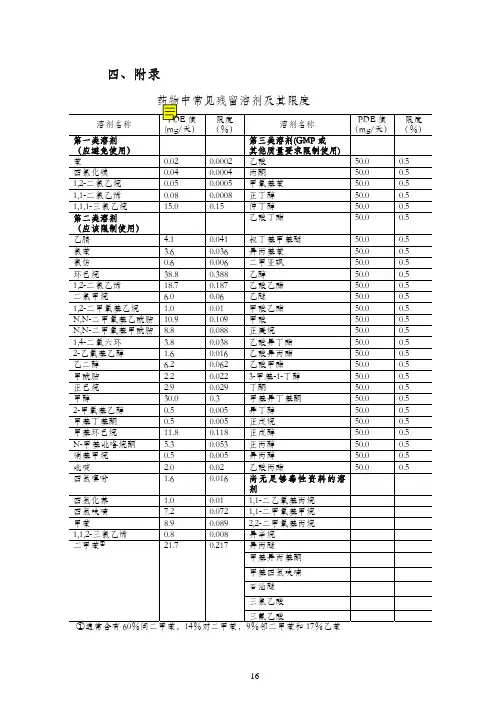
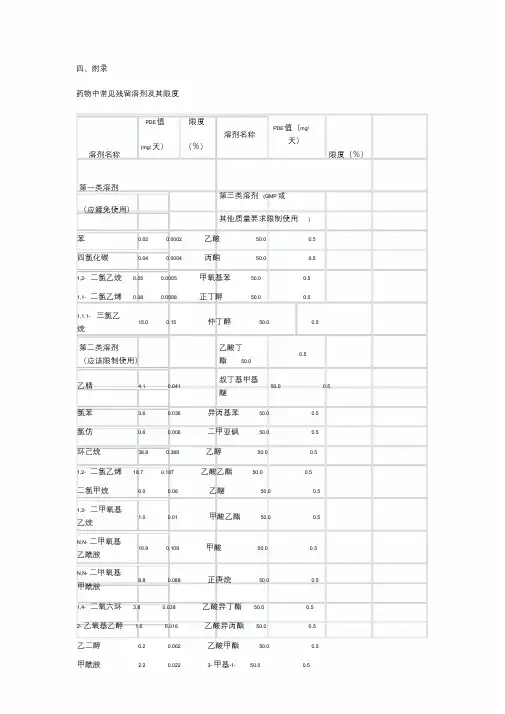
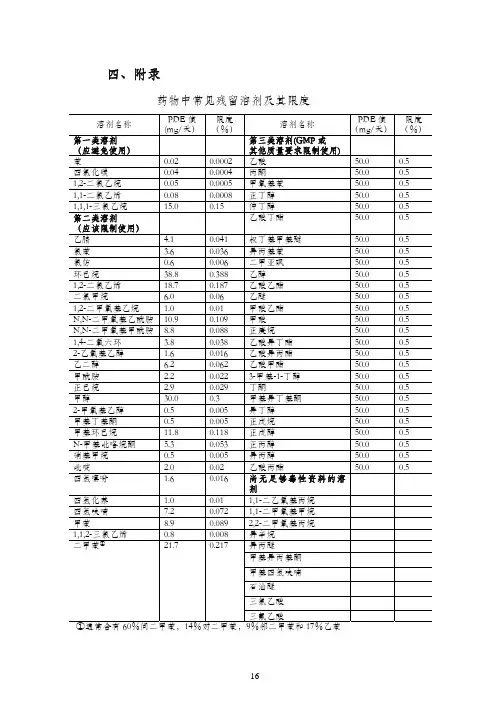
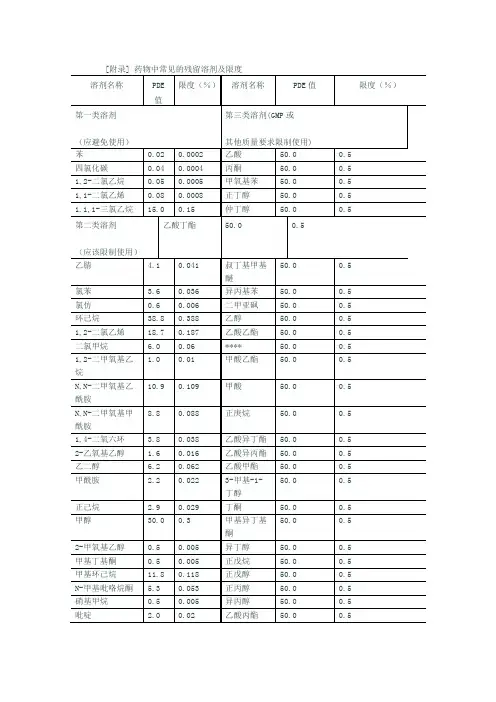
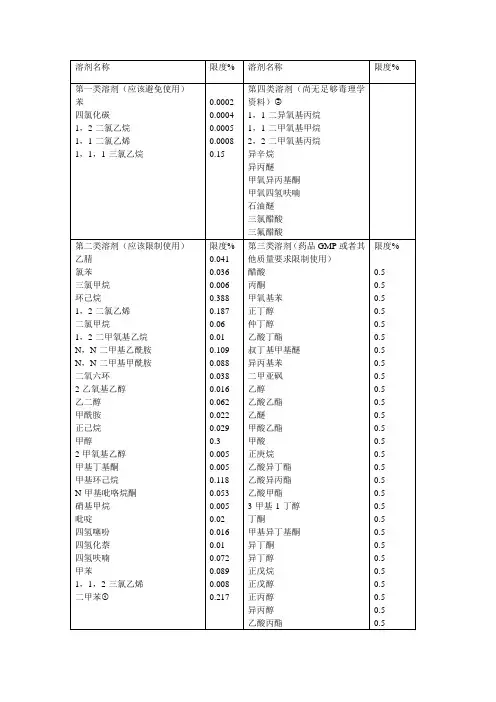
溶剂名称 限度ppm 溶剂名称 限度ppm
第一类溶剂(应避免使用) 第三类溶剂(GMP或其他质量要求限制使)苯 2 乙酸 5000 四氯化碳 4 丙酮 5000 1,2-二氯乙烷 5 甲氧基苯 5000
1,1-二氯乙烯 8 正丁醇 5000
1,1,1-三氯乙烷 1500 仲丁醇 5000
第二类溶剂(应该限制使用) 乙酸丁酯 5000 硝基甲烷 50 叔丁基甲基醚 5000
甲基丁基酮 50 异丙基苯 5000
2-甲氧基乙醇 50 二甲亚砜 5000 氯仿 60 乙醇 5000 1,1,2-三氯乙烯 80 乙酸乙酯 5000
1,2-二甲氧基乙烷 100 乙醚 5000 四氢化萘 100 甲酸乙酯 5000 2-乙氧基乙醇 160 甲酸 5000 四氢噻吩 160 正庚烷 5000
吡啶 200 乙酸异丁酯 5000
甲酰胺 220 乙酸异丙酯 5000
正己烷 290 乙酸甲酯 5000
甲醇 300 3-甲基-1-丁醇 5000
氯苯 360 丁酮 5000 1,4-二氧六环 380 甲基异丁基酮 5000 乙腈 410 异丁醇 5000 N-甲基吡咯烷酮 530 正戊烷 5000 二氯甲烷 600 正戊醇 5000
乙二醇 620 正丙醇 5000
四氢呋喃 720 异丙醇 5000
N,N-二甲氧基甲酰胺 880 乙酸丙酯 5000 甲苯 890 尚无足够毒性资料的溶剂
N,N-二甲氧基乙酰胺 1090 1,1-二乙氧基丙烷 甲基异丙基酮 甲基环己烷 1180 1,1-二甲氧基甲烷 甲基四氢呋喃 1,2-二氯乙烯 1870 2,2-二甲氧基丙烷 石油醚 二甲苯 2170 异辛烷 三氯乙酸
环己烷 3880 异丙醚 三氟乙酸。
467有机挥发性杂质残留溶剂限度在药典中,药品中的残留溶剂系指在原料药或辅料的生产过程中,以及在制剂制备过程中使用过或产生的有机挥发物。
残留溶剂在实际的生产工艺中未能完全去除。
在原料药或辅料合成过程中选择适当的溶剂可以提高产量,或用于测定物质特性,如结晶形态、纯度、可溶性等。
所以,溶剂有时候是合成过程中的关键因素。
本章讨论的溶剂并非辅料,也不是溶剂化物。
但是,药品中的溶剂必须要评价并证明符合要求。
由于残留溶剂没有任何医疗效果,因此应尽可能地去除,使达到原料和成品的规定标准,生产工艺规定以及其它的质量要求。
药品中的残留溶剂的含量不得高于规定的安全范围。
已知会产生严重毒性的溶剂(表1,第一类)在药品原料、辅料和成品的生产中必须避免使用,除非它们严格符合毒性安全评估。
毒性稍低的溶剂(表2,第二类)必须限制含量,从而保护病患免除可能的副作用。
理论上,毒性最低的溶剂(表3,第三类)在实际需要的时候可以使用。
本章讨论的溶剂在附录1中已全部列出。
但这些表格和附录并不全面。
当有关调整部门正式批准同意使用其它溶剂时,这些溶剂可能就要添入表格和目录。
如果已知药品生产或净化过程中存在残留溶剂,那么原料、辅料和成品中必须检测残留溶剂。
但仅需检测在药品生产或净化过程中使用或产生的残留溶剂。
生产厂家可能会选择检测药品成品,但药品各成分的残留溶剂限度都可能需要逐步计算。
若计算的结果低于或在本章规定的范围内,那药品成品就没有必要检测残留溶剂。
但是若计算的结果高于规定范围,那成品就必须检测残留溶剂以确定处方在配制过程是否将有关的溶剂范围降低到可接受的量。
药品生产过程中如果使用了残留溶剂,那成品也必须检测。
见附录2有关残留溶剂的附加资料。
残留溶剂按毒性评估的分类国际化学安全会用“每日容许摄取量”(TDI)来衡量毒性化学药品的接触极限,而世界卫生组织(WHO)与其它国家、国际卫生机构和研究所则使用“每日允许摄取量”(ADI)。
在药品领域中,为了避免同一物质有不同的ADI S,将“每日安全接触量”(PDE)统一规定为残留溶剂的允许摄取量。
USP[467]有机挥发性杂质残留溶剂限度Ⅰ级需避免的溶剂已知人体实验致癌物质;强烈疑似人体实验致癌物质;环境危害物质Ⅱ级需被限制的溶剂动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性;其它疑似重大但可逆毒性Ⅲ级具有低潜在毒性溶剂对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂PDEs上限为≥50mg/天)表1 Ⅰ级残留溶剂溶剂浓度限度(ppm)不良反应苯 2 致癌物四氯化碳 4 中毒和外周脑组织损害1,2-二氯乙烷 5 中毒1,1-二氯乙烷8 中毒1,1,1-三氯乙烷1500 环境危害Ⅱ级残留溶剂表2 Ⅱ级残留溶剂溶剂PDE(mg/天)浓度限度(ppm)乙腈Acetonitrile 4.1 410氯苯Chlorobenzene 3.6 360氯仿Chloroform0.6 60环己烷Cyclohexane38.8 38801,2-二氯乙烯1,2-Dichloroethene18.7 18701,2-二甲氧乙烷 1.0 100N,N-二甲基乙酰胺N,N-Dimethylacetamide10.9 1090N,N-二甲基甲酰胺N,N-Dimethylformamide8.8 8801,4-二氧六环1,4-Dioxane3.8 3802-乙氧基乙醇 1.6 160乙二醇Ethylene glycol 6.2 620甲酰胺Formamide 2.2 220己烷Hexane 2.9 290甲醇Methanol30.0 30002-甲氧基乙醇0.5 50甲基丁基(甲)酮0.5 502-己酮甲基环己烷11.8 1180二氯甲烷 6.0 600N-甲基吡咯烷酮 5.3 530硝酸甲烷0.5 50吡啶 2.0 200环丁砜 1.6 160四氢呋喃7.2 7201,2,3,4-四氢化萘 1.0 100甲苯8.9 890三氯乙烯0.8 80二甲苯* 21.7 2170 *通常含有60%间-二甲苯,14%对-二甲苯,9%邻-二甲苯和17%乙苯Ⅲ级残留溶剂表3 Ⅲ级残留溶剂(GMP或其它原料药、赋形剂和药物制剂质量标准规定)醋酸Acetic acid 庚烷Heptane丙酮Acetone 乙酸异丁酯苯甲醚乙酸异丙酯正丁醇乙酸甲酯2-丁醇3-甲基-1-丁醇乙酸丁酯甲基乙基酮叔丁基甲基醚甲基异丁基酮异丙基苯2-甲基-1-丙醇二甲基亚砜戊烷乙醇1-戊醇乙酸乙酯1-丙醇乙醚2-丙醇甲酸乙酯乙酸丙酯甲酸表4 其它残留溶剂(缺乏足够的毒物学方面的资料)1,1-二乙氧基丙烷甲基异丙基酮1,1-二甲氧基甲烷甲基四氢呋喃2,2-二甲氧基丙烷溶剂己烷异辛烷三氯醋酸异丙醚三氟醋酸除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:有机挥发性杂质限度(μg/g)氯仿601,4-二氧杂环己烷380二氯甲烷600三氯乙烷80附录1 本章节所述残留溶剂表溶剂别名化学结构式级别醋酸乙酸CH3COOH Ⅲ级CH3COCH3 Ⅲ级丙酮2-丙酮,丙醛-2-酮乙腈CH3CN Ⅱ级苯甲醚甲氧基苯Ⅲ级苯安息油Ⅰ级1-丁醇正丁醇,丁基-1-CH3(CH2)3OH Ⅲ级醇CH3CH2CH(OH)CH3 Ⅲ级2-丁醇2-丁基醇,丁基-2-醇醋酸丁酯醋酸丁基醚CH3COO(CH2)3CH3 Ⅲ级叔丁基甲基醚2-甲氧基-2-甲基(CH3)3COCH3 Ⅲ级丙烷四氯化碳四氯甲烷CCl4 Ⅰ级氯苯Ⅱ级氯仿三氯甲烷CHCl3 Ⅱ级枯烯异丙基苯,(1-甲Ⅲ级基乙基)苯环己烷Ⅱ级1,2-二氯乙烷均二氯乙烷CH2ClCH2Cl Ⅰ级1,1-二氯乙烷1,1-二氯乙烯H2C=CCl2 Ⅰ级1,2-二氯乙烷1,2-二氯乙烯ClHC=CHCl Ⅱ级1,2-二甲氧基乙二甲基溶纤剂H3COCH2CH2OCH3 Ⅱ级烷DMA CH3CON(CH3)2 Ⅱ级N,N-二甲基乙酰胺N,N-二甲基甲酰DMF HCON(CH3)2 Ⅱ级胺二甲亚砜DMSO (CH3)2SO Ⅲ级Ⅱ级1,4-二氧杂环己烷乙醇CH3CH2OH Ⅲ级2-乙氧基乙醇溶纤剂CH3CH2OCH2CH2OH Ⅱ级醋酸乙酯CH3COOCH2CH3 Ⅲ级乙二醇1,2-二羟基乙烷HOCH2CH2OH Ⅱ级乙醚二乙基醚CH3CH2OCH2CH3 Ⅲ级甲酸乙酯HCOOCH2CH3 Ⅲ级甲酰胺HCONH2 Ⅱ级甲酸HCOOH Ⅲ级庚烷正庚烷CH3(CH2)5CH3 Ⅲ级己烷正己烷CH3(CH2)4CH3 Ⅱ级醋酸异丁酯CH3COOCH2CH(CH3)2 Ⅲ级醋酸异丙酯CH3COOCH(CH3)2 Ⅲ级甲醇CH3OH Ⅱ级2-甲氧基乙醇甲基溶纤剂CH3OCH2CH2OH Ⅱ级醋酸甲酯CH3COOCH3 Ⅲ级3-甲基-1-丁醇异戊基醇(CH3)2CHCH2CH2OH Ⅲ级甲基丁基(甲)酮2-己酮CH3(CH2)3COCH3 Ⅱ级甲基环己烷Ⅱ级二氯甲烷CH2Cl2 Ⅱ级甲基乙基(甲)酮2-丁酮CH3CH2COCH3 Ⅲ级甲基异丁基(甲)MIBK CH3COCH2CH(CH3)2 Ⅲ级酮2-甲基-1-丙醇异丁基醇(CH3)2CHCH2OH Ⅲ级Ⅱ级N-甲基吡咯烷酮1-甲基-2-吡咯烷酮硝基甲烷CH3NO2 Ⅱ级戊烷正戊烷CH3(CH2)3CH3 Ⅲ级1-戊醇CH3CH2CH2OH Ⅲ级2-戊醇(CH3)2CHOH Ⅲ级醋酸丙酯CH3COOCH2CH2CH3 Ⅲ级吡啶Ⅱ级Ⅱ级环丁砜四氢噻吩1,1-二氧化物四氢呋喃环氧戊烷Ⅱ级Ⅱ级1,2,3,4-四氢化萘甲苯Ⅱ级1,1,1-三氯乙烷甲基氯仿CH3CCl3 Ⅰ级三氯乙烯1,1,2-三氯乙烯HClC=CCl2 Ⅱ级二甲苯* Ⅱ级*通常含有60%间-二甲苯,14%对-二甲苯,9%邻-二甲苯和17%乙苯EP残留溶剂表一.第一类残留溶剂溶剂极限浓度(ppm)涉及苯 2 致癌物质四氯化碳 4 有毒、对环境有害的1,2-二氯乙烷 5 有毒1,1-二氯乙烷8 有毒1,1,1-三氯乙烷1500 环境表二第二类残留溶剂溶剂PDE(mg/天)浓度极限(ppm)乙腈 4.1 410氯苯 3.6 360氯仿0.6 60环己烷38.8 3380 1,2-二氯乙烷18.7 18701,2-二甲氧基乙烷 1.0 100N,N-二甲基乙酰胺10.9 1090N,N-二甲基甲酰胺8.8 8801,4-二氧杂环己烷 3.8 380 2-乙氧基乙醇 1.6 160 乙二醇 6.2 620甲酰胺 2.2 220己烷 2.9 290甲醇30.0 3000 2-甲氧基乙醇0.5 50甲基丁基酮0.5 50甲基环己烷11.8 1180二氯甲烷 6.0 600 N-甲基吡咯烷酮 5.3 530硝基甲烷0.5 50 吡啶 2.0 200环丁砜 1.6 160四氢呋喃7.2 720四氢化奈 1.0 100 甲苯8.9 890 三氯乙烯0.8 80二甲苯* 21.7 2170 *通常含有60%间二甲苯,14%对二甲苯,9%邻二甲苯,和17%乙苯表三第三类残留溶剂(在药品、辅料、药物制剂中受到GMP或其它质量要求的限制)乙酸庚烷丙酮乙酸异丁酯苯甲醚乙酸异丙酯1-丁醇乙酸甲酯2-丁醇3-甲基-1-丁醇乙酸丁酯甲乙酮叔-丁基甲基醚甲异丁酮异丙基苯2-甲基-1-丙醇二甲基亚砜戊烷乙醇1-戊醇乙酸乙酯1-丙醇乙醚2-丙醇甲酸乙酯乙酸丙酯甲酸表四其它残留溶剂(没有充分毒物学数据)1,1-二乙氧基丙烷甲异丁酮1,1-二甲氧基甲烷甲基四氢呋喃2,2-二甲氧基丙烷溶剂已烷异辛烷三氯乙酸异丙醚三氟乙酸附录1 标准中所列的溶剂清单溶剂别名结构分类乙酸醋酸CH3COOH 第三类丙酮2-丙酮CH3COCH3第三类乙腈CH3CN 第二类苯甲醚茴香醚第三类苯安息油第一类1-丁醇丁-1-醇CH3(CH2)3OH 第三类2-丁醇丁-2-醇CH3CH2CH(OH)CH3第三类乙酸丁酯醋酸丁酯CH3CO(CH2)3CH3第三类叔丁基甲醚2-甲氧基-2-甲基(CH3)3COCH3第三类四氯化碳四氯甲烷CCl4第一类氯苯第二类氯仿CHCl3第二类异丙基苯异丙苯(1-甲基乙基)苯第三类环己烷环己胺1,2-二氯乙烷二氯化乙烯CH2ClCH2Cl 第一类1,1-二氯乙烷偏二氯乙烯H2C=CCl2第一类二氯乙烯二氯乙炔ClHC=CHCl 第二类二氯甲烷亚甲基氯CH2Cl21,2-乙二醇二甲醚H3COCH2CH2OCH3第二类NN-二甲基乙酰胺DMA CH3CON(CH3)2第二类NN-二甲基甲酰胺DMF HCON(CH3)2第二类二甲基亚砜DMSO HCON(CH3)2第三类1,4-二氧六环(1,4)二恶烷第二类乙醇CH3CH2OH 第三类二乙氧基乙醇溶纤剂CH3CH2OCH2CH2OH乙酸乙酯醋酸乙酯CH3COOCH2CH3第三类乙二醇1,2-乙二醇HOCH2CH2OH 第二类乙醚二乙醚CH3CH2OCH2CH3第三类甲酸乙酯HCOOCH2CH3第三类甲酰胺HCONH2第二类甲酸HCONH2第三类庚烷n-庚烷CH3(CH2)4CH3第三类正己烷n -正己烷CH3(CH2)4CH3第二类乙酸异丁酯醋酸异丁酯CH3COOCH2CH(CH3)2第三类乙酸异丙酯醋酸异丙酯CH3COOCH(CH3)2第三类甲醇CH3OH二甲醚CH3OCH2CH2OH 第二类乙酸甲酯醋酸甲酯CH3COOCH3第三类异戊醇3-甲基-1-丁醇(CH3)2CHCH2CH2OH 第三类甲丁酮2-己酮CH3(CH2)3COCH3第二类甲基环己烷环己基甲烷第二类丁酮2-丁酮 MEK CH3CH2COCH3第三类丙酮醛MIBK CH3COCH2CH(CH3)2第三类2-甲基-1-丙醇异丁醇(CH3)2CHCH2OH 第三类N-甲基吡咯烷酮第二类硝基甲烷CH3NO2第二类戊烷n-戊烷CH3(CH2)3CH3第三类正戊醇戊乙醇CH3(CH2)3CH2OH 第三类丙醇丙-1-醇CH3CH2CH2OH 第三类2-丙醇丙-2-醇(CH3)2CHOH 第三类丙基乙酸丙基醋酸CH3COOCH2CH2CH3第三类吡啶第二类环丁砜四亚甲基亚砜第二类四氢呋喃氧杂环戊烷第二类四氢萘1,2,3,4-四氢萘第二类甲苯第二类1,1,1-三氯乙烷CH3CCl3第一类1,1,2-三氯乙烯HClC=CCl2第二类二甲苯* 第二类*通常含有60%间二甲苯,14%对二甲苯,9%邻二甲苯,和17%乙苯限度标准一览表:药物中常见残留溶剂及其限度溶剂名称PDE值 (mg/天)限度(%)溶剂名称PDE值 (mg/天)限度(%)第一类溶剂(应该避免使用)第三类溶剂(GMP或其他质量要求限制使用)苯0.0 0.0002 醋酸50.0 0.5 四氯化碳0.0 0.0004 丙酮50.0 0.5 1, 2-二氯乙烷0.1 0.0005 甲氧基苯50.0 0.5CP限度标准一览表:。