什么是析氢过电位
- 格式:docx
- 大小:16.77 KB
- 文档页数:2

析氢过电位是什么意思?就是说,实际的电极反应在进行的时候,会发生阴极电位比理论值低,阳极电位比理论值高的情况,这就叫做过电位.如果阴极析出的是氢气,就叫析氢过电位,析氧过电位也一样.过电位是由于电极的极化而产生的,就是说实际的电极反应已经偏离了理想的电极反应.析氢过电位(一定程度上)可以用塔菲尔常数衡量,塔菲尔常数越大,过电位越大.常见金属塔菲尔常数较大的有Pb1.56,Hg1.41,Zn1.24,Sn1.20等.详细的东西我分两部分讲。
A.电化学有一个很有名的方程叫Nernst(能斯特)方程,大意是电极的电位与电极周围的离子浓度有关,氧化形式的离子浓度越高,或还原形式的离子浓度越低,则电极的电位就越高,反之亦然。
B.实际的电极在工作过程中,会发生偏离理想电极模型的情况,这就叫极化。
电极的极化有两种:1.浓差极化。
由于实际电极反应要消耗附近的溶液的溶质(这是理想电极不考虑的),造成浓度下降,而溶液的浓度扩散不及时,导致电极周围溶液浓度下降。
对析氢电极(阴极),是氧化态浓度下降;对析氧电极(阳极),是还原态浓度下降。
于是由Nernst方程,析氢电位会下降,而析氧电位会上升。
2.活化极化。
由于电极反应并不是如理想中的那样迅速,所以当电位达到理论电位,电极反应的速率却仍然很慢。
要使速率达到可观的水平,必须升高电位,这就叫活化过电位,而这种效果在气体的析出上非常明显。
塔菲尔(Tafel)认为活化过电位η与电流密度i有η=a+blgi的关系,其中a,b叫塔菲尔系数。
不同金属的b值相差不大而a相差明显,因此常以a作为活化过电位大小的判据。
由于过电位的存在,因此在实际的电解操作中,要把这些问题也考虑进去。
比如电解水,理论上O2/H2O的电位是1.23V,但实际上一般需要达到1.36V左右,这就是O2的析出存在活化过电位的结果。

电化学基本概念1. 导体(Conductor):能导电的物质称为导体。
有些导体依靠其中的电子传递电流,称为电子导体或第一类导体(如金属,石墨,PbO2、Fe3O4等金属氧化物);有些导体靠离子的移动来实现其导电任务,称为离子导体或第二类导体(如电解质溶液,熔融电解质,固体电解质)。
一般来说,离子导体的导电能力比电子导体小得多。
2. 电极反应(Electrode Reaction):电子导体能够独立地完成导电任务;而要想让离子导体导电,必须有电子导体与之相连接。
但流经两类导体的电荷载体不一样,为了使电流持续不断地通过离子导体,在两类导体界面上必然会有得电子或失电子的反应发生。
这种在两类导体界面界进行的有电子得失的化学反应称为电极反应或电化学反应。
★自发电池 / 电解池3. 阴极(Cathode):电流通过两类导体界面时,使正电荷从电极进入溶液(发生还原反应)的电极。
4. 阳极(Anode):电流通过两类导体界面时,使正电荷从溶液进入电极(发生氧化反应)的电极。
5. 法拉第(Faraday):一摩尔电子的电量。
摩尔常数N A =6.02×1023;每个电子的电量 e 0 = 1.602×10-19库仑(Coulomb);一库仑为一安培·秒(Ampere-second);所以:1法拉第 = 6.02×1023×1.602×10-19≈96500库仑1法拉第 = 6.02×1023×1.602×10-19÷3600≈26.8安时(Ampere-hour)6. 法拉第定律(Faraday Law):在整个电路中各处的电流是相等的,因此电极上通过的电量与电极反应的反应物和反应产物之间有如下的精确关系:若反应为M z + + z e- = M,则生成1摩尔 M 所需的电量为 z 法拉第。
★法拉第定律成立的前提是:电子导体中不包含离子导电的成分,而离子导体中也不包含电子导电的成分。

析氢反应过电位和析氧反应过电位是指在电化学领域中,电极上发生的氢气和氧气的析出反应所需要的电位能量。
这两个过电位是电解水制氢氧的重要参数,也是研究电解水效率的关键指标。
1. 析氢反应过电位析氢反应是指在阳极上发生的水分子电解制氢气的反应。
在常温下,水的电解需要一个较高的电位才能使水分子发生断裂,从而产生氢气和氢氧离子。
这个较高的电位就是析氢反应的过电位。
析氢反应的过电位受多种因素的影响,例如电解液的组成、电极材料、电解条件等。
通过合理的选择电解质和电极材料,可以降低析氢反应的过电位,提高电解效率,减少能量损耗,实现更经济高效的水电解制氢。
2. 析氧反应过电位析氧反应是指在阴极上发生的水分子电解制氧气的反应。
与析氢反应类似,析氧反应也需要一个较高的电位才能使水分子发生断裂,从而产生氧气和氢氧离子。
与析氢反应不同的是,析氧反应的过电位通常比析氢反应大,这意味着在电解水制氧的过程中需要更多的能量。
降低析氧反应的过电位,提高电解效率,也是提升水电解制氢氧效率的关键。
3. 个人观点和理解在电解水制氢氧的过程中,析氢反应过电位和析氧反应过电位是制约电解效率的重要因素。
通过降低这两个过电位,可以提高电解效率,降低能耗和成本,推动水电解技术向更加经济高效的方向发展。
总结回顾电解水制氢氧是一项具有重要意义的技术,而析氢和析氧反应的过电位则是影响电解效率的关键因素。
通过减小这两个过电位,可以提高电解效率,降低能量损耗,推动水电解技术的发展。
对析氢反应过电位和析氧反应过电位的深入研究和理解,将有助于推动水电解技术的发展和应用。
以上是根据您提供的主题内容撰写的文章,希望能够符合您的需求。
如果还有其他方面需要修改或补充,请随时告诉我。
电解水是指在电化学过程中使用电流将水分解成氢氧的过程。
在这个过程中,析氢反应和析氧反应的过电位是影响电解效率的关键因素。
通常来说,为了提高电解效率,降低能耗和成本,降低析氢和析氧反应的过电位是非常重要的。


各种金属的氢过电位在化学中,氢过电位指的是一种物理量,代表了一种金属在水中或弱酸溶液中,与氢离子结合形成氢气的倾向程度。
当金属的氢过电位比水中的氢离子的还原电位更高时,金属会被电化学反应中的氢离子还原,从而被溶解。
氢过电位对于金属的腐蚀和防护等相关行业十分重要,下面将对几种金属的氢过电位进行粗略介绍。
镍(Ni)镍是一种优良的耐腐蚀材料,其氢过电位较高,可达-0.25V。
因此,镍可在酸碱环境下常年使用,并广泛用于冶金、冶炼、化工、制药等行业。
另外,镍还被广泛用于合金材料和电镀技术中。
铜(Cu)铜是另一种重要的金属材料,其氢过电位约为-0.34V。
铜广泛用于制作电线、电缆、地铁轨道、建筑外墙装饰等行业,而且在机械加工和电子行业中也很有用。
铝(Al)铝是一种轻便而坚固的材料,具有许多良好的性质,如导电、导热、抗腐蚀和可塑性等。
它的氢过电位约为-1.66V,比较低,但这并不影响其在航空、轨道交通、建筑等领域中的广泛应用。
锌(Zn)锌是常用的金属材料之一,其氢过电位为-0.76V,低于铜和镍,但高于铁。
锌在防腐蚀、合金材料、电池、家用电器等领域有着广泛的应用。
铁(Fe)铁是一种广泛使用的金属,其氢过电位为-0.44V。
虽然相对其他金属,它的氢过电位较低,但是在建筑物、轨道交通和汽车制造等领域中仍然有着重要的作用。
不过,铁的腐蚀性比较强,因此要对其进行保护,尤其是在潮湿环境下。
以上是几种常见金属的氢过电位介绍,有需要的读者可以在实际应用中了解更多详细信息。
在金属选择和腐蚀防护等方面,了解金属的氢过电位是非常有用的,可以帮助避免不必要的损失和其他问题。

pt的析氢过电位Pt的析氢过电位引言:析氢过电位是指在电化学过程中,金属表面发生氢气析出的能力所需的电势差。
Pt是一种常用的催化剂材料,具有较低的析氢过电位,因此被广泛应用于氢能源领域。
本文将从Pt的析氢过电位的定义、影响因素以及应用等方面进行阐述。
一、析氢过电位的定义析氢过电位是金属表面发生氢气析出的能力所需的电势差。
在电化学反应中,当金属表面达到一定的电位时,水分子中的氢离子被还原生成氢气。
析氢过电位可以用来评估催化剂的催化活性和稳定性。
二、影响析氢过电位的因素1. 催化剂的材料:不同的金属材料具有不同的析氢过电位。
Pt是一种常用的催化剂材料,具有较低的析氢过电位,因此在氢能源领域得到了广泛应用。
2. 催化剂的表面形貌:催化剂的表面形貌对析氢过电位有着重要的影响。
高度分散的Pt催化剂具有较大的表面积,能够提供更多的催化活性位点,从而降低析氢过电位。
3. 催化剂的晶面结构:催化剂的晶面结构也对析氢过电位有一定的影响。
某些晶面结构具有较高的析氢过电位,而其他晶面结构则具有较低的析氢过电位。
4. 催化剂的电子结构:催化剂的电子结构决定了其对氢气析出反应的催化活性。
Pt具有较好的电子传导性和电子亲和力,能够有效地促进氢气析出反应。
三、Pt的析氢过电位的应用1. 燃料电池:燃料电池是一种将氢气和氧气直接转化为电能的装置。
Pt被广泛应用于燃料电池的阴极催化层,用于促进氢气的析出反应。
2. 氢气产生:水电解是一种常用的制备氢气的方法。
Pt催化剂可以作为电解池的阳极材料,降低析氢过电位,提高水电解的效率。
3. 氢能储存:氢气是一种理想的能源储存介质,可以通过吸附在催化剂表面的方式进行储存。
Pt催化剂具有较低的析氢过电位,可以有效地催化氢气的吸附和解吸过程。
结论:Pt具有较低的析氢过电位,是一种常用的催化剂材料,广泛应用于氢能源领域。
析氢过电位的大小受多种因素影响,包括催化剂的材料、表面形貌、晶面结构和电子结构等。


![[物理]第四章析氢腐蚀与吸氧腐蚀](https://uimg.taocdn.com/77bcf7d2ba4cf7ec4afe04a1b0717fd5360cb2f7.webp)

1.腐蚀:⑴材料的腐蚀:指材料体系与环境之间发生作用而导致材料的破坏或变质的现象⑵金属材料的腐蚀:金属受到环境的高温化学氧化、电化学溶解等作用,使金属单质变为化合物(冶金的逆过程),导致金属受到损失和破坏的现象自然条件下,金属总是存在着自发回归低能稳定态的倾向——与周围介质(通常为氧)反应形成低能态的化合物,在这个过程中,金属失去电子被氧化,发生腐蚀,因此可以将金属腐蚀理解为冶金的逆过程⑶非金属材料的腐蚀:非金属受到环境的化学或物理作用,导致非金属构件变质或破坏的现象。
2.材料体系与环境的作用包括化学反应、电化学反应、物理溶解等。
3.金属及其合金的腐蚀主要是化学和电化学作用引起的破坏,有时伴随有机械、物理或生物作用。
4.材料的破坏:材料的重量损失、开裂、穿孔、溶解、溶胀等。
材料的变质:材料的服役性能变差,如力学强度下降,弹性降低、韧性减小、脆性增大。
5.金属腐蚀:⑴危害:①腐蚀造成重大的直接经济损失②间接经济损失③人身伤亡和环境污染④阻碍了科学技术的发展⑵控制方法:①合理的结构设计②正确选材和发展新型耐蚀材料③研究可行的表面处理工艺④改善环境和使用合适的缓蚀剂⑤电化学保护⑶有利的一面:①电化学加工②制备信息硬件的印刷线路③腐蚀金相试样6.腐蚀分类:⑴按照腐蚀环境:干燥气体腐蚀(干腐蚀)、电解液中的腐蚀、非电解质中的腐蚀、熔融金属的腐蚀(物理腐蚀)⑵按照腐蚀机理:化学腐蚀(化学腐蚀是指金属表面与非电解质直接发生化学反应而引起的破坏)、电化学腐蚀(金属的电化学腐蚀指的是金属在水溶液中与离子导电的电解质发生电化学反应产生的破坏)⑶按照腐蚀形态:①普遍性(全面)腐蚀:全面腐蚀是指发生在金属表面的全部或大部损坏,也称普遍性腐蚀②局部腐蚀:局部腐蚀是指只发生在金属表面的狭小区域的破坏。
其危害性比均匀腐蚀严重得多分类:小孔腐蚀(又称坑蚀和点蚀,在金属表面上极个别的区域被产生小而深的孔蚀现象)、缝隙腐蚀(在电解液中金属与金属或金属与非金属表面之间构成狭窄的缝隙,缝隙内离子的移动受到了阻滞,形成浓差电池,从而使金属局部破坏的现象)、电偶腐蚀(两种电极电位不同的金属或合金互相接触,并在一定的介质中发生电化学反应,使电位较负的金属发生加速破坏的现象)、晶间腐蚀(金属在特定的腐蚀介质中,沿着材料的晶界出现的腐蚀,使晶粒之间丧失结合力的一种局部破坏现象)、选择性腐蚀(多元合金在腐蚀介质中,较活泼的组分优先溶解,结果造成材料强度大大下降的现象)③应力作用下的腐蚀断裂:应力腐蚀是金属在特定的介质中和在静拉伸应力(包括外加载荷、热应力、冷加工、热加工、焊接等所引起的残余应力等)下,所出现的低于强度极限的脆性开裂现象磨损腐蚀:是由机械因素(湍流、漩涡、多相流体冲击、空化作用、微振摩擦等)和腐蚀介质联合作用而产生的金属材料破坏现象7.阳极反应:金属原子从金属转移到介质中并放出电子的过程,即氧化过程。
第一章 金属与合金的高温氧化1、 金属氧化膜具有保护作用的的充分条件与必要条件充分条件:膜要致密、连续、无孔洞,晶体缺陷少;稳定性好,蒸汽压低,熔点高;膜与基体的附着能力强,不易脱落;生长内应力小;与金属基体具有相近热膨胀系数;膜的自愈能力强。
必要条件:氧化时生成的金属氧化膜的体积与生成这些氧化膜所消耗的金属的体积之比必须大于1,即PBR值大于1.2、 说出几种主要的恒温氧化动力学规律,并分别说明其意义。
(1) 直线规律:符合这种规律的金属在氧化时,氧化膜疏松,易脱落,即不具有保护性,或者在反应期间生成气相或者液相产物离开了金属表面,或者在氧化初期氧化膜很薄时,其氧化速度直线由形成氧化物的化学反应速度决定,因此其氧化速度恒定不变,符合直线规律。
(2) 抛物线规律:许多金属或者合金在较高的高温氧化时,其表面可形成致密的固态氧化物膜,氧化速度与膜的厚度成反比,即其氧化动力学符合这种规律。
(3) 立方规律:在一定温度范围内,一些金属的氧化物膜符合这种规律。
(4) 对数和反对数规律:许多金属在温度低于300-400摄氏度氧化时,其反应一开始很快,但是随后就降到了氧化速度可以忽略的程度,该行为符合对数或反对数规律。
3、 说出三种以上能提高钢抗高温氧化的元素 镍,铝,钛4.、纯NI在1000摄氏度氧气氛中遵循抛物线氧化规律,常数k=39X10-12 cm2/s,如果这种关系不受氧化膜厚度的影响,试计算使0.1cm厚镍板全部氧化所需的时间。
解:由抛物线规律可知:厚度y与时间t存在如下关系: y2=kt, t=y2/k=2.56x108s5 哈菲价法则:当基体氧化膜为P型半导体时,往基体中加入比基体原子低价的合金元素,使离子空穴浓度降低,提高电子浓度,结果导致电导率增加,而氧化速率降低,往基体中比此基体原子高价的合金元素,使离子空穴浓度提高,降低电子浓度,结果导致电导率降低,而氧化速度提高。
当基体氧化膜为n型半导体时,往基体中加入比基体原子低价的合金元素,使电子浓度降低,电导率降低,而基体离子浓度增加,氧化速度增加,往基体中加入比基体原子高价的合金元素,使电子浓度增加,电导率增加,而基体离子浓度降低,氧化速度降低。
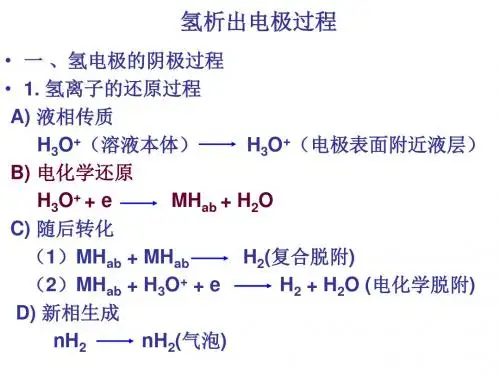
什么是析氢过电位,和析氧过电位,有什么用?
能够给我讲清楚电吗,机理,为什么析氢过电位会略低,析氧过电位会略高,这样与电解有什么关系吗?
实际的电极反应在进行的时候,会发生阴极电位比理论值低,阳极电位比理论值高的情况,这就叫做过电位.如果阴极析出的是氢气,就叫析氢过电位,析氧过电位也一样.过电位是由于电极的极化而产生的,就是说实际的电极反应已经偏离了理想的电极反应.
析氢过电位(一定程度上)可以用塔菲尔常数衡量,塔菲尔常数越大,过电位越大.常见金属塔菲尔常数较大的有Pb1.56,Hg1.41,Zn1.24,Sn1.20等.
详细的东西我分两部分讲。
A.电化学有一个很有名的方程叫Nernst(能斯特)方程,大意是电极的电位与电极周围的离子浓度有关,氧化形式的离子浓度越高,或还原形式的离子浓度越低,则电极的电位就越高,反之亦然。
B.实际的电极在工作过程中,会发生偏离理想电极模型的情况,这就叫极化。
电极的极化有两种:
1.浓差极化。
由于实际电极反应要消耗附近的溶液的溶质(这是理想电极不考虑的),造成浓度下降,而溶液的浓度扩散不及时,导致电极周围溶液浓度下降。
对析氢电极(阴极),是氧化态浓度下降;对析氧电极(阳极),是还原态浓度下降。
于是由Nernst方程,析氢电位会下降,而析氧电位会上升。
2.活化极化。
由于电极反应并不是如理想中的那样迅速,所以当电位达到理论电位,电极反应的速率却仍然很慢。
要使速率达到可观的水平,必须升高电位,这就叫活化过电位,而这种效果在气体的析出上非常明显。
塔菲尔(Tafel)认为活化过电位η与电流密度i有η=a+blgi的关系,其中a,b叫塔菲尔系数。
不同金属的b值相差不大而a相差明显,因此常以a作为活化过电位大小的判据。
由于过电位的存在,因此在实际的电解操作中,要把这些问题也考虑进去。
比如电解水,理论上O2/H2O的电位是1.23V,但实际上一般需要达到1.36V左右,这就是O2的析出存在活化过电位的结果
自腐蚀电位(Ecorr)是一个特定的腐蚀体系在没有外加电流的情况下测得的金属电位。
Ecorr负值越大,腐蚀倾向越大;其正值越大,腐蚀倾向越小。
在电解池中,析氢是还原反应,析氧是氧化反应,当电极电势越负时,电子能量越高,电子越容易从电极迁移至溶液,析氢越容易发生。
同理,电极电势越正,电子能量低,电子从溶液转移至电极,析氧越容易发生。
故析氢电位越负,越容易析氢;析氧电位越正,越容易析氧。