高一化学离子反应(1)
- 格式:pdf
- 大小:1.10 MB
- 文档页数:9

高一化学必修1:离子反应方程式整理(全)1. 离子反应方程式基础离子反应方程式是描述离子在化学反应中参与的过程和生成物的方程式。
在离子反应方程式中,正离子和负离子交换或结合形成新的化合物。
2. 离子反应方程式的写法离子反应方程式的写法包括离子的符号和配平系数。
2.1 正离子符号正离子的符号通常采用元素的化学符号,例如:- 钠离子:Na+- 铝离子:Al3+- 铵离子:NH4+2.2 负离子符号负离子的符号通常采用元素本身的符号加上负号,例如:- 氯离子:Cl-- 氧离子:O2-2.3 配平系数离子反应方程式中的配平系数用于平衡反应方程式。
配平系数表示反应物和生成物的摩尔比例关系。
3. 离子反应方程式的例子以下是一些常见的离子反应方程式例子:3.1 酸和金属反应的离子方程式酸和金属反应时,氢气和相应的金属盐会生成。
例如:2HCl + Zn -> ZnCl2 + H23.2 酸和碱反应的离子方程式酸和碱反应时,盐和水会生成。
例如:HCl + NaOH -> NaCl + H2O3.3 氯化物和银离子反应的离子方程式氯化物和银离子反应时,生成相应的沉淀物。
例如:AgNO3 + NaCl -> AgCl↓ + NaNO3(注:↓表示沉淀物)4. 总结离子反应方程式是描述离子在化学反应中参与的过程和生成物的方程式。
了解离子反应方程式的基础知识,包括离子的符号和配平系数,可以帮助我们更好地理解化学反应的过程和结果。
以上是关于高一化学必修1中离子反应方程式的整理,希望对你的学习有所帮助。

1、钠单质与水反应:2Na + 2H2O = 2Na+ + OH- + H2↑2、过氧根离子与水反应:2O22- + 2H2O = 4OH- + O2↑3、过氧根离子与二氧化碳反应:2O22- + 2CO2 = 2CO32- + O24、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑5、铝与强碱性溶液反应:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑6、氧化钙与水反应:CaO + H2O = Ca2+ + 2OH-7、氧化铁与酸反应:Fe2O3 + 6H+ = 2Fe3+ + 3H2O8、氧化铝与酸反应:Al2O3 + 6H+ = 2Al3+ + 3H2O9、氧化铝与强碱性溶液反应:Al2O3 + 2OH- = 2AlO2- + H2O10、三价铁离子与氢氧根离子反应:Fe3+ + 3OH- = Fe(OH)3↓11、二价铁离子与氢氧根离子反应:Fe2+ + 2OH- = Fe(OH)2↓12、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)313、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O(g)↑14、实验室制取氢氧化铝:2Al3+ + 6NH3•H2O = 2Al(OH)3↓ + 6NH4+15、氢氧化铝与酸反应:Al(OH)3 + 3H+ = Al3+ + 3H2O16、氢氧化铝与强碱性溶液反应:Al(OH)3 + OH- = AlO2- + 2H2O17、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O18、三价铁离子与铁单质反应:2Fe3+ + Fe = 3Fe2+19、二价铁离子与氯气反应:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-20、氯气与铁单质反应:2Fe + 3Cl2 点燃2Fe3+ + 6Cl-21、氯气与金属铜反应:Cu + Cl2 点燃Cu2+ + 2Cl-22、氯气与金属钠反应:2Na + Cl2 点燃2Na+ + 2Cl-23、氯气与水反应:Cl2 + H2O = H+ + Cl- + HClO↑24、次氯酸光照分解:2HClO 光2H+ + Cl- + O225、氯气与氢氧根离子反应:Cl2 + 2OH- = Cl- + ClO- + H2O26、氯离子与银离子反应:Cl- + Ag+ = AgCl↓27、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO↑28、二氧化氮与水反应:3NO2 + H2O = 2H+ + 2NO3- + NO29、三氧化硫与水反应:SO3 + H2O = 2H+ + SO42-30、铵根离子与氢氧根离子反应:NH4 + OH- △NH3↑ + H2O31、二氧化硫与氢氧化钙的反应:SO2 + Ca2+ + 2OH- = CaSO3↓ + H2O32、二氧化硫与氯气的反应SO2 + Cl2 + 2H2O = 2H+ + 2Cl- + H2+ + SO42-33、亚硫酸与硫化氢的反应:H2SO3 + 4H+ + 2S2- = 3S + 2H2O34、NO、NO2的回收:NO2 + NO + 2OH- = 2NO2- + H2O补充初中的:35、硫酸根离子的检验: Ba2+ + SO42- = BaSO4↓36、碳酸根离子的检验: CaC2+ + CO32- = CaCO3↓37、碳酸钠与酸反应: CO32- + 2H+ = H2O + CO2↑38、铁单质与二价铜离子反应: Fe + Cu2+ = Fe2+ + Cu39、钙离子与碳酸根离子反应:Ca2+ + CO32- = CaCO3↓一些学习方法:一、难溶物不拆例l:向碳酸钙中加入过量盐酸。

高一化学必修一离子反应知识点高一化学必修一离子反应知识点(一)?电解质和非电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
(2)非电解质:在水溶液里和熔融状态下都不导电的化合物。
(3)强电解质:在水溶液里全部电离成离子的电解质,大多数盐强酸、强碱是强电解质。
(4)弱电解质:在水溶液里只有部分电离成离子的电解质,弱酸、弱碱、水是弱电解质。
?电离(1)概念:电解质在水溶液中或熔融状态下解离成自由移动的阴、阳离子的过程称为电离。
(2)电离方程式:电离方程式在书写时要遵循质量守恒和电荷守恒,书写时强电解质连接符用“可逆号”,弱电解质连接符用“一”。
(3)从电离的角度认识酸、碱、盐①酸:电离时生成的阳离子全部是H的化合物。
②碱;电离时生成的阴离子全部是OH的化合物。
③盐:电离时能生成金属阳离子(或NH4+ )和酸根阴离子的化合物。
?离子反应(1)离子反应:在溶液中有离子参加的反应称为离子反应。
(2)离子反应发生的条件:有难溶物质、难电离物质或挥发性物质生成。
(3)离子方程式①概念:用实际参加反应的离子符号来表示反应的式子。
②书写步骤:可概括为四个字,即“写”“拆“删”“查”。
③意义:表示某一个具体的化学反应,表示同一类型的离子反应。
(4)离子方程式正误的判断(5)溶液中离子的共存问题知识1电解质和非电解质问题1:不是电解质的物质定是非电解质吗?不一定最据化合物在水溶液中或端融状态下能香导电,将化合物分为电邮解质和非电解质、即电解质和非电解质是针对化合物而言的,判断物质是电解质还是非电为化合物。
单质和混合物不属于化合物,它们既不是电解质也不是非电解质。
因此,不是电解质解质的前提条件是物质的物质不一定是非电解质,正确的说法是”不是电解质的化合物定是非电解质”。
问题2:在水溶液中能导电的化合物定是电解质吗?电解质在熔触状态下一定能导电吗?不一定。
只有在水溶液中或熔融状态时自身电离成自由离子而导电的化合物才是电解质。



化学离子反应【1】一.选择题1.已知某酸性溶液中含有Ba2+、Mg2+,则下述离子组中能与上述离子共存的是()A.CO32-、Cl- B.NO3-、Cl- C.NO3-、SO42- D.OH-、NO3-2.在强碱性溶液中,下列各组离子能大量共存的是()A.Na+、 K+、CO32-、Cl-B.Cu2+、 Na+、NO3-、SO42-C.Na+、 K+、HCO3-、Cl-D.Mg2+、 Na+、NO3-、Cl-3.一种无色溶液中加入BaCl2溶液,生成不溶于硝酸的白色沉淀,则该溶液中()A.一定含有 SO42- B.一定含有 CO32-C.一定含Ag+D.可能含有 SO42-,也可能含有Ag+ 4.下列可以大量共存且溶液是无色的离子组是()A.H+,Na+,NO3-,MnO4-B.Fe2+,Mg2+,Cl-,SO42-C.H+,K+,OH-,NO3-D.NO3-,SO42-,K+,Mg2+5.巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是()A.Al3+、CH3COO-、Cl-B.Mg2+、Ba2+、Br-C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-6.下列电离方程式中,错误的是()A.NaHCO3 == Na++HCO3- B.H2SO4 == 2H++SO42-C.NaHS==Na++H++S2-D.NaHSO4==Na++H++SO42-7.下列物质的水溶液能导电,但属于非电解质的是()A.HClOB. Cl2C. NaHCO3D. CO28.能用H++OH-= H2O表示的是()A.NaOH溶液和CO2的反应B.Ba(OH)2溶液和稀H2SO4的反应C.NaOH溶液和盐酸反应D.氨水和稀H2SO4的反应9. 不能用离子方程式:CO32-+2H+=H2O+CO2↑来表示的反应是()A.BaCO3+HCl B.K2CO3+H2SO4 C.Na2CO3+HNO3 D.(NH4)2CO3+HCl 10.下列反应完成后没有沉淀的是()A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOHB.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4C.AgNO3溶液与Na2CO3溶液加足量稀HClD.AgNO3溶液与FeCl3溶液加足量稀HNO311.下列离子方程式书写正确的是()A.碳酸钙与盐酸反应:CO32-+2H+==CO2↑+H2OB.硫酸和氯化钡溶液反应:Ba2++SO42-==BaSO4↓C.氢氧化钠和硫酸反应:2OH-+H2SO4==SO42—+2H2OD.铁钉放入硫酸铜溶液中:Fe+3Cu2+==2Fe3++3Cu二.填空题(写出下列反应的离子方程式)12.铜片溶于稀硝酸:13.氯气被氢氧化钠溶液吸收:14.亚硫酸钠溶液加入溴水中:15.FeCl3溶液中加入铜片_____________________________________________16.Cl2通入水中__________________________________________________17.漂白粉投入水中,再通入CO2气体_________________________________________________18.电解饱和食盐水_________________________________________________三.推断题19.某溶液可能含下列阴离子:Cl-、SO42-、SO32-、S2-、CO32-的溶液:(1)若溶液中显强酸性,不能大量共存的离子是_______________。

精心整理
高一化学必修一知识点:离子反应
高一化学必修一知识点:离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电
具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
、Ag
H+和
H+和OH-
注意:
题干中的条件:
如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式。

离子反应和离子方程式(一)离子反应 1、离子反应的概念 在反应中有离子参加或有离子生成的反应称为离子反应。
在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。
因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。
2、离子反应的特点离子反应的反应速率快,相应离子间的反应不受其它离子的干扰。
3、离子反应的类型 (1)离子互换反应 在溶液中酸、碱、盐之间互相交换离子的反应,一般为非氧化还原反应。
(2)离子互换反应发生的条件 ①生成难溶的物质。
如生成BaSO 4、AgCl 、CaCO 3等。
②生成难电离的物质。
如生成CH 3COOH 、H 2O 、NH 3·H 2O 、HClO 等。
③生成挥发性物质。
如生成CO 2、SO 2、H 2S 等。
只要具备上述三个条件中的一个,离子互换反应即可发生。
这是由于溶液中离子间相互作用生成难溶物质、难电离物质、易挥发物质时,都可使溶液中某几种、自由移动离子浓度减小的缘故。
若不能使某几种自由移动离子浓度减小时,则该离子反应不能发生。
如KNO 3溶液与NaCl 溶液混合后,因无难溶物质、难电离物质、易挥发物质生成,Na +、Cl -、K +、NO 3-浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
(3)有离子参加的氧化还原反应 ①置换反应的离子反应:金属单质与金属阳离子之间的置换反应,如Fe 与CuSO 4溶液的反应,实际上是Fe 与Cu 2+之间的置换反应。
非金属单质与非金属阴离子之间的置换反应,如Cl 2与NaBr 溶液的反应,实际上是Cl 2与Br -之间的置换反应。
②其它一些有离子参加的氧化还原反应:如MnO 2与浓HCl 反应制取Cl 2;Cu 与FeCl 3溶液反应生成FeCl 2、CuCl 2;Cl 2与NaOH 溶液反应生成NaCl 、NaClO 和水等。
这些离子反应发生的条件是:比较强的氧化剂和较强的还原剂反应,生成氧化性较弱的氧化产物和还原性较弱的还原产物。

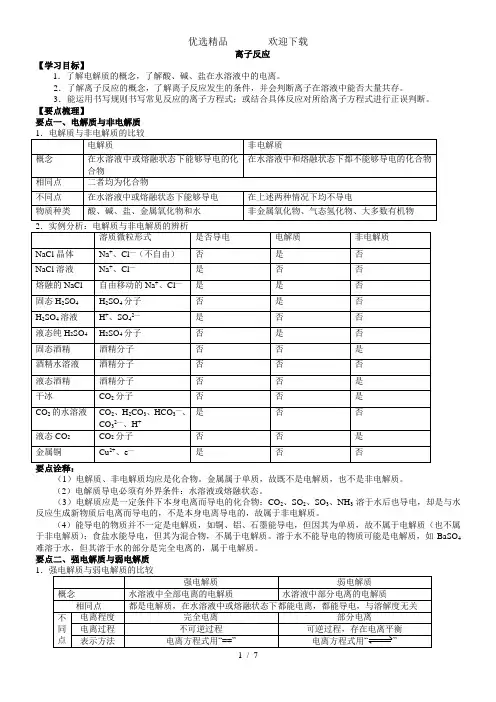
离子反应【学习目标】1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。
2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。
【要点梳理】要点一、电解质与非电解质(1)电解质、非电解质均应是化合物。
金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。
溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
要点二、强电解质与弱电解质1电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能力没有必然联系。
①BaSO4、CaCO3等虽然在水中溶解度很小,溶液的导电性很差,但是由于都是离子化合物,溶于水的部分是全部电离的,是强电解质。
②浓氨水的导电性比极稀NaOH溶液强,但NH3·H2O属于弱电解质。
2.电离方程式的书写方法:(1)要求左边书写电解质的化学式,右边写电解质电离出的离子的化学式,不同离子间用加号相连。
强电解质用“==”,弱电解质用“”。
如:H2SO4==2H++SO42-;NaHSO4==Na++H++SO42—;Ca(HCO3)2==Ca2++2HCO3—CH3COOHCH3COO- + H+;NH3·H2ONH4+ +OH- ;H2OH++ OH-(2)电离过程中,元素或原子团的化合价不变。
离子所带电荷数等于它在化合物中显示的化合价。
(3)检查电离方程式书写是否正确时,不仅要检查质量是否守恒(即电离前后原子的种类是否相同和个数是否相等),而且要检查电荷是否守恒(即电离后的阴、阳离子所带负、正电荷总数是否相等)。

书写步骤 类范围 书书规 离子方程式 水溶液中的离子反应 ①非氧化还原反应(复分解反应、双水解反应、络合反应); ①写离子符号的规则(可溶的强电解质);②保留化学式的规则③配平规则(同时满足:质量守恒、电子守恒、电荷写、拆、删、查 离子反应【新课标知识梳理】离子反应:1.定义:2.总趋势:3.表示方法:【易错指津】判断离子方程式的正误,应注意以下问题:①查是否违背反应事实,如铁跟硝酸反应:Fe+2H +=Fe 2++H 2↑(错误)。
②查电荷守恒(这是高考考查重点),如Fe+ Fe 3+=2Fe 2+是错误的。
③查化学式能否拆成离子,如硫化亚铁与盐酸反应的离子方程式不能写成:S 2-+2H +=H 2S↑。
④查是否漏写离子反应,如硫酸铜和氢氧化钡溶液反应的离子方程式不能写成:Ba 2++SO 42-=BaSO 4↓。
⑤查离子的配比数是否正确,如硫酸和氢氧化钡溶液反应的离子方程式不能写成:H ++SO 42-+ Ba 2++2OH -= BaSO 4↓+H 2O 。
⑥查反应物因过量或少量导致产物的不同,如往小苏打溶液中加入少量澄清石灰水的离子方程式为:Ca 2++2OH -+2HCO 3-=CaCO 3↓+2H 2O+CO 32-;往澄清石灰水加入少量小苏打溶液的离子方程式为:Ca 2++OH -+HCO 3-=CaCO 3↓+H 2O 。
⑦电解质溶液中的反应,其本质是离子间的反应。
用离子方程式所反映的是物质在溶液中存在的主要形式,而不一定是真实参与反应的离子。
如H 2S 通入NaOH 溶液,H +来自H 2S 的微弱电离:H 2S H ++HS -。
若H 2S 气体通入NaOH 溶液,由于上述H 2S 电离出来的H +被OH -中和,电离过程不断进行,反应的离子方程式为H 2S+OH -=HS -+H 2O ,若NaOH 过量,则反应的离子方程式为H 2S+2OH -=S 2-+2H 2O 。
高一化学离子方程式总结化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。
下面是由店铺整理的高一化学离子方程式总结,希望对大家有所帮助。
高一化学离子方程式总结(一)1、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4离子方程式:2Fe3++ H2S== 2Fe 2++ S↓+2 H+2、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4离子方程式:2ClO- +2SO2+ 2H2O══SO42-+ 2Cl-+2 H++SO42-3、氯气通入水中:Cl2+H2O HCl+HclO离子方程式:Cl2+H2O H++Cl-+HClO4、氟气通入水中:2F2+2H2O 4HF+O2↑离子方程式:2F2+2H2O 4HF+O2↑5、氯气通入冷的氢氧化钠溶液中:Cl2+2 NaOH══NaClO+NaCl+ H2O离子方程式:Cl2+ 2OH-══ ClO- + Cl-+ H2O6、FeBr2溶液中通入过量Cl2:2FeBr2+ 3Cl2══2FeCl3+2 Br2离子方程式:2Fe 2++4 Br-+ 3Cl2══2Fe3+++2 Br2 +6Cl-7、FeBr2溶液与等物质的量Cl2反应:6FeBr2+ 6C12 4FeCl3+2FeBr3+ 3Br2离子方程式:2Fe 2++2Br-+ 2Cl2══Br2 +4Cl-8、足量氯气通入碘化亚铁溶液中:3Cl2+2FeI2 2FeCl3+2I2离子方程式:3Cl2+2Fe 2++4I- 2Fe3++2I29、在FeI2溶液中滴入少量溴水:FeI2 +Br2 FeBr2+ I2离子方程式:Br2+2I- 2Br-+ I210、氯化亚铁溶液中滴入溴水:6FeCl2 + 3Br2══4FeCl3+2 FeBr3离子方程式:2Fe 2++ Br2══2Fe3++2Br-高一化学离子方程式总结(二)1、钠与水反应:2Na+2H2O 2NaOH +H2↑离子方程式:2Na+2H2O 2Na++2OH- +H2↑2、铝片投入氢氧化钠溶液:2Al+ 2NaOH +6H2O 2 Na [Al(OH)4] +3H2↑离子方程式:2Al+2OH-+6H2O [Al(OH)4] - +3H2↑3、氯化铁溶液中加入铁粉:2FeCl3+ Fe 3 FeCl2离子方程式:2Fe3++Fe 3 Fe 2+4、FeCl3溶液与Cu反应:2FeCl3+ Cu CuCl2+2FeCl2离子方程式:2Fe3++Cu Cu2++2Fe 2+5、硫氢化钠溶液与碘反应:NaHS+I2 S↓+ HI+NaI离子方程式:HS-+I2 S↓+2I-6、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑离子方程式:2Na2O2+2H2O=4 Na++4OH- +O2↑7、铜与浓硝酸:Cu+4HNO3(浓) Cu(NO3)2+ 2NO2↑+ 2H2O离子方程式:Cu+4H++2NO3- Cu2++ 2NO2↑+ 2H2O8、铜与稀硝酸:3Cu+8HNO3(稀) 3Cu(NO3)2+ 2NO↑+ 4H2O离子方程式:Cu+4H++2NO3- Cu2++ 2NO2↑+ 2H2O9、稀硝酸除银镜:3Ag+4HNO3 3AgNO3+ NO↑+ 2H2O离子方程式:3Ag+4H++NO3- 3Ag++ NO↑+ 2H2O10、稀硝酸与过量的铁屑反应3Fe+8HNO3(稀) 3Fe(NO3)2+ 2NO↑+ 4H2O离子方程式:3Fe+8H++2NO3—=3Fe3++2NO↑+4H2O高一化学离子方程式总结(三)1、向氢氧化钠溶液中通入少量CO2 :2NaOH + CO2 ==== Na2CO3+ H2O离子方程式:CO2 + OH- CO32-+ H2O2、在标准状况下过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3离子方程式:CO2+ OH- HCO3-3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3离子方程式:OH- +SO2 HSO3-4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2离子方程式:CO2+ OH- HCO3-5、氨水中通入少量二氧化碳:2NH3•H2O+CO2== (NH4)2 CO3+ H2O离子方程式:2NH3•H2O+CO2== 2NH4+ +2H2O6、用碳酸钠溶液吸收少量二氧化硫:Na2CO3+ SO2 Na2SO3+ CO2↑离子方程式:CO32-+ SO2 SO32-+ CO2↑7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3离子方程式:CO32-+ CO2 +H2O══HCO3-8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc离子方程式:Pb(Ac)2+H2S=PbS↓+2HAc9、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3离子方程式:CO2+H2O+C6H5O-→C6H5OH+ HCO3-10、氯化铁溶液中通入碘化氢气体:2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl离子方程式:2Fe3++2 H++2I- 2Fe 2++ I2+2 H+高一化学离子方程式总结(四)1、FeS和稀硝酸反应:FeS+4HNO3══Fe(NO3)3+NO↑+S↓+2 H2O离子方程式:FeS +4H++2NO3- Fe3++NO↑+S↓+2 H2O2、电解饱和食盐水:2 NaCl+2H2OC12↑+ H2↑+2NaOH离子方程式:2Cl-+2H2OC12↑+ H2↑+ 2OH-3、用石墨电极电解硫酸铜溶液:2CuSO4+2H2O O2↑+2Cu+ 2H2SO4离子方程式:2Cu2++2H2O2Cu+O2↑+4H+4、醋酸加入氨水:CH3COOH+NH3·H2O CH3COONH4+H2O离子方程式:CH3COOH+NH3·H2O CH3COO-+NH4++H2O5、氢氧化镁加入醋酸:Mg(OH)2+2CH3COOH (CH3COO)2Mg+2H2O离子方程式:Mg(OH)2+2CH3COOH 2CH3COO-+Mg2++2H2O6、在硫酸铜溶液中加入过量氢氧化钡溶液: CuSO4+ Ba(OH)2══Cu(OH)2↓+ BaSO4↓离子方程式:Cu2++SO42-+ Ba2++2OH-══Cu(OH)2↓+ BaSO4↓7、石灰乳与海水制取氢氧化镁:MgCl2+Ca(OH)2══Mg(OH)2↓+ CaCl2离子方程式:Mg2++2OH-══Mg(OH)2↓8、少量氢氧化钙溶液与碳酸氢钙溶液混合:Ca(HCO3)2+ Ca(OH)2 2CaCO3↓+2H2O离子方程式:Ca2++ HCO3-+OH-══CaCO3↓+H2O9、向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca(HCO3)2+ 2NaOH══CaCO3↓+ Na2CO3+2 H2O离子方程式:Ca2++ 2HCO3-+2OH-══CaCO3↓+H2O+CO32-。
中加双语学校高一化学作业(离子反应1)班级 姓名一、选择题1.下列反应的离子方程式正确的是 A .氨气通入醋酸溶液 CH 3COOH+NH 3 == CH 3COONH 4 B .澄清的石灰水跟盐酸反应 H ++OH - == H 2O C .碳酸钡溶于醋酸 BaCO 3+2H + == Ba 2++H 2O+CO 2↑D .金属钠跟水反应 2Na+2H 2O == 2Na ++2OH -+H 2↑ 2.下列反应的离子方程正确的是A .碳酸钠溶液中通入少量氯化氢气体 CO 32-+2H CO 2↑+H 2OB .碳酸铵溶液中加入氢氧化钡溶液 SO 42-+Ba BaSO 4↓C .用氨水吸收氯化氢气体 NH 3·H 2O+H NH 4++ H 2O D .足量的锌跟硫酸铁反应 Zn+2Fe Zn 2++2Fe 2+3.能用H ++OH -= H 2O 表示的化学方程式为( )A.稀H 2SO 4和Ba(OH)2溶液反应B.氢氧化铜和稀盐酸反应C.氢氧化钾和稀H 2SO 4反应D.氢氧化钠和醋酸反应 4.下列离子方程式书写正确的是( )A.Na 与水反应:Na+H 2O=Na ++OH -+H 2↑ B.Fe 与盐酸反应:2Fe+6H +=2Fe 3++3H 2↑C.Cu 和AgNO 溶液反应:Cu+Ag +=Cu 2++Ag+D.石灰石与盐酸反应:CaCO 3+2H +=Ca 2++H 2O+CO 2↑ 5.无色溶液中能大量共存的是A.K +、Na +、Cl -、NO 3-B.Cu 2+、NO 3-、OH -、Cl -C.MnO 4-、OH -、Cl -、K +D.CO 32-、K +、H +、Cl -6.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是A .Na +、K +、OH -、Cl -B .Na +、Cu 2+ 、SO 42-、NO 3-C .Mg 2+、Na +、SO 42-、Cl -D .Ba 2+、HCO 3-、NO 3-、K +7.重金属离子具有毒性。
高一化学辅导离子反应(一)一.电解质:(一).电解质与非电解质:1电离:盐酸,氢氧化钠溶液,氯化钠的溶液能导电,其原因是_________________________________2.电解质:非电解质:电解质溶液导电的原因:3.常见的电解质:酸:__________________________________________________碱:___________________________________________________盐:___________________________________________________水活泼金属氧化物_____________________________________________常见的非电解质:CO2,SO2,CO,NH3,CH4,酒精C2H5OH,蔗糖,苯,四氯化碳CCl4,①CO2的水溶液能导电,这是由于CO2与H2O生成H2CO3,碳酸能电离出H,CO3。
所以H2CO3是电解质,而CO2不是电解质。
②同样道理,NH3+H2O=NH3·H2O,一水合氨能电离成OH-与NH4+。
NH3·H2O是电解质,而NH3不是电解质。
③水能极弱的电离出H+与OH-,所以水是电解质④难溶于水的盐如:CaCO3,BaSO4,难溶于水的碱如Mg(OH)2,及活泼金属的氧化物如:Na2O、CaO、MgO、Al2O3等在熔融状态下能电离成离子,在熔融状况下能导电,这些物质也是电解质。
思考:1.下列物质属于弱电解质的是A. BaSO4B. CH3COOHC. NaOHD. CaCO32.下列物质中属于非电解质,但放入水中所得溶液可导电的是A.乙醇B.铜C.硫酸D.二氧化碳3.下列物质的水溶液不能导电的是A.氯酸钾B.硫酸C. 蔗糖溶液D.碳酸氢钙4.下列物质能导电,但既不属于电解质,也不属于非电解质的是:A.熔融氯化钠B.纯硫酸C.汞D.氢氧化钠固体(二) 强电解质与弱电解质:1.定义:强电解质:在水溶液中能完全电离的电解质弱电解质:在水溶液中部分电离的电解质决定溶液导电性强弱的因素:①主要:溶液中离子浓度:离子浓度越大,溶液导电性_______________②其次:离子电荷:离子电荷越大,溶液导电性_______________2.常见的强电解质:强酸:H2SO4HCl HNO3等强碱:KOH,Ca(OH)2,NaOH,Ba(OH)2,等盐:包括可溶性盐与不溶性盐3.常见的弱电解质:弱酸:H2CO3,CH3COOH,柠檬酸,H2SO3,H2S 等弱碱:NH3·H2O Al(OH)3,Zn(OH)2,Fe(OH)2,Fe(OH)3,Cu(OH)2水强调:①弱电解质溶于水中,只有部分分子离解为离子溶液中还有大部分分子②弱酸的电离是分步进行的,每一步都不完全H2CO3溶液中含有:H+,HCO3-,CO32-少量离子,还有大量H2CO3分子③NH3·H2O溶液中含有:NH4+,OH-少量离子,大量NH3·H2O分子④纯水是一种极弱的电解质。
⾼⼀化学《离⼦反应》知识点梳理 离⼦反应是指有离⼦参加的反应,今天⼩编要和⼤家分享的是⾼⼀化学必修⼀《离⼦反应》知识点梳理,希望能够帮助到⼤家好好学习并掌握这部分知识,赶快学习起来吧。
⾼⼀化学必修⼀《离⼦反应》知识点梳理 ⼀、离⼦反应的概念 离⼦反应是指有离⼦参加的反应。
也就是说,反应物中有离⼦或⽣成物中有离⼦的反应,均为离⼦反应。
由于中学阶段涉及的问题多数是指⽔溶液中的变化,所以⽔溶液中电解质间的相互反应便成了离⼦反应的常见问题。
但须注意的是,凡是离⼦化合物,就含有离⼦,有时固体状态的物质之间(如实验室判氨)或固体与⽓体之间(如碱⽯灰与氯化氢)发⽣的反应,也可以是离⼦反应,只是通常不书写类似这样过程的离⼦反应⽅程式。
在⽔溶液中发⽣离⼦反应的条件即复分解反应的三个条件(有难电离、难溶及易挥发物质⽣成)和氧化还原反应(⽐如置换反应等)。
⼆、离⼦共存问题 凡是能发⽣反应的离⼦之间或在⽔溶液中⽔解相互促进的离⼦之间不能⼤量共存(注意不是完全不能共存,⽽是不能⼤量共存)。
⼀般规律是: 1、凡相互结合⽣成难溶或微溶性盐的离⼦(熟记常见的难溶、微溶盐); 2、与H+不能⼤量共存的离⼦(⽣成⽔或弱)酸及酸式弱酸根离⼦: 1氧族有:OH-、S2-、HS-、SO32-、HSO3- 2氮族有:H2PO4-、HPO42-、PO43- 3卤族有:F-、ClO- 4碳族有:CH3COO-、CO32-、HCO3-、SiO32- 5含⾦属酸根离⼦:AlO2- 3、与OH-不能⼤量共存的离⼦有: NH4+和HS-、HSO3-、HCO3-、H2PO4-、HPO42-等弱酸的酸式酸根离⼦以及弱碱的简单阳离⼦(⽐如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等) 4、能相互发⽣氧化还原反应的离⼦不能⼤量共存: 1常见还原性较强的离⼦有:Fe2+、S2-、I-、SO32-。
2氧化性较强的离⼦有:Fe3+、ClO-、MnO4-、Cr2O72-、NO3-、此外,S2O32-与H+也不能共存(发⽣歧化反应)。