中和反应反应热的测定实验
- 格式:doc
- 大小:29.00 KB
- 文档页数:2

测定中和反应热【实验目的】1.理解中和热的概念2.能以中和热的测定为例掌握反应热的测定方法3.能进行误差分析,采取措施减少实验误差。
【实验探究】中和反应反应热的测定(1)实验原理:根据中和热的概念,通过简单实验测量一定量的强酸、强碱溶液在反应前后的温度变化,计算反应放出的热量,依据Q=cm△t计算Q(反应放出的热量),从而测定反应热(中和热)计算公式:即通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得反应热。
①c:比热容,近似认为4.18J/(g·℃);②m:盐酸和氢氧化钠的总质量(密度近似为1g/cm3);③Δt:前后两次的温度差Δt=t2-t1。
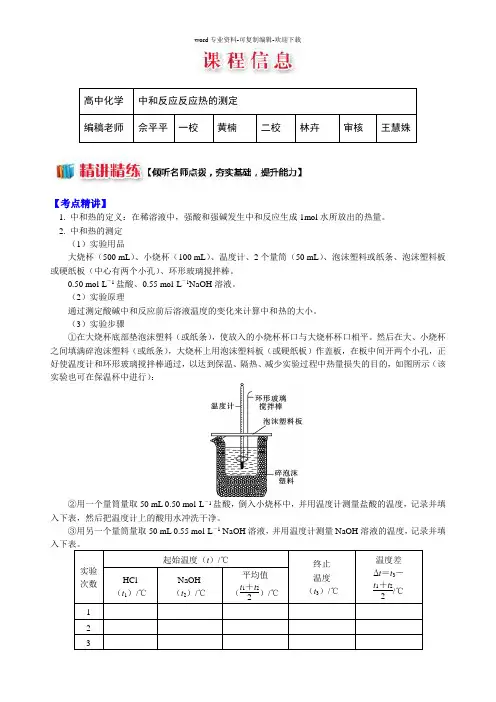
(2)实验用品(3)实验装置:①装置名称:(简易)量热计。
②各部分仪器的作用ⅰ.玻璃搅拌器的作用是使反应物混合均匀充分接触。
ⅱ.隔热层的作用是减少热量的散失。
ⅲ.温度计的作用是测定反应前后反应体系的温度(4)实验步骤①反应物温度(t1)的测量:用一个量筒量取50mL0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。
用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50mL0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1。
②反应后体系温度(t2)的测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。
并准确读取混合溶液的最高温度,并记录为t2。
③重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
(5)实验数据处理:①计算实验中盐酸与NaOH溶液完全反应放出的热量(保留三位有效数字,下同) 。
Q=cmΔt=100g×4.18 J·g-1·℃-1×(t2—t1) ℃=0.418(t2—t1) kJ≈ 1.42kJ;②计算生成1 mol H2O时的放出的热量。
高中化学中和反应反应热的测定编稿老师佘平平一校黄楠二校林卉审核王慧姝【考点精讲】1. 中和热的定义:在稀溶液中,强酸和强碱发生中和反应生成1mol水所放出的热量。
2. 中和热的测定(1)实验用品大烧杯(500 mL)、小烧杯(100 mL)、温度计、2个量筒(50 mL)、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液。
(2)实验原理通过测定酸碱中和反应前后溶液温度的变化来计算中和热的大小。
(3)实验步骤①在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示(该实验也可在保温杯中进行):②用一个量筒量取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录并填入下表,然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用温度计测量NaOH溶液的温度,记录并填实验次数起始温度(t)/℃终止温度(t3)/℃温度差Δt=t3-t1+t22/℃HCl(t1)/℃NaOH(t2)/℃平均值(t1+t22)/℃1 2 3④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),用环形玻璃搅拌棒轻轻搅动溶液,并准确读出混合溶液的最高温度,作为终止温度,记录并填入表格。
⑤重复实验三次,取测量所得数据的平均值作为计算的依据。
⑥根据实验数据计算中和热。
【典例精析】例题1 某学生进行中和热测定,取用50 mL 0.50 mol·L -1的HCl 和50 mL 0.55 mol·L -1 的NaOH 溶液(密度都是1 g·cm -3)。

中和反应反应热的测定实验注意事项一、引言中和反应是化学中常见的一种反应类型,它是指酸和碱在适当的条件下发生反应,生成盐和水的化学变化过程。
在中和反应中,反应热是一个重要的物理量,它可以用来评估反应的放热或吸热性质。
本文将介绍如何进行中和反应反应热的测定实验以及实验中需要注意的事项。
二、实验目的本实验的主要目的是通过实验测定中和反应的反应热,从而了解该反应的放热或吸热性质,并掌握实验方法和注意事项。
三、实验原理中和反应的反应热可以通过测定反应前后溶液的温度变化来间接计算。
实验中,需要将一定量的酸和碱溶液混合,使其发生中和反应,测量反应前后溶液的温度变化,并利用热容量公式计算反应热。
四、实验仪器和试剂1. 实验仪器:烧杯、温度计、计时器等。
2. 实验试剂:酸和碱溶液。
五、实验步骤1. 准备实验仪器和试剂,并按照实验要求配制好酸和碱溶液。
2. 使用烧杯分别量取一定量的酸和碱溶液,并记录其初始温度。
3. 将酸和碱溶液缓慢倒入同一个烧杯中,搅拌均匀。
4. 开始计时,并记录混合溶液的温度变化。
5. 当混合溶液的温度变化趋于平缓时,停止计时,并记录最终温度。
六、实验注意事项1. 实验操作要规范,注意安全。
在进行实验时,应佩戴实验室必备的防护用具,如实验手套、护目镜等。
2. 实验仪器和试剂要干净,避免杂质的干扰。
在使用烧杯等实验仪器前,应先进行清洗和干燥。
3. 酸和碱溶液的配制要准确,浓度要一致。
使用天平等仪器进行称量时,应注意准确读数,避免误差。
4. 在混合溶液时,要轻轻搅拌,避免剧烈搅拌产生的热量对实验结果的影响。
5. 记录温度变化时,要准确读数。
温度计应插入溶液中央,避免接触容器壁面,以免产生误差。
6. 在混合溶液温度变化趋于平缓时,应立即停止计时,并记录最终温度。
过长的实验时间可能导致温度变化不明显,影响结果的准确性。
7. 实验结束后,应将实验仪器和试剂清洗干净,放置在指定位置。
七、实验数据处理与结果分析根据实验记录的初始温度、最终温度和实验所使用的试剂浓度,可以计算出中和反应的反应热。


中和反应反应热的测量定义:在稀溶液中,酸和碱发生中和反应,生成mol 水时的反应热。
一、实验目的:测定强酸和强碱反应的反应热。
二、实验用品:大烧杯(500ml )、小烧杯(100ml )、温度计、量筒(50ml )两个泡沫塑料或纸条,泡沫塑料板或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.5mol/L 盐酸 0.55mol/L NaOH 溶液 三、实验步骤:1、在大烧杯底垫泡沫塑料(或纸条),使放入小烧杯杯口与大烧杯之口相平,然后再在大烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温隔热,减少实验过程中热量损失的目的。
如图2、用一个量筒量取倒入小烧杯中,并用温度计测量盐酸的温度,记入下表,然后把温度计上的酸用水冲洗干净。
3、用另一个量筒量取50ml 0.550mol/L NaoH ,并用温度计测量NaOH 的温度记入下表。
4、把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 一次(防止造成热量损失)倒入小烧杯(注意不要洒到外面),用环形玻璃棒搅动溶液,并准确读取混合溶液的最高温度,记好终止温度,记入表格中。
5、重复实验步骤2~4次。
6、根据实验数据计算中和热。
四、实验数据处理:2、计算反应热:Q=cm △tQ :中和反应放出的热量 m :混合液的质量 c :混合液的比热溶△t :反应前的溶液的温度差五、实验分析:1、中和热和反应热的区别与联系。
2、若将50ml 0.5mol/L Hcl →50ml 0.5mol/L CH 3COOH ,所测得结果是否会有变化。
3、若改用100ml 0.5mol/L Hcl 和100ml 0.55mol/L NaOH ,中和热数据是否为上述实验结果2倍。
4、若用50ml 0.5mol/L Hcl 和100ml 0.55mol/L NaOH ,结果偏小,说明原因。

中和反应热测定
中和反应热是指在恒定压力下的酸碱中和反应中释放或吸收的热量。
测定中和反应热可以帮助我们了解反应热力学性质、计算反应焓变以及评估反应的热稳定性等。
一种常见的方法是通过热量计测量中和反应释放或吸收的热量。
具体步骤如下:
1) 准备反应物:准确称取酸和碱的量,使它们符合反应的化学计量比。
2) 混合反应物:将酸和碱混合在热量计容器中。
重要的是要保持实验条件恒定,例如保持温度和压力稳定。
3) 记录温度变化:开始测量前,记录热量计容器内的初始温度。
随后,观察并记录反应发生时温度的变化。
4) 计算反应热量:根据温度变化以及热量计容器中的热容量,可以计算出反应释放或吸收的热量。
需要注意的是,为了减少热量损失,通常在热量计系统中使用双层壁的器皿,并保持封闭状态。
中和反应热的测定可以用于许多化学反应和热力学实验中,以了解反应的能量变化和反应性质。
它对于研究热力学性质、反应速率和反应稳定性等方面具有重要意义。




中和反应反应热的测定实验原理
中和反应是指一种化学反应,其中酸和碱反应生成盐和水。
中和反应通常是放热的,这是因为酸和碱结合后会释放出能量。
测定中和反应的反应热可以使用热量计来完成。
热量计是一个装置,用于测量化学反应释放或吸收的热量。
实验原理如下:
1. 首先,在热量计中准确测量一定量的酸和碱的体积,通常使用定容烧瓶或分别称量一定质量的酸和碱。
2. 然后,将酸和碱混合在热量计中,并迅速加上热量计的盖子,以避免热量的散失。
3. 当酸和碱反应时,会释放出热量。
这些释放的热量将升高热量计中的水的温度。
4. 在反应结束后,测量水的温度变化。
从温度变化可以推断出反应释放的热量。
5. 通过测量酸和碱的质量或体积,并结合热量计中水的特定热容量,可以计算出单位质量或单位体积的酸碱反应的反应热。
这种测定中和反应反应热的实验原理适用于室温下的中和反应。
通过测量反应热,可以了解酸和碱之间的相对强度和反应的放热程度,以及控制化学反应中热量变化的关键参数。

中和反应反应热的测定实验注意事项以中和反应反应热的测定实验注意事项为标题,写一篇文章。
中和反应反应热的测定实验是化学实验中常见的一种实验方法,通过测定中和反应释放或吸收的热量来研究反应的热力学性质。
下面我们来介绍一下在进行中和反应反应热测定实验时需要注意的事项。
1. 实验前的准备工作在进行实验前,首先要对实验室进行安全检查,确保实验室环境安全。
同时要查看实验所需的试剂和仪器是否齐全,并检查是否有过期的试剂。
另外,在进行实验前应该对实验步骤进行充分的了解,避免在实验过程中出现操作错误。
2. 试剂的选择和配制在进行中和反应反应热测定实验时,选择合适的试剂非常重要。
试剂的选择应该考虑到其反应性和安全性。
同时,试剂的浓度也需要适当调整,以保证反应能够顺利进行并得到准确的实验结果。
3. 实验设备的使用在进行中和反应反应热测定实验时,需要使用到一些特殊的实验设备,如量热器、温度计等。
在使用这些设备时,需要保证设备的清洁和准确性。
另外,在使用量热器时要注意保持其密封性,以避免热量的损失。
4. 实验条件的控制在进行中和反应反应热测定实验时,需要控制好实验条件,以确保实验的准确性和可重复性。
例如,控制反应的温度和压力,保持实验室的恒温和恒压条件。
同时,还要控制反应物的用量和摩尔比,以保证反应的完全进行。
5. 数据的记录和分析在进行中和反应反应热测定实验时,需要及时记录实验数据,并进行合理的数据分析。
在记录数据时,要注意使用准确的仪器,并保持实验操作的一致性。
在数据分析时,可以通过计算反应的焓变来研究反应的热力学性质。
6. 安全注意事项在进行中和反应反应热测定实验时,需要注意安全事项。
例如,要佩戴好实验室所需的个人防护用品,如实验服、手套等。
同时,在操作过程中要小心谨慎,避免发生意外事故。
7. 清洁与废弃物处理在实验结束后,要及时清洁实验设备和实验台。
废弃物的处理要按照实验室的规定进行,以保护环境和他人的安全。
通过以上几点注意事项,我们可以更好地进行中和反应反应热测定实验,得到准确可靠的实验结果。
中和反应反应热的测定实验实验原理:稀溶液中,酸跟碱发生中和反应而生成1molH 2O ,这时的反应能量变化叫做中和热。
实验中通过测定酸碱中和反应过程中所放出的热量来计算中和热。
实验用品:大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL )两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌器。
0.50,ol/L 盐酸、0.55mol/L NaOH 溶液。
实验步骤:⑴在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯扣与大烧杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌器通过,以达到保温隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
⑵用一个量筒量取50mL 0.05mol/L 的盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
⑶用另一个量筒量取50mL0.55mol/L 的NaOH 溶液,并用温度计测量NaOH 溶液的温度,记入下表。
⑷把套有盖板的温度计和环形玻璃搅拌器放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。
用环形玻璃搅拌器轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
温度 试验 次数起始温度t 1/℃ 终止温度 t 2/℃温度差 (t 2- t 1)/℃HCl NaOH 平均值 12 3⑹根据实验数据计算中和热。
为了使计算更简便一些,我们近似地认为0.5mol/L 的盐酸和0.55mol/L 的NaOH 溶液的密度都是1g/cm 3,所以50mL0.5mol/L 的盐酸的质量m 1=50g ,50mL0.55mol/L 的NaOH 溶液的质量m 2=50g 。
中和后生成溶液的比热容c=4.18J ·(g ·℃)-1,由此可以计算出,50mL0.55mol/L 的盐酸与50mL0.55mol/L 的NaOH 溶液发生中和反应时放出的热量为(m 1+ m 2)·c ·(t 2- t 1)=0.418(t 2- t 1)kJ又因50mL0.55mol/L 的盐酸中含有0.025mol HCl ,0.025mol HCl 与0.025mol NaOH 发生中和反应,生成0.025molH 2O ,放出热量是0.418(t 2- t 1)kJ所以,生成1 mol H 2O 时放出的热量即为中和热为025.0)(418.012t t kJ/mol实验思考:1、反应热的测定实验中酸碱溶液为什么一定用稀溶液?答:在稀溶液中强酸与强碱已经完全电离,不会影响H ++OH -==H 2O 反应所产生的热量的测定。
【教材实验热点】13 中和反应反应热的测定专题13 中和反应反应热的测定【教材实验梳理】1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
2.实验装置3.实验用品大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、盐酸(0.50 mol·L−1)、氢氧化钠溶液(0. 55 mol·L−1)4.实验步骤5.实验说明(1)中和热的测定实验中,NaOH溶液的浓度稍大于盐酸的浓度是确保HCl反应完全。
若采用的酸、碱浓度相等,可采用碱体积稍过量的方法达到这个目的。
(2)中和热的计算公式ΔH=()()酸终碱始水+⋅⋅--m m c t tnkJ/mol(3)实验中若用弱酸(或弱碱)代替强酸(或强碱),因弱酸(或弱碱)电离出H+(或OH−)需要吸收热量,故测定的中和热的数值偏小;若用浓硫酸与强碱反应测定中和热,因浓硫酸稀释要放热,故测定的中和热的数值偏大。
(4)要提高反应热测定的准确性,应注意“快”(实验操作要快,尽量减少热量散失)、“准”(准确测量液体温度和液体体积)、“稀”(浓度不宜过大,避免稀释放热,也要避免浓度过小)。
(5)要使用同一支温度计,温度计的水银球要完全浸入溶液中,读出变化过程中的最高温度。
(6)环形玻璃搅拌棒不能用铁丝代替,若用铁丝代替,会因铁丝与酸反应放出热量,且铁丝传热快而使测试结果不准确。
(7)对于定量实验,需重复实验步骤,取3次实验数据的平均值,但相差太大的数据应舍弃。
6.误差分析(1)分析的依据看实验中有哪些因素能造成(t终−t始)出现误差。
若(t终−t始)偏大,则|ΔH|偏大;若(t 终−t始)偏小,则|ΔH|偏小。
(2)误差分析实例50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液反应的误差分析:【答题技巧】反应热答题规范指导(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH后所跟数值需要带“+”、“-”符号。
中和反应反应热的测定中和热:在稀溶液中,酸与碱发生中和反应生成1mol H2O(l)时释放的热量称为中和热。
(一)实验目的:测定强酸与强碱反应的反应热,体验化学反应的热效应。
(二)实验原理:根据中和热的概念,通过简单实验测量一定量的酸、碱溶液在反应前后的温度变化,计算反应放出的热量,由此求得中和热。
(三)实验用品:大烧杯(500mL)、小烧杯(100mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料或硬纸板(中心有两个小孔)、环形玻璃搅拌棒、0.50mol/L 盐酸、0.55mol/L NaOH溶液。
(四)实验步骤:①实验装置如图所示:②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度(t1),记录数据,然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL0.55mol/L NaOH溶液,并用温度计测量NaOH溶液的温度(t2),记录数据。
④把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面),盖好盖板。
用环形玻璃搅拌棒轻轻搅拌溶液,并准确读取混合溶液的最高温度(t3),记录数据。
⑤重复实验步骤②~④三次。
(五)实验数据处理①取三次测量所得数据的平均值作为计算依据。
②为了计算方便,可近似地认为实验所用盐酸、NaOH溶液的密度和比热容与水相同,并忽略实验装置的比热容。
③盐酸的质量m1=50g,NaOH溶液的质量m2=50g,中和后生成的溶液的比热容c=4.18J/(g·℃),反应体系的温度变化∆t=t3-t1+t2,实验中反应放出的热量为2(m1+m2)·c·(t3−t1+t22),则生成1mol H2O(l)时的反应热∆H=-(m1+m2)×c×(t3−t1+t22)×10−3n(H2O)=-0.418(t3−t1+t22)0.025kJ/mol。
中和反应反应热的测定实验.doc实验目的:通过实验测定中和反应的反应热,并掌握测定方法。
实验原理:中和反应是指酸和碱反应后生成盐和水的化学反应。
中和反应通常是放热反应,反应热量可以用来测量反应的热力学性质。
在实验中,通过测定反应前后溶液的温度变化来计算反应热。
实验仪器:常压容量瓶、酸钠、氢氧化钠、稀盐酸、热量计、温度计等。
实验方法:1. 取两个常压容量瓶,一个装入30mL浓氢氧化钠溶液,另一个装入30mL的稀盐酸溶液。
2. 将热量计放置在容量瓶下方的支架上,然后将两个容量瓶倒置,使其顶端分别浸入热量计中的两个槽内。
3. 稳定后,将氢氧化钠溶液迅速倒入稀盐酸溶液中,开始反应。
4. 观察反应过程,记录反应前后的溶液温度。
5. 清洗实验仪器,重复以上步骤进行第二次实验。
实验数据及处理:反应前温度(℃)反应后温度(℃)稀盐酸 21.5 45.0氢氧化钠 21.5 45.0反应热计算:在实验中,反应热可以用以下公式计算:Q = m·C·ΔT其中,Q为反应放出的热量,m为反应混合物的质量,C为混合物的比热容,ΔT为反应前后溶液温度差。
计算中可将酸钠溶液和氢氧化钠溶液质量视为相等,且C值可取水的比热容为4.18J/g·℃。
则可得出以下数据:实验1中,反应前后温度差ΔT = 23.5℃,m = 60g,Q = 60×4.18×23.5 = 5926.4J = 5.93kJ。
实验平均反应热:(5.93 + 6.27) / 2 = 6.10kJ。
实验结论:通过实验,成功测定出中和反应的平均反应热为6.10kJ,证明中和反应属于放热反应。
掌握了测定反应热的方法,同时提高了实验操作技能。
中和反应反应热的测量定义:在稀溶液中,酸和碱发生中和反应,生成mol 水时的反应热。
一、实验目的:测定强酸和强碱反应的反应热。
二、实验用品:大烧杯(500ml )、小烧杯(100ml )、温度计、量筒(50ml )两个泡沫塑料或纸条,泡沫塑料板或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.5mol/L 盐酸 0.55mol/L NaOH 溶液 三、实验步骤:1、在大烧杯底垫泡沫塑料(或纸条),使放入小烧杯杯口与大烧杯之口相平,然后再在大烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温隔热,减少实验过程中热量损失的目的。
如图2、用一个量筒量取倒入小烧杯中,并用温度计测量盐酸的温度,记入下表,然后把温度计上的酸用水冲洗干净。
3、用另一个量筒量取50ml 0.550mol/L NaoH ,并用温度计测量NaOH 的温度记入下表。
4、把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 一次(防止造成热量损失)倒入小烧杯(注意不要洒到外面),用环形玻璃棒搅动溶液,并准确读取混合溶液的最高温度,记好终止温度,记入表格中。
5、重复实验步骤2~4次。
6、根据实验数据计算中和热。
四、实验数据处理:2、计算反应热:Q=cm △tQ :中和反应放出的热量 m :混合液的质量 c :混合液的比热溶△t :反应前的溶液的温度差五、实验分析:1、中和热和反应热的区别与联系。
2、若将50ml 0.5mol/L Hcl →50ml 0.5mol/L CH 3COOH ,所测得结果是否会有变化。
3、若改用100ml 0.5mol/L Hcl 和100ml 0.55mol/L NaOH ,中和热数据是否为上述实验结果2倍。
4、若用50ml 0.5mol/L Hcl 和100ml 0.55mol/L NaOH ,结果偏小,说明原因。
实验原理:稀溶液中,酸跟碱发生中和反应而生成1molH 2O ,这时的反应能量变化叫做中和热。
实验中通过测定酸碱中和反应过程中所放出的热量来计算中和热。
实验用品:大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL )两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌器。
,ol/L 盐酸、L NaOH 溶液。
实验步骤:⑴在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯扣与大烧杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌器通过,以达到保温隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
⑵用一个量筒量取50mL L 的盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
⑶用另一个量筒量取L 的NaOH 溶液,并用温度计测量NaOH 溶液的温度,记入下表。
⑷把套有盖板的温度计和环形玻璃搅拌器放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。
用环形玻璃搅拌器轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑹根据实验数据计算中和热。
为了使计算更简便一些,我们近似地认为L 的盐酸和L 的NaOH 溶液的密度都是1g/cm 3
,所以L 的盐酸的质量m 1=50g ,L 的NaOH 溶液的质量m 2=50g 。
中和后生成溶液的比热容c=·(g ·℃)-1
,由此可以计算出,L 的盐酸与L 的NaOH 溶液发生中和反应时放出的热量为(m 1+ m 2)·c ·(t 2- t 1)=(t 2- t 1)kJ
又因L 的盐酸中含有 HCl , HCl 与 NaOH 发生中和反应,生成,放出热量是(t 2- t 1)kJ
所以,生成1 mol H 2O 时放出的热量即为中和热为
025
.0)
(418.012t t kJ/mol
实验思考:
1、反应热的测定实验中酸碱溶液为什么一定用稀溶液?
答:在稀溶液中强酸与强碱已经完全电离,不会影响H ++OH -==H 2O 反应所产生的热量的测定。
另外,
稀溶液的比热接近于水,密度与水相差不大,在粗略计算时误差小。
同时应注意溶液也不能太稀,因溶液浓度太小时,体系温度改变量太小,测量时困难,且测得的误差很大。
2、简易的量热剂中大小烧杯间填满碎纸条的作用是什么? 答:
3、实验时,为什么酸或碱一定略过量?
4、不同的强酸与强碱之间的反应,若它们的体积和氢离子的浓度值均与教材中所给定值相同,所测得的反应热是否也相同?
答:相同。
因为参加反应的物质都是强酸与强碱,它们在水中均是完全电离,所发生的反应都是H ++OH -==H 2O ,且它们所含的H +和OH -的物质的量相同,产生的水的量也相同,所以测定的反应热也就
相同。
5、为了减小误差,操作中应注意哪些问题?
答:⑴量热剂的隔热效果要好
⑵HCl和NaOH的体积必须准确量取
⑶温度计的读数要准确,水银球部分要完全浸没在溶液中且要稳定一段时间后再读数(要读得最
高温度)。
⑷测量盐酸的温度后,要将温度计上的酸冲洗干净后再测量NaOH溶液的温度
⑸实验操作要快
习题:1、实验室用50mL L盐酸、50mL L NaOH溶液和下图所示装置进行测定中和热的实验,得到表
完成下列问题:
⑴实验时用环形玻璃棒搅拌溶液的方法是,不能用铜丝搅拌棒代替环形玻璃棒的理由是
⑵经数据处理,t2-t1=℃。
则该实验测得的中和热△H= [盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按·(g·℃)-1jisuan ]。
⑶若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1与△H的关系为:△H1 (填“<”“>”或“=”)△H,理由是。
2、50mL L盐酸与50mL L NaOH溶液在下图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
⑴从实验装置上看,图中尚缺少的一种玻璃用品是。
⑵烧杯间填满碎纸条的作用是。
⑶大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”或“无影响”)。
⑷实验中改用60mL L盐酸与50mL L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),简述理由:
⑸用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL L NaOH溶液进行上述实验,测得的中和热的数值会。
(填“偏大”“偏小”或“无影响”)。