碳负离子的重排
- 格式:doc
- 大小:991.50 KB
- 文档页数:13




克莱森重排机理克莱森重排是指在存在乙酰丙酮(或酮类)和硫脲(或脲类)等分子间的反应中,分子间发生重排反应,生成异构体的化学过程。
该反应在有机化学合成中有广泛的应用,具有一定的机理特点。
一、反应机理克莱森重排的反应机理包括以下几个步骤:1.硫脲与酮类分子发生亲核加成,形成价态复杂的中间体;2.中间体负离子发生轴向异构,形成中间体B。
此时,碳负离子在α位置得到了稳定化;3.负离子中间体B发生质子转移,并发生环型闭合,生成异构体。
此时,杂原子硫原子转化为环内原子性质,生成六元环的化合物;4.反应的最终产物是异构体的混合物,难以区分哪个成分是主要的产物。
二、反应条件克莱森重排作为一种常用的有机化学反应,其反应条件具有一定的特点,通常需要满足以下条件:1.反应物要求有一定的亲电性和亲核性,包括酮类和硫脲(或脲类)化合物;2.反应需要在适量的碱性条件下进行,以促进负离子中间体的形成;3.反应需要在适宜的温度下进行,不宜过高或过低,一般在室温至70℃之间;4.溶剂选择要合适,一般选择乙醇、二甲基甲酰胺等极性溶剂;5.该反应具有缩合反应的性质,易于生成大分子化合物。
三、应用克莱森重排在有机化学领域中具有广泛的应用,常用于:1.生产有机化合物的制备,例如生产杀菌剂、农药、抗生素等产品;2.新药研发领域中的化学反应研究;3.有机合成化学研究领域中,用于生成环状或多环状的复杂化合物,为后续有机合成研究提供组成部分;4.生物化学领域,用于设计合成有机化合物,以研究其生物活性等性质。
总之,克莱森重排反应是一种常用的有机反应过程,具有一定的机理特征和应用价值。
在化学研究领域,在其反应条件和应用范围等方面进行深入了解和研究,对于有机化学领域的发展和推动具有重要意义。
![20春奥鹏西南大学[1095]《有机化学(二)》答案](https://uimg.taocdn.com/05d70c81f12d2af90242e6bc.webp)
单项选择题372129897 1、命名下列化合物().间甲苯胺.对甲苯胺.邻甲苯胺.邻氨基甲苯2、....3、........4、()是最常用的淀粉鉴定试剂。
.茚三酮.2,4-二硝基氟苯.碘.异硫氰酸苯酯5、下列化合物中,碱性最强的是()。
....6、下列化合物中,()可以用作化学合成染料。
....7、蛋白质的基本组成单位是()。
.氨基酸.脱氧核糖核酸.核糖核酸.葡萄糖8、命名下列化合物().2-甲基呋喃.1-甲基四氢呋喃.2-甲基四氢呋喃.1-甲基呋喃9、命名下列化合物().乙酸.乙酸酐.乙酸乙酯.乙酰胺10、....11、氨基酸自动分析仪可用来()。
.分析N-端氨基酸单元.分析C-端氨基酸单元.测定氨基酸组成及其相对比例.切断二硫键12、蒎烯中有一个不稳定的四元环,很容易发生______,使碳架发生改变。
.碳正离子的重排.碳负离子的重排.过渡态的重排.自由基的重排13、....14、()和亚硝酸或亚硝酸盐及过量的酸在低温下反应可生成芳香重氮盐。
.芳香铵盐.芳香三级胺.芳香一级胺.芳香二级胺15、为何酰胺熔沸点比分子量相近的酯高()。
.范德华力. A and B.分子间氢键作用.分子间静电作用16、两个或两个以上的异戊二烯分子以头尾相连的方式结合起来的化合物称为______。
.生物碱.甾体化合物.萜类化合物.蛋白质17、.... 18、....19、下列基团中____不能用来保护羟基.THP(四氢吡喃基).对甲氧基苄氧基甲基p-MeOC6H4CH2OCH2―简写为PMBM .硅保护基,例如三乙基硅基(TES).苄基20、下列反应中,()不属于周环反应。
.Cope重排.Claisen重排.Aldol缩合反应.Diels-Alder反应21、下列化合物中,____不属于生物碱试剂。
().碳酸钠.苦味酸.硝酸.盐酸22、命名下列化合物.苯胺.甲胺.苯甲酸.甲苯23、下列试剂中,()可以用来鉴别伯、仲、叔胺。

mumm重排反应机理一、引言Mumm重排反应是一种有机化学中的重要反应类型,它在有机合成、药物化学等领域具有广泛的应用。
了解Mumm重排反应的反应机理对于化学研究者具有重要意义。
本文将详细介绍Mumm重排反应的定义、特点、反应机理及应用,以期为读者提供实用的参考。
二、Mumm重排反应的定义和特点Mumm重排反应,又称为Mumm降解或Mumm消除,是指一类有机化合物在酸性条件下,通过脱羧和脱氢的过程,生成不饱和化合物的反应。
这类反应通常具有以下特点:1.反应发生在酸性条件下;2.反应物为含有羧基的有机化合物;3.反应过程中,羧基脱去,生成不饱和键(如烯烃、炔烃等);4.反应通常伴随着立体化学的变化。
三、Mumm重排反应的反应机理Mumm重排反应的反应机理可分为以下几个步骤:1.羧基的质子化:在酸性条件下,羧基上的氧原子质子化,形成碳负离子。
2.亲核进攻:碳负离子作为亲核试剂,进攻另一个碳原子,形成一个新的碳负离子。
3.脱羧:第一个碳负离子失去一个碳原子,生成一个不饱和键(如烯烃、炔烃等)。
4.脱氢:第二个碳负离子失去一个氢原子,生成另一个不饱和键(如烯烃、炔烃等)。
5.立体化学变化:由于反应过程中碳负离子的空间取向变化,可能导致产物立体构型发生变化。
四、Mumm重排反应的应用Mumm重排反应在有机合成中具有广泛的应用,以下为例:1.合成不饱和化合物:通过Mumm重排反应,可以便捷地从羧酸或酯类化合物合成不饱和化合物,为进一步的有机合成提供基础。
2.药物化学:许多生物活性分子中含有不饱和键,通过Mumm重排反应,可以实现对这类分子的修饰和改造,从而改善其生物活性。
3.材料科学:某些具有特定性能的材料可通过Mumm重排反应进行合成,如高分子材料、液晶材料等。
五、结论Mumm重排反应是一种重要的有机化学反应,具有广泛的应用前景。
了解其反应机理和应用有助于化学研究者更好地利用这一反应类型进行有机合成和研究。

碳负离子重排碳负离子重排是一种在现代生物科技、医学领域中被广泛应用的技术。
它通过改变人体离子平衡,促进新陈代谢,强化自愈能力,对身体健康具有积极作用。
本文将从碳负离子重排的原理、应用场景以及使用方法进行全面介绍,希望能给读者提供指导意义。
首先,我们来了解一下碳负离子重排的原理。
碳负离子是一种载有负电荷的氧化物离子,具有较强的氧化还原能力。
当人体受到各种外界因素的干扰时,离子平衡会被打破,导致身体出现各种问题,如疲劳、免疫力下降等。
碳负离子重排作为一种调整离子平衡的方法,通过静电作用和电子转移作用,将离子重新排列,以达到修复人体功能的目的。
接下来,我们来看一下碳负离子重排的应用场景。
首先,它在美容领域具有广泛的应用。
由于碳负离子具有清洁、抗菌、抗氧化等特性,可以帮助清除面部污垢,抑制细菌滋生,减少皮肤老化。
其次,碳负离子重排还可以用于促进伤口愈合。
离子的重新排列可以改善局部血液循环,加快伤口愈合速度,减少感染的发生。
此外,碳负离子重排还可以用于治疗一些疾病,如关节炎、肺炎等,通过调整离子平衡,促进机体自愈能力,加速疾病康复。
最后,我们来了解一下碳负离子重排的使用方法。
首先,选择合适的碳负离子重排产品。
市面上有很多不同的产品,包括碳负离子贴、碳负离子仪器等。
根据实际需要选择适合的产品进行使用。
其次,正确使用产品。
按照产品说明书的指导,将产品贴于身体相应部位,保持一定时间,让离子重新排列。
使用过程中要注意卫生,保持产品的清洁。
最后,持续使用并结合其他保健方法。
碳负离子重排并不是一劳永逸的过程,需要坚持使用,并结合锻炼、饮食等多种保健方法才能达到最佳效果。
综上所述,碳负离子重排是一种以调整离子平衡为原理的生物科技技术。
它在美容、伤口愈合和疾病治疗等方面具有广泛的应用,并且使用方法简便。
然而,读者在使用时也需要注意选择合适的产品,并结合其他保健方法,才能达到最佳效果。
希望本文能给读者提供一些有关碳负离子重排的全面指导。


化学反应的亲电重排机理亲电重排是一种广泛应用于有机化学领域的重要化学反应。
它能够实现结构的转变,从而产生新的有机化合物。
在亲电重排反应中,分子内的化学键重新排列,通常是通过亲电中心的重排来实现的。
本文将详细介绍亲电重排反应的机理。
一、亲电重排反应的定义与分类亲电重排反应是在化学反应中,由于亲电强迫作用而导致分子内键重新排列的过程。
根据亲电中心的位置,亲电重排反应可以分为两类:1)碳原子的亲电重排;2)非碳原子的亲电重排。
二、碳原子的亲电重排机理在碳原子的亲电重排反应中,亲电中心通常是位于一个碳原子上,通过质子迁移,形成一个自由的负电荷的碳离子(负离子)。
这个负离子经过构象重排或结构调整,最终形成一个新的化学键。
碳原子的亲电重排机理可以通过以下步骤来描述:1. 亲电中心的形成:在反应中,一个碳原子上的双键或者孤对电子会作为亲电中心,接受一个亲电。
这个亲电可以是一个正离子(如质子H+)或者一个亲电试剂。
2. 质子迁移:亲电中心上的质子被迫转移到相邻的碳原子上,形成一个自由的负电荷的碳离子。
3. 构象重排:碳离子可以经历构象重排或结构调整,通过倾斜或旋转化学键的方式,重新排列它们的连接方式。
4. 键形成:最终,新的化学键被形成,以稳定碳离子中的负电荷。
三、非碳原子的亲电重排机理非碳原子的亲电重排反应中,亲电中心通常位于非碳原子上,比如氧、氮等。
非碳原子的亲电重排机理与碳原子的亲电重排机理类似,也包括亲电中心的形成、质子迁移、构象重排和键形成等步骤。
但由于非碳原子的特殊性,这些步骤可能存在一些差异。
四、亲电重排反应的应用亲电重排反应在有机合成中有着广泛的应用。
通过选择不同的亲电试剂和反应条件,可以实现特定官能团的转化。
例如,亲电重排反应可以用于制备环状化合物、杂环化合物以及有机合成中的其他重要中间体。
结论亲电重排反应是一种重要的化学反应,通过亲电中心的重排,能够改变有机化合物的结构。
碳原子的亲电重排和非碳原子的亲电重排都遵循着一定的机理,包括亲电中心的形成、质子迁移、构象重排和键形成等步骤。
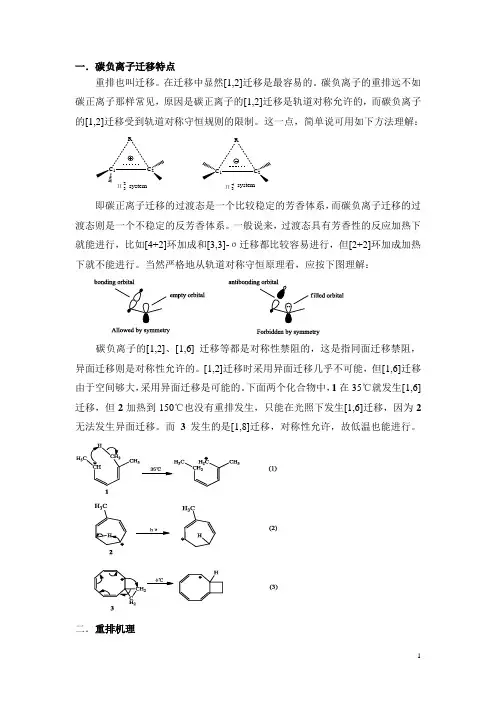
一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1C 2RC 1C 2RΠ32Π34systemsystem即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示)芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。

favorskii重排反应机理
Favorskii重排反应是一种有机合成反应,特别是在羰基化合物中,它发挥着重要的
作用。
该反应通过1,2-醛缩基团的自发性裂解,来形成同时存在碳负离子的不稳定中间体,然后再通过重排反应生成新的有机化合物。
Favorskii重排反应机理具体如下:
首先,在存在氢氧离子的存在下,醛基底物和碱性的季铵盐中间体通过醛缩反应发生
了反应。
这种反应生成的产物是光稳定的季铵盐缩合物,但这个中间体是不稳定的,因为
它存在着1,2-醛缩的羰基基团。
这个羰基具有高度极性,因此势能较高,导致了其自发裂解的倾向性。
接下来,这个羰基基团裂解成羰基碳正离子和氧负离子。
新的中间体中,羰基碳原来
是被覆盖的,但现在已经成为了一个孤独的碳离子。
这种离子形式非常稳定,而且具有高
反应性。
因此,它会试图寻找其他的反应物来与之反应。
总的来说,Favorskii重排反应机理是由三个步骤组成的:醛缩反应裂解、羰基碳、
氧负离子反应、羟甲基替换反应。
这种反应的特点是它的反应物和产物都是类似于醛和酮
的化合物,因此很容易进行分类和识别。
这些化合物中普遍存在于有机化学中,因此Favorskii重排反应对于有机化学有很高的实用价值。
碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。
有机化学中的重排反应合成方法重排反应是有机化学中一类非常重要的反应类型,通过此类反应可以有效地合成复杂的有机化合物。
本文将介绍有机化学中常见的重排反应及其合成方法。
一、醇重排反应醇重排反应是指醇分子在一定条件下发生内部原子或官能团重排,从而生成具有不同结构的醇化合物。
常见的醇重排反应有醇的断裂与迁移重排、氧化重排和氧杂环重排等。
1. 醇的断裂与迁移重排醇的断裂与迁移重排是指醇分子中的C-O键发生断裂与迁移,生成具有不同碳骨架的醇化合物。
常见的醇的断裂与迁移重排反应包括β-消除重排、E1cb机理的重排和Pinacol重排等。
2. 氧化重排氧化重排是指醇分子在氧化剂的作用下发生内部重排,生成具有不同碳骨架的醇化合物。
常见的氧化重排反应有Baeyer-Villiger氧化重排和尤格催化剂氧化重排等。
3. 氧杂环重排氧杂环重排是指含氧杂环化合物在一定条件下发生内部重排,生成具有不同结构的醇化合物。
常见的氧杂环重排反应包括Pummerer重排和Beckmann重排等。
二、烯重排反应烯重排反应是指具有烯丙基结构的有机化合物在一定条件下发生结构重排,生成具有不同结构的化合物。
常见的烯重排反应包括烯醇重排、烯丙基重排和烯烃转位等。
1. 烯醇重排烯醇重排是指烯醇分子在一定条件下发生内部重排,生成具有不同碳骨架的化合物。
常见的烯醇重排反应有脱醇重排和β-取代基迁移等。
2. 烯丙基重排烯丙基重排是指具有烯丙基结构的化合物在一定条件下发生结构重排,生成具有不同碳骨架的化合物。
常见的烯丙基重排反应有烯丙醇重排和烯丙基迁移等。
3. 烯烃转位烯烃转位是指具有烯烃结构的有机化合物在一定条件下发生结构转位,生成具有不同碳骨架的化合物。
常见的烯烃转位反应包括Cope重排和Claisen重排等。
三、碳负离子重排反应碳负离子重排反应是指碳负离子化合物在一定条件下发生内部重排,生成具有不同碳骨架的化合物。
常见的碳负离子重排反应有甲基重排、氢负离子迁移和羰基碳负离子重排等。
碳正离子与碳负离子的对比一、碳正离子1.碳正离子的产生碳正离子可以认为是通过C-C 单键中一对电子的异裂形成的,式中X 代表卤素。
碳正离子中带正电荷的碳原子是sp 2 杂化,三个杂化轨道呈平面排列与其他原子或基团成键,键角约为120o ,有一个垂直于此平面的空p 轨道,这个空的P 轨道与化学性质密切相关。
B碳正离子很不稳定,需要电子来完成八隅体构型,因此任何给电子的因素都能使正电荷分散而稳定,任何吸电子的因素均能使正电荷集中而更不稳定。
故而R 的共轭效应,给电子的诱导效应和立体效应,以及烷基的超共轭效应都能对碳正离子起稳定作用。
2.碳正离子的稳定性烷基有给电子的诱导效应,故带正电荷的碳上的烷基越多,给电子的诱导效应越大,使正电荷越分散而稳定。
还有超共轭效应,也使得碳正离子更稳定。
P-π共轭也能使正电荷分散而稳定,碳正离子与不饱和的烯或芳基相连时,共轭体系越多,碳正离子越稳定。
(CH 3)3C +>(CH 3)2C +H>CH 3C +H 2>C +H 3 (CH 2=CH)3C +>(CH 2=CH)2C +H>CH 2=CHC +H 2由于碳正离子中带正电荷的碳原子是sp 2 杂化,桥头碳原子由于桥的刚性结构,不形成具有平面三角形的SP 2轨道的碳正离子,即使能形成也很不稳定。
3.碳正离子的反应(1)与与亲核试剂结合:R ++Nu —→R —Nu (2)消除邻位碳上的一个质子而形成烯烃:(3)和烯烃加成形成更大的碳正离子:R 3CXR 3C+XoC +3C +2HC+H 2>>CHC+C CR ++C CC C +R(4)使芳香环烷基化:(5)重排成为更稳定的碳正离子:在有碳正离子的反应中,例如S N 1中,其反应机理如下:R 33C ++X _ R 3C ++N u 3CNu由于碳正离子的平面结构,带正电的碳原子上有一个空的P 轨道,如果该碳原子上连接着三个不同的基团,由于亲核试剂从平面两边进攻的机会相等,因而可以得到“构型保持”和“构型翻转”两种化合物如下:S N 1反应中还包含了碳正离子的另一个重要的反应—重排反应,如上面已给的图中,由一级碳正离子转变为三级碳正离子就是一个重排反应。
一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1C RΠ3Π34system即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:—碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示);芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
&多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。
不过(8)式中苯基的迁移能力优先于对甲苯基,表明苯基的迁移中间体是碳负离子。
如果中间体是自由基,则由于对甲苯基对自由基的稳定能力大于苯基,则对甲苯基应优先迁移。
'虽然大部分苯基的迁移遵循加成-消去机理,但例外的情况总是有的。
(9)式显然是一个消除-加成的机理。
之所以发生这样进行,是因为消除后能得到一个稳定的产物二苯乙烯和一个稳定的中间体苄基负离子,而按照加成-消去进行得到的中间体负离子不如苄基负离子稳定。
而苄基负离子之所以能和二苯乙烯加成(一般负离子不能和烯烃加成,为什么),是因为加成后得到的负离子比苄基负离子更加稳定。
既然高烯丙基负离子中的碳负离子可以与C=C双键加成形成三元环,这种进攻当然是亲核进攻,那么把C=C双键改为C=O双键,则这种重排显然要快得多,事实的确如此,见下一页的反应式(10)。
反应(10)是一个酮的碳负离子的重排。
要想形成碳负离子,当然要先拔掉H离子。
要形成类似高烯丙基负离子的重排,酮就要拔掉β碳上的H离子。
但众所周知,酮的α碳上H离子酸性大大高于β碳上的H离子,所以一般情况下酮的碳负离子重排几乎不可能发生。
茨尼酮能发生重排,是因为它虽有α氢,但这个H拔掉后形成的负离子无法与羰基共轭(桥头不能形成双键),所以这个α氢实际上没有酸性,强碱首先拔掉的是β氢,形成的负离子可以通过进攻羰基而得到稳定化。
所以酮负离子重排的前提是酮必须没有活泼α氢。
\没有α氢的二叔丁基酮可以在强碱下发生碳负离子重排,见反应(11)。
&如果位置合适,甚至γ氢也可以拔掉进行负碳离子重排。
碳负离子的加成-消除机理能进行的化必须有一个前提,即分子内必须有一个不饱和基团,否则第一步的加成无法进行,这个不饱和基团可以是乙烯基、芳基或者羰基,对于羰基的场合必须要求羰基没有活泼α氢。
这种机理和碳正离子重排很不相同,不过有一点是一样的,那就是:重排是可逆的,重排动力都是为了形成更稳定的中间体。
2.自由基机理(Wittig 重排)…对于α位含有杂原子的碳负离子来说,发生[1,2]重排在能量上是有利的,因为重排后负电荷位于电负性很大的杂原子上(通常是O原子)。
当这种碳负离子不含有不饱和基团,或者不饱和基团位置不合适时,肯定不能按照消除-加成机理进行重排,实验证明此时按照自由基机理进行重排。
机理如下:~其中,丁基自由基可以由甲基自由基和丁基负离子反应得到,这是一个正向有利的平衡反应。
根据这种机理,烯丙基负离子发生Wittig重排时,会有[1,2]重排和[1,4]重排两种产物,这是由自由基共振造成的。
3.协同反应机理([2,3]-Wittig 重排)—在Wittig 重排中,如果反应物是烯丙基醚(与反应式14不同,碳负离子位置不同),则容易发生[2,3]-Wittig重排,而按Wittig重排发生的[1,2]迁移则是副产物。
例如:[2,3]-Wittig 重排[1,2]迁移[2,3]-Wittig重排从表面上看就不属于碳负离子的[1,2]迁移,不存在对称性禁阻的问题,可以按协同反应机理进行。
实际上,[2,3]-Wittig重排的本质和常见的Cope重排及[3,3]-σ迁移是一样的,它们的过渡态是等电子体系,只不过是用碳负离子的两个电子代替双键的两个电子而已。
在(16)式的[2,3]-Wittig重排中碳负离子的构型会进行完全翻转,产物构型是唯一的,说明[2,3]-Wittig重排的确是协同反应。
(16)式还能说明一点,即协同的亲电取代反应也是背后进攻,构型反转的,这与协同的亲核取代(S N 2)反应是一样的。
O R3RLiRC OR2CH=CH 2(16)(15)中[1,2]迁移产物当然是对称性禁阻的,所以是非协同反应,它的生成机理就是上一节讨论的自由基机理,此处不再讨论。
由于自由基机理在高温下容易进行,所以温度升高时,[1,2]迁移产物的确增加了。
.三.叶立德重排分子中具有相反电荷的两个原子相互链接成键,叫做叶立德(ylide )。
多数情况下,带负电荷的原子是碳,所以叶立德的重排也属于碳负离子重排,叫做Stevens 重排。
但是带正电荷的原子决不能是碳,只能是没有空轨道的N 、S 等原子;P 原子也不行,因为P 的空3p 轨道可以和碳负离子成π键而稳定,这就是Wittig 试剂, Wittig 试剂不发生Stevens 重排。
在叶立德重排中,正电荷原子没有空轨道,不能像碳正离子那样发生重排,所以叶立德的重排实际上和碳负离子的重排没有本质上的区别。
不过叶立德重排后会变成一个中性分子,比原来的叶立德稳定得多,所以叶立德重排在能量上十分有利,是放热反应。
叶立德重排一般遵循先分裂再结合的自由基机理,所以会有共振产物和分子内交叉产物,而且实验上发现Stevens 重排活化熵是很大的正值,这与预期相吻合。
例如:C 6H 5CH 2N CH 3CH3CH 2=CH 2(CH 3)2N CH CH=CH 2CH 2C 6H 5(CH 3)2NCH=CH CH 2CH 2C 6H 5+(17)|CH3SCH2C6H5CC6H5OCH3S CH CC6H52C6H5O+CH3S CH CC6H5OCH3S CH CC6H5O+C6H5CH2-CH2C6H5(18)同碳负离子一样,叶立德也能发生协同的[2,3]-σ迁移,只不过名字改成Sommelet-Hauser重排。
Sommelet-Hauser重排由于是协同的,通常都比非协同的Stevens重排快,是优先进行的重排,例如:S(19)四.分子内取代反应引起的重排1.Favorskii重排:α-卤代酮或环氧酮在碱催化下烷基从羰基迁移到α-碳的反应叫做Favorskii重排。
如下面例子:《25%(20)该反应机理由Loftfield提出如下:这个机理有如下一些证据支持:(1)环丙酮中间体的存在。
(环丙酮是一个非常活泼的酮,原因是羰基碳角张力非常大。
羰基碳是sp 2杂化,键角要求是120°,而三元环实际键角在60°左右,差距太大,所以羰基有强烈的加成倾向,因为加成后C 原子变为sp 3杂化,要求的键角变成°,则要求与现实之间差距变小,稍微稳定。
如果环丙酮带上两个位阻大的取代基来妨碍亲核试剂的进攻,则这样的环丙酮可以稍微稳定,从而能分离得到。
下面这个α-卤代酮在与NaOH 的反应中确实分离得到了2,3-二叔丁基环丙酮。
(CH 3)3CCH 2CCHC(CH 3)3ClONaOHO(H 3C)3CC(CH 3)3(22)(2) 立体化学证据。
在下面这两个例子中,α碳的构型都发生了反转。
》CCH 3O3NaOCH 3ether3COCH 33(23)CCH 3O 3NaOCH 3etherCOCH 3O33(24)23242526反应的立体化学变化过程如下所示:在上述过程中,当甲氧基负离子进攻环丙酮时,总是断裂b 键而不断裂a 键,原因是取代基少的负离子更加稳定。
当用醚作溶剂时,23几乎全部生成25,表明速率决定步骤是S N2反应。
不过实验发现,若使用溶剂化能力强的甲醇做溶剂,则无论以23还是24做原料,反应后都得到25和26的混合物,表明此时速率决定步骤可能是S N1反应。
原因是溶剂化能力强的时候,碳负离子(即烯醇负离子)被溶剂化,亲核能力下降,同时Cl离子先离去后,形成的碳正离子因溶剂化而稳定,所以此时发生分子内S N1反应可能性大大增加。
2.准Favorskii重排:Favorskii重排的起始步骤是酮的α-氢被碱拔掉,然后发生分子内亲核取代。
但是实验发现有些酮没有α-氢,或者α-氢根本没有酸性(不能被烯醇的α-氢没有酸性),但这些酮也能发生Favorskii重排,只不过速度比较慢而已,于是把这种重排叫做准Favorskii重排或半Favorskii重排。
有些酮,虽然α-氢有酸性,但是不能像Favorskii重排那样形成三元环,如(27)式,那么这样的酮也按准Favorskii重排机理进行反应。
如下面这些例子:&3. Ramburg-Backlund反应:α卤代砜在碱作用下,连在砜上的两个烷基以双键相连,最后得到烯烃的反应。
反应机理如下:机理中最后一步反应消除SO 2的反应当然是SO 2和烯烃加成反应的逆反应。
凡是既含有空轨道又含有孤对电子的体系都可以和烯烃加成形成三元环,如卡宾、Br 鎓离子和SO 2等,由于这种加成是可逆的,所以三元环的砜容易消除SO 2得到烯烃。
不过CO 不能与烯烃加成,因为形成的环丙酮太不稳定(角张力大)。
4. Neber 重排:N 上带有离去基团的亚胺在强碱作用下N 原子发生迁移形成一个α-氨基酮的反应。
该反应机理如下:C 6H 5C NXCH 2CH 3B C 6H 5CCHCH 3C 6H5C CHCH 3N H 2OC 6H 5C O CHCH 3NH 2(32)碳 负 离 子 重 排 习 题1. 写出下列反应产物(5)H2CCCH3 N3H A ketone2. 写出下列反应机理。