2006年全国普通高等学校招生考试化学重庆
- 格式:doc
- 大小:956.50 KB
- 文档页数:3

2006年普通高等学校招生全国统一考试(重庆卷)数学试题卷(理工农医类)一、选择题:本大题共10小题,每小题5分。
在每小题给出的四个备选项中,只有一项是符合题目要求的。
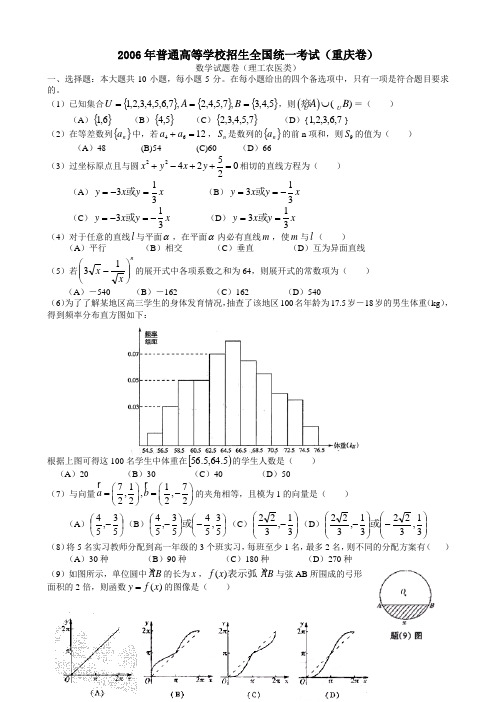
(1)已知集合{}{}{}5,4,3,7,5,4,2,7,6,5,4,3,2,1===B A U ,则()()U U A B ⋃痧=( )(A ){}6,1 (B ){}5,4 (C ){}7,5,4,3,2 (D ){7,6,3,2,1}(2)在等差数列{}n a 中,若4612a a +=,n S 是数列的{}n a 的前n 项和,则9S 的值为( ) (A )48 (B)54 (C)60 (D )66(3)过坐标原点且与圆2254202x y x y +-++=相切的直线方程为( ) (A )x y x y 313=-=或 (B )x y x y 313-==或(C )x y x y 313-=-=或 (D )x y x y 313==或(4)对于任意的直线l 与平面α,在平面α内必有直线m ,使m 与l ( )(A )平行 (B )相交 (C )垂直 (D )互为异面直线(5)若nx x ⎪⎪⎭⎫ ⎝⎛-13的展开式中各项系数之和为64,则展开式的常数项为( )(A )-540 (B )-162 (C )162 (D )540(6)为了了解某地区高三学生的身体发育情况,抽查了该地区100名年龄为17.5岁-18岁的男生体重(kg ),得到频率分布直方图如下:根据上图可得这100名学生中体重在[)5.64,5.56的学生人数是( ) (A )20 (B )30 (C )40 (D )50(7)与向量7117,,,2222a b ⎛⎫⎛⎫==- ⎪ ⎪⎝⎭⎝⎭的夹角相等,且模为1的向量是( )(A )⎪⎭⎫ ⎝⎛-53,54(B )⎪⎭⎫ ⎝⎛-⎪⎭⎫ ⎝⎛-53,5453,54或(C )⎪⎪⎭⎫ ⎝⎛-31,322(D )⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛-31,32231,322或 (8)将5名实习教师分配到高一年级的3个班实习,每班至少1名,最多2名,则不同的分配方案有( )(A )30种 (B )90种 (C )180种 (D )270种(9)如图所示,单位圆中AB 的长为x ,()f x 表示弧 AB 与弦AB 所围成的弓形面积的2倍,则函数()y f x =的图像是( )(10)若,,0a b c >且()4a a b c bc +++=-则2a b c ++的最小值为( )(A 1 (B 1 (C )2 (D )2 二、填空题:本大题共6小题,每小题4分,共24分。

贵州省丹寨民族高级中学2006年11月教师解题能力竞赛化学试卷 (考试时间120分钟,满分216分)姓名:成绩:可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32Cl—35.5 K—39 Ca—40 Fe—56 Cu—64 Ba—137一、选择题(本题包括16小题,每小题6分,共96分。
每小题只有一个选项符合题意..........。
请将正确选项1、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于:(A) 分子晶体(B) 原子晶体(C) 离子晶体(D) 何种晶体无法判断2、下列叙述正确的是:(A) 同一主族的元素,原子半径越大,其单质的熔点一定越高(B) 同一周期元素的原子,半径越小越容易失去电子(C) 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高(D) 稀有气体元素的原子序数越大,其单质的沸点一定越高3、用N A代表阿伏加德罗常数,下列说法正确的是:(A) 0.5 mol Al与足量盐酸反应转移电子数为1N A(B) 标准状况下,11.2 L SO3所含的分子数为0.5N A(C) 0.1 mol CH4所含的电子数为1N A(D) 46 g NO2和N2O4的混合物含有的分子数为1N A4、把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为:(A) 1 : 2 : 3 (B) 3 : 2 : 1 (C) 6 : 3 : 1 (D) 6 : 3 : 25、将浓度均为0.1mol·L—1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是:(A) BaCl2、NaOH 、NaHCO3(B) Na2CO3、MgCl2、H2SO4(C) AlCl3、NH3•H2O 、NaOH (D) Ba(OH)2、CaCl2、Na2SO46、在0.1mol·L—1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO—+ H+对于该平衡,下列叙述正确的是:(A) 加入水时,平衡向逆反应方向移动(B) 加入少量NaOH固体,平衡向正反应方向移动(C) 加入少量0.1mol·L—1 HCl溶液,溶液中c(H+)减小(D) 加入少量CH3COONa固体,平衡向正反应方向移动7、茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:关于茉莉醛的下列叙述错误..的是:(A) 在加热和催化剂作用下,能被氢气还原(B) 能被高锰酸钾酸性溶液氧化(C) 在一定条件下能与溴发生取代反应(D) 不能与氢溴酸发生加成反应8、由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH = 1,c(Al3+) = 0.4 mol·L—1,c (SO42—) = 0.8 mol·L—1,则c(K+)为:(A) 0.15 mol·L—1 (B) 0.2 mol·L—1(C) 0.3 mol·L—1(D) 0.4 mol·L—19、下列做法正确的是:(A) 将浓硝酸保存在无色玻璃瓶中(B) 用镊子取出白磷并置于水中切割(C) 把氯酸钾制氧气后的残渣倒入垃圾桶(D) 氢气还原氧化铜实验先加热再通氢气10、设N A代表阿伏加德罗常数,下列说法正确的是:(A) 5.6 g铁与足量盐酸反应转移的电子数为0.3 N A(B) 100 mL 2.0 mol·L—1的盐酸与醋酸溶液中氢离子均为0.2 N A(C) 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 N A(D) 20 g重水(D2O)中含有的电子数为10 N A11、能正确表示下列反应的化学方程式是:(A) 黄铁矿煅炼:2FeS2 + 5O22FeO + 4SO2(B) 石英与石灰石共熔:SiO2 + CaO CaSiO3(C) 氨的催化氧化:4NH3 + 5O2 4NO + 6H2O(D) 氯气与石灰乳反应:2Cl2+ 2Ca(OH) 2 =CaCl2 + CaClO2 + 2H2O12、:温度相同、浓度均为0.2 mol·L—1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是(A) ③①④②⑥⑤(B) ①③⑥④②⑤(C) ③②①⑥④⑤(D) ⑤⑥②④①③13、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、─CH=C—CHOCH2(CH2)3CH32800 kJ /mol ,则下列热化学方程式正确的是:(A) C (s) + 2(g) = CO (g) ; △H = —393.5 kJ /mol (B) 2H 2 (g) + O 2 (g) = 2H 2O(g) ; △H = +571.6 kJ /mol(C) CH 4(g) + 2O 2(g) = CO 2(g) + 2H 2O(g) ;△H = —890.3 kJ /mol (D) 6H 12O 6(s) +3O 2(g) = 3CO 2(g) + 3H 2O(l);△H = —1400 kJ /mol 14、已知反应m X(g) + n Y(g)q Z(g) 的△H <0,m +n >q ,在恒容密闭容器中反应达到平衡时,下列说法正确的是:(A) 通入稀有气体使压强增大,平衡将正向移动(B) X 的正反应速率是Y 的逆反应速率的 倍 (C) 降低温度,混合气体的平均相对分子质量变小 (D) 增加X 的物质的量,Y 的转化率降低15、利尿酸在奥运会上被禁用,其结构简式如图所示。

2006年高考化学试题(高一内容)2006高考化学江苏部分:1.空气是人类生存所必需的重要资源。
为改善空气质量而启动的“蓝天工程”得到了全民的支持。
下列措施不利于...“蓝天工程”建设的是A.推广使用燃煤脱硫技术,防治SO2污染B.实施绿化工程,防治扬尘污染C.研制开发燃料电池汽车,消除机动车尾气污染D.加大石油、煤炭的开采速度,增加化石燃料的供应量2.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是A.一个D2O分子所含2的中子数为8 B.NH3的结构式为C.HCl的电子式为D.热稳定性:H2S>HF6.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是A.1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023B.Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023C.32 g S8单质中含有的S—S键个数为6.02×1023 S8分子结构模型D.22.4 L N2中所含的分子数为6.02×10239.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。
X原子的最外层电子数是其电子层数的3倍。
Z原子的核外电子数比Y原子少1。
下列说法正确的是A.元素非金属性由弱到强的顺序为Z<Y<XB.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4C.3种元素的气态氢化物中,Z的气态氢化物最稳定D.原子半径由大到小的顺序为Z>Y>X15.下列关于晶体的说法一定正确的是A.分子晶体中都存在共价键B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金属晶体的熔点都比分子晶体的熔点高19.(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。

Ed ward.根据短文内容,回答问题。
96.What was wrong with the wife?97.Did the wi fe go shopping wi th her husband?98.Where did the husband put the baby while he wasshopping?99.What did the woman in the supermarket thi nk ofthe husband at firs t?100.Who is the father,George or Edward?五、书面表达(共10分)!.请以∀My Hobby 为题写一篇短文。
说说你的爱好是什么?你为什么喜欢它?它对你的生活或学习产生了什么样的影响?要求:1.语句通顺,合乎逻辑。
2.词数60#80。
3.文中请勿使用真实的姓名与学校名称。
注:参考答案见本期第47页。
(考 评 提供)2006年重庆市初中毕业生学业暨高中招生考试化学试题可能用到的相对原子质量:H#1 O#16 S#32一、选择题(每小题2分,共30分;每小题只有一个选项符合题意)1.厨房里发生的下列变化中不包含化学变化的是( ).(A)沼气燃烧(B)铁锅生锈(C)水沸腾(D)蔬菜腐烂2.小巧在家里测定了一些液体的p H,她的测定或记录一定有误的是( ).(A)雨水pH=5(B)柠檬汁p H=2(C)肥皂水p H=4(D)洗涤剂p H=123.林强家里种的花出现叶子发黄的现象,老师告诉他需要施氮肥,他应该施用以下肥料中的( ).(A)NH4HCO3(B)Ca3(PO4)2(C)KCl(D)K2SO44.水是宝贵的自然资源,以下关于水的叙述中正确的是( ).(A)冰的密度小于水的密度(B)水由氢气和氧气组成(C)生活废水不会污染江河(D)淡水资源取之不尽5.建设节约型社会人人有责.下列节约行为中合理可行的是( ).(A)直接用工厂排出的废水灌溉农田(B)吃经高温蒸煮后的霉变大米(C)把用剩的药品放回原试剂瓶(D)用洗菜、洗衣服的水冲厕所6.合理利用燃料,防止污染环境是可持续发展的重要方面.关于燃料的说法错误的是( ).(A)酒精是比汽油更环保的燃料(B)天然气是比煤更清洁的燃料(C)氢气是比天然气更理想的燃料(D)石油是工厂经常使用的燃料7.每年的6月26日是国际禁毒日.一种新型毒品K粉的主要成分是盐酸氯胺酮,盐酸氯胺酮的化学式为C13H16ONCl,它会对大脑造成永久损害.下列叙述中错误的是( ).(A)青少年应该远离毒品(B)K粉是纯净物(C)盐酸氯胺酮由五种元素组成(D)盐酸氯胺酮中氢元素和氧元素的质量分数相同8.二氧化碳的下述用途没有利用其化学性质的是( ).(A)CO2用作气体肥料432007年第3期(B)C O 2用于灭火(C)干冰用于人工降雨(D)CO 2用来制Na 2C O 39.下列陈述不正确的是( ).(A)分子可以分解成原子(B)原子由原子核和电子构成(C)阳离子得到电子变成原子(D)原子失去电子变成阴离子10.(课改实验区考生做)材料与人类生活紧密相关.下列物品与所用材料的对应关系不正确的是( ).(A)羊绒衫###天然纤维(B)汽车轮胎###塑料(C)食品袋###塑料(D)不锈钢餐具###铁合金(非课改实验区考生做)对下列物质性质的描述中错误的是( ).(A)AgCl 是白色固体(B)无水CuSO 4是蓝色固体(C)Fe 3O 4是黑色固体(D)Fe(OH)3是红褐色固体11.以下判断正确的是( ).(A)只有在点燃或加热时,可燃物才能燃烧(B)只要温度达到着火点,可燃物就能燃烧(C)只有含碳元素的物质才能燃烧(D)只要使可燃物温度降到着火点以下,就能够灭火12.能够说明∀分子间存在间隔 的事实是( ).(A)空气被压缩后体积缩小(B)1L 芝麻和1L 绿豆混匀后体积小于2L (C)走近花园,闻到花香(D)2L H 2和O 2的混合气体点燃后体积小于2L 13.实验室制取氧气时,必须满足的条件是( ).(A)必须使用催化剂(B)(C)(D)14.KAl (SO 4)m 可( ).(A)1(B)215.按酸、碱、盐、氧化物的顺序排列的一组物质是( ).(A)H 2SO 4、Na 2CO 3、NaCl 、CuO(B)H 2O 、Ca(OH)2、HCl 、Na 2SO 4(C)H 2SO 4、NaOH 、Na 2CO 3、Fe 2O 3(D)NaOH 、H 2CO 3、NaCl 、C O 2二、填空题(共44分)16.(4分)(课改实验区考生做)某校食堂中餐食谱如下:主食:大米饭配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤炒猪肝主食和配菜中主要含维生素、、、、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加的配菜是.(非课改实验区考生做)氢气和一氧化碳都具有的化学性质是性和性,点燃它们之前都需要,实验室制取它们时都可用法收集.17.(6分)小强在厨房里发现一瓶没有标签的无色液体.(1)他闻了闻,初步判断为白醋,小强是利用白醋的(填∀物理 、∀化学 )性质作出的判断;(2)他取少量此液体放入玻璃杯中,加入纯碱,产生气体,说明该液体含有(填∀酸性 、∀碱性 或∀中性 )物质,进一步判断为白醋;(3)他另取少量此液体滴入石蕊试液,溶液变为色,要使其变为蓝色,可向其中加入(填编号).a.食盐b.熟石灰c.白酒d.水18.(9分)写出下列反应的化学方程式,并指出其基本反应类型:(1)磷在氧气中燃烧:( )(2)加热高锰酸钾制氧气:( )(3)将铁片放入硫酸铜溶液中:( )19.(3分)为了探究影响金属与酸反应剧烈程度的因素,进行了如表1所记录的实验.表 144中学教与学由此得出影响金属与酸反应剧烈程度的因素包括:因素一:;因素二:;因素三:.20.(12分)从HCl 、NaCl 、NaOH 、Na 2CO 3、Ca(OH)2几种溶液中取出其中的两种混合,可能的组合共有种.(1)若混合后溶液的质量减小,可能的组合是、;(2)若混合后溶液的质量不变,但发生了化学反应,有关的化学方程式为: ;图1(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生的气体与加入的稀硫酸有如图1所示的关系,则这样的组合可能是 .21.(10分)20∃时,取相同质量的a 、b 、c 三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40∃,固体的溶解情况如图2所示.图3为a 、b 、c 三种物质的溶解度曲线.请仔细阅读图2和图3,回答下列问题:图2图3(1)三种物质的溶解度关系为b>a>c 时的温度为t ,则t 的取值范围是;(2)烧杯甲里是物质的溶液,烧杯乙里是物质的溶液;(3)40∃时,烧杯里的溶液中溶剂最少;(4)各种状态下,各烧杯(甲、乙、丙)里的溶液溶质的质量分数的比较一定正确的是.(A)甲(状态2)>甲(状态1)(B)乙(状态1)>甲(状态3)(C)甲(状态1)=乙(状态2)(D)乙(状态3)>丙(状态3)三、实验题(共16分)22.(6分)(1)选择仪器的序号填空:%量筒 &烧杯 ∋玻璃棒 (试管 )蒸发皿常用作少量药品反应的容器是,用于量取一定体积的液体的仪器是;(2)为完成过滤操作,除选用(1)中的部分仪器外,还缺少的玻璃仪器是.23.(10分)化学兴趣小组用以下装置探究炼铁的原理.(1)加热Fe 2O 3之前要先通一会儿C O ,目的是 ;(2)如图4所示的实验装置中的方框里连接的是C 和D,导管接口的连接顺序为a ∗( )∗( )∗( ),如果导管连接错误,后果是;图4(3)玻璃管A 中发生反应的化学方程式为,用这种方法∀炼 得的铁与工业上炼出的生铁在组成上的最大区别是 .四、计算题(共10分)24.(3分)煤炭中往往含有硫,直接燃烧产生的二氧化硫会污染环境.计算含硫400g 的煤炭燃烧时产生二氧化硫的质量.25.(7分)过氧化氢的水溶液俗称双氧水,其在放置过程中会缓慢分解,化学方程式为:2H 2O 22H 2O+O 2+现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息:%H 2O 2的质量分数为30%;&内装溶液的质量为1000g.经实验测定,其中H 2O 2的质量分数仅为10%.(1)若用这瓶双氧水配制H 2O 2的质量分数为3%的医用双氧水1500g,需用这种双氧水的质量是452007年第3期多少?(2)计算这瓶双氧水中已分解的过氧化氢的质量.(计算结果保留整数)注:参考答案见本期封三.(考 评 提供)九年级结课英语质量检测题参考答案一、1#5 CACAB 6#10 AABCB 11#15 BB CAA 16#20 CBABC 21#25 CBABB 26#30 ACCCB二、31#35 BCBC A 36#40 ADABC 41#45 CCACC三、46#50 ABCDC 51#55 ABDCD四、56#60 DDCCA 61#65 CACDD 66#70 CDBAB五、71#72 i s worth 73#74 rich in 75#76 used to 77#78 trying out 79#80 knocked down六、81.No,I haven t 82.How did it happen 83. What did the driver do with hi m 84.How is the child now85.I hope everything goes well七、86#90 FFTFT八、91.says 92.and 93.play 94.spend95.way e 97.read 98.make 99.with 100.public九、略听力录音稿A)1.May I borrow your bicycle,please?2.Who i s that girl?3.How was your holiday?4.How does he work in the factory?5.What s wrong wi th you,young man?6.Why was Mr.Wang worried?7.Where have you been this morning?8.Why didn t you stay a little longer?B)9.T om is a schoolboy.He is15.10.My friends had a good ti me in the park yesterday.11.I received a letter from Ji m yesterday.12.T he dictionary is very expensive.13.This cake is the biggest of the three.14.Shall we leave at a quarter past ten?15.People from Hunan prefer hot food to sweet food.16.∀Don t make any noise,Bill. the teacher said.C)17.M:What bad weather!I don t like the rain!W:The rain won t last long.The radio says it will be fine later on.18.M:What would you li ke to do this Sunday?W:How about goi ng fishing?M:That s not a bad idea.19.W:You look worried.What s the matter,Paul?M:I left my homework at home.20.M:Are we going to have an English exam nextweek?W:No,we aren t.But don t you know we are going to help some farmers wi th their orangeharvest next week?M:Wonderful!Working on the farm is much bet ter than having any classes!21.W:Are you going to spend the Spring Festivalhere in China?M:No,I m goin g abroad to spend the holidays.W:Where are you going?M:Australia.There are lots of beautiful places to visit,and the weather there is nice.22.M:E x cuse me.Where s the nearest post office?W:Walk along this street.Take the second turn ing on the left.T hen go ahead.You ll find agreen house between a bookshop and ahospital.That s the post office.23.W:Mr.and Mrs.Lee,thank you very much forsuch nice food.I m afraid I ll have to go backnow.M:Please come over again.Take good care of yourself.W:Thanks a lot.24.W:Did you see the football match yesterdayevening,David?M:Oh,I missed it,Alice!By the time I turned on the TV,it had already finished.W:Never mind.It s just a waste of time.D)听下面一段材料,回答第25至第27题。
2006年普通高等学校招生全国统一考试理科综合能力测试(I)1、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于A、分子晶体B、原子晶体C、离子晶体D、何种晶体无法判断2、下列叙述正确的是A 同一主族的元素,原子半径越大,其单质的熔点一定越高B 同一周期元素的原子,半径越小越容易失去电子C 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高D 稀有气体元素的原子序数越大,其单质的沸点一定越高3、用N A代表阿伏加德罗常数,下列说法正确的是A 0.5mol Al与足量盐酸反应转移电子数为1N AB 标准状况下,11.2L SO3所含的分子数为0.5N AC 0.1mol CH4所含的电子数为1N AD 46g NO2和N2O4的混合物含有的分子数为1N A4、把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为A、1︰2︰3B、3︰2︰1C、6︰3︰1D、6︰3︰25、浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是A BaCl2 NaOH NaHCO3B Na2CO3 MgCl2 H2SO4C AlCl3 NH3·H2O NaOHD Ba(OH)2 CaCl2 Na2SO46、在0.1mol·L-1CH 3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是A 加入水时,平衡向逆反应方向移动B 加入少量NaOH固体,平衡向正反应方向移动C 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小D 加入小量CH6COONa.固体,平衡向正反应方向移动7、茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:关于茉莉醛的下列叙述错误的是A 在加热和催化剂作用下,能被氢气还原B 能被高锰酸钾酸性溶液氧化C 在一定条件下能与溴发生取代反应D 不能与氢溴酸发生加成反应8、由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为A、0.15mol·L-1B、0.2mol·L-1C、0.3mol·L-1D、0.4mol·L-19、X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
Ⅰ. 考试性质:普通高等学校招生全国统一考试是由合格的高中毕业生和具有同等学力的考生参加的选拔性考试。
高考学校根据考生的成绩,按已确定的招生计划,德、智、体全面衡量,择优录取。
因此高考应有较高的信度、效度、必要的区分度和适当的难度Ⅱ.考试内容:根据普通高等学校对新生文化素质的要求,参照教育部颁布的《全日制普通高级中学教学大纲》,并考虑中学教学实际,制定以下考试内容。
化学科试题旨在测试考生对中学化学基础知识、基本技能的掌握情况和所应具有的观察能力、实验能力、思维能力和自学能力;试题还应力图反映出考生能够初步运用化学视角,去观察、分析生活、生产和社会中的各类有关化学问题。
(一)能力和能力的品质1.观察能力-----能够通过对实验现象、实物、模型、图形、图表以及自然界、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆的能力。
2.实验能力(1)用正确的化学实验基本操作,完成规定的"学生实验"的能力。
(2)观察记录实验现象,分析实验结果和处理实验数据,得出正确结论的能力。
(3)初步处理实验过程中的有关安全问题的能力。
(4)能识别和绘制典型的实验仪器装置图的能力。
(5)根据实验试题的要求,设计或评价简单实验方案的能力。
3.思维能力(1)对中学化学应该掌握的内容能融会贯通。
将知识点统摄整理,使之网络化,有序地存储,作"意义记忆"和抽象"逻辑记忆",有正确复述、再现、辩认的能力。
(2)能将实验问题(或题设情境)分解,找出解答的关键。
能够运用自己存储的知识,将它们分解、迁移转换、重组,使问题得到解决的应用能力。
(3)能将化学信息(含实际事物、实验现象、数据和各种信息、提示、暗示),按题设情境抽象归纳、逻辑地统摄成规律,并能运用此规律,进行推理(收敛和发散)的创造能力。
(4)对原子、分子、化学键等微观结构有一定的三维想像能力。
注:尊敬的各位读者,本文是笔者教育资料系列文章的一篇,由于时间关系,如有相关问题,望各位雅正。
希望本文能对有需要的朋友有所帮助。
如果您需要其它类型的教育资料,可以关注笔者知识店铺。
由于部分内容来源网络,如有部分内容侵权请联系笔者。
2006年普通高等学校招生全国统一考试化学(广东卷试卷类型:A)可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Ca 40 Co 59 Ag 108第一部分选择题(共67分)一、选择题(本题包括9小题,每小题3分,共27分。
每小题只有一个选项符合题意).闪电时空气中有臭氧生成。
下列说法中正确的是A.O3和O2互为同位素B.O2比O3稳定C.等体积O3和O2含有相同质子数D.O3与O2的相互转化是物理变化.同主族两种元素原子的核外电子数的差值可能为A.6 B.12 C.26 D.30.下列表述正确的是①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能A.①②③B.②④C.③④⑤D.③⑤.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。
下列有关该金属氧化物的应用的叙述不正确的是A.将形成酸雨的SO2氧化为SO3B.将家居装修挥发出的甲醛氧化为CO2和H2OC.将医药废水中的苯酚氧化成H2O和CO2D.将电镀废水中的氰根离子CN-氧化成CO2和N2.利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可转化成醛、酸、酯等多种产物。
下列表述正确的是①以合成气为原料的反应都是化合反应②改变合成气中CO与H2的体积比,可以得到不同产物③合成气的转化反应需在适当的温度和压强下通过催化完成④从合成气出发生成液态烃或醇类有机物是实现“煤变油”的有效途径⑤以合成气为原料的反应产物中不可能有烯烃或水A.①②④B.②③④C.②④⑤D.③④⑤.等量镁铝合粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是A.2mol·L-1H2SO4溶液B.18 mol·L-1H2SO4溶液C.6 mol·L-1KOH溶液D.3 mol·L-1HNO3溶液.下列实验能达到预期目的的是①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸②将Cl2的制备和性质实验联合进行以减少实验中的空气污染③用食醋和澄清石灰水验证蛋壳中含有碳酸盐④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子⑤用溴水检验汽油中是否含有不饱和脂肪烃A.①②③B.①③④C.②③⑤D.②④⑤.下列叙述正确是A.酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K时活性更强B.医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关C.银制品久置干燥空气中因电化学腐蚀使表面变暗D.C60是由60个碳原子构成的形似足球的分子,结构对称,稳定性好.研究发现,烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃。
2006年普通高等学校招生全国统一考试(重庆卷)语文语文试题卷共8页。
考式时间150分钟。
第1至11题为选择题,33分;第12至25题为非选择题,117分。
满分150分。
注意事项:1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。
2.答第1至11题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答第12至25题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,将试题和答题卡一并交回。
一、(本大题共4小题,每小题3分,共12分)1.下列词语中加点的字的读音完全相同的一组是A.豁.免附和.蛊惑.人心祸.起萧墙B.遏.止扼.要鄂.伦春族厄.瓜多尔C.菁.华矜.持泾.渭分明惊.世骇俗D.撕裂.趔.趄烈.火金刚骂骂咧.咧2.下列词语中有错别的一组是A.慰藉销毁矫揉造诈瞠目结舌B.焦躁坐标变本加厉缘木求鱼C.颠簸竣工关怀备至顶礼摩拜D.盘绕静谧哄堂大笑迫不及待3.下列句子中加点的成语使用不恰当...的一项是A. 奶奶在城里呆了许多年,很少出门,从不逛街。
有一次乡下的亲戚来了,她竟然毛遂..自荐..,要带他们上街去玩。
B. 午后,我独自在花间小径上穿行,猝不及防....地被一只蝴蝶在面颊上点了一个触吻,一时,心头掠过了几许诗意般的遐想。
C. 李老汉是一知恩图报的人。
别人给他的帮助与恩惠,哪怕仅仅只是一句安慰的话,他也睚毗..。
..必报D. 植物也有“喜怒哀乐”,养植物跟养宠物一样,对它经常给予关爱,让它“心绪”良好,它就会投桃报李....,令你心旷神怡。
4.下面句子中没有..语病的一项是A. 通过仪器来观察世界开阔了人们的视野,由此也改变了我们对物质世界的认识。
B.新牌坊立交桥的建成将大大缓解交通高峰期的堵车问题。
C.由于适当的温度有助于化学反应速度,工期将选在气温较高的5、6月份。
2006年理科综合能力测试(重庆)
第I卷
相对原子质量:H 1 O 16 S 32 Cl 35.5 Br 80 Fe 56 Pb 207
选择题一(本题包括18小题。
每小题只有一个选项符合题意)
6.下列做法正确的是
A.将浓硝酸保存在无色玻璃瓶中B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶D.氢气还原氧化铜实验先加热再通氢气
7.设N A代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3 N A
B.100 mL 2.0 mol / L的盐酸与醋酸溶液中氢离子数均为0.2 N A
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 N A
D.20 g重水(D2O)中含有的电子数为10 N A
8.能正确表示下列反应的化学方程式是
A.黄铁矿煅烧:2 FeS2 + 5 O2 2 FeO + 4 SO2
B.石英与石灰石共熔:SiO2 + CaO CaSiO3
C.氨的催化氧化:4 NH3 + 5 O2 4 NO + 6 H2O
D.氯气与石灰乳反应:2 Cl2 + 2 Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2 H2O
9.温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤-ONa、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A.③①④②⑥⑤B.①③⑥④②⑤C.③②①⑥④⑤D.⑤⑥②④①③10.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ / mol、285.8 kJ / mol、890.3 kJ / mol、2800 kJ / mol,则下列热化学方程式正确的是
A.C(s) + 1/2 O2(g) == CO(g);△H == -393.5 kJ / mol
B.2 H2(g) + O2(g) == 2 H2O(g);△H == +571.6 kJ / mol
C.CH4(g) + 2 O2(g) == CO2(g) + 2 H2O(g);△H == -890.3 kJ / mol
D.1/2 C6H12O6(g) + 3 O2(g) == 3 CO2(g) + 3 H2O(l);△H == -1400 kJ / mol
11.已知反应mX(g) + nY(g)qZ(g)的△H<0,m + n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
12.利尿酸在奥运会上被禁用,其结构简式如右图所示。
下列叙述正确的是
A.利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸能与FeCl3,溶液发生显色反应
13.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是
A.Ba(OH)2KSCN NaCl Mg(NO3)2(FeCl3溶液)
B.NaNO3NaHCO3(NH4)2SO3Na2SiO3(H2SO4溶液)
C.NH4Br K2CO3NaI CaCl2(AgNO3溶液)
D.(NH4)3PO4NaBr CuSO4AlCl3(KOH溶液)
第Ⅱ卷
26.为除去粗盐中的Ca+2、Mg+2、Fe+3、SO-24以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是。
(2)第④步中,相关的离子方程式是。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因
是。
(4)为检验精盐纯度,制配制150 mL,0.2 mol / L NaCl(精盐)溶液,右图
是该同学转移溶液的示意图,图中的错误是。
27.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb + PbO2 + 4 H++ 2 SO-24 2 PbSO4 + 2 H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是;电解液中
H2SO4的浓度将变;当外电路通过1 mol电子时,理论上负极板
的质量增加g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,
则在A电极上生成、B电极上生成,此时铅蓄电池的正负
极的极性将。
28.α—松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物:
请回答下列问题:
(1)试剂1是,试剂2是。
(2)A至H中,能发生银镜反应的是。
(3)G和H的结构简式分别是:G ;H 。
(4)E转化为F的反应方程式是。
29.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X 原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。
单质Y和W都可与浓的NaOH溶液反应。
请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是。
(2)ZW2的电子式是,它在常温下呈液态,形成晶体时,属于晶体。
(3)工业生产单质Y的原理是(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是。
(5)0.1 mol的单质W与50 mL 1.5 mol / L的FeBr2溶液反应,则被氧化的Fe+2和Br -
的
物质的量之比是 。
参考答案
26.(1)取第②步后的上层溶液1—2滴于点滴板上,再滴入1—2滴BaCl 2溶液,若溶液未变浑浊,则表明BaCl 2已过量
(2)Ca +2+ CO -23== CaCO 3↓ Ba +2+ CO -23== BaCO 3↓
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用150 mL 容量瓶
27.(1)PbO 2 + 2 e -+ 4 H ++ SO -2
4== PbSO 4 + 2 H 2O 小 48
(2)Pb PbO 2 对换
28.(1)O 2 Br 2
(2)CH 3CHO
(3)
(4)(CH 3)2CBrCHBrCH 3 + 2 NaOH −−−→−醇,加热
CH 2==C(CH 3)CH==CH 2 + 2 NaBr + 2 H 2O 29.(1)Cl<S<Al
(2) 分子
(3)2 Al 2O 3−−−→−电解熔融
4 Al + 3 O 2↑
(4)Be + 2 NaOH == Na 2BeO 2 + H 2↑
(5)3 : 5。