日本新药信息检索
- 格式:pdf
- 大小:2.05 MB
- 文档页数:18

日本新药信息检索目录一、日本的药品审批二、日本药品的分类三、日本药品说明书四、日本药品信息检索五、处于研发阶段的日本药品信息检索丁香园战友老鞋制作一、日本的药品审批日本製薬工業協会于平成18年(2006年)3月公布了《日本の薬事行政》(下载:http://www.jpma.or.jp/jpmalib/pdf/06yakuji.pdf;英文版可以从以下网址下载:http://www.jpma.or.jp/english/parj/pdf/2006.pdf)。
其中列出了日本新药从研发到批准、上市的整个过程,详见下图。
总的来看,日本药品的审批过程大抵与其它国家类似,包括非临床研究、若干期临床研究直至审批后上市,以及上市后的监控等。
不得不承认的是,日本对药品批准后的各种相关信息的公开程度堪称是最高的,据说是因为日本政府要求这些资料应该向每一位日本公民公开(涉及商业秘密的除外),当然基本上也就等于是对我们公开了。
这一点应该说做的比美国和欧盟要好,我指的是新药资料的“完整性”,并非是新药资料具体的“质量”或“研究水平”。
看看日本对药品申报资料的具体要求吧(见下表),呵呵,是不是感觉似曾相识,与我国药品注册管理办法的附件有几分相似呢(我指的是排列成表,以○、×、▼等标记)?日本的药品申报共分以下9类:1、新有效成份;2、新复方;3、新给药途径;4、新适应症;5、新剂型;6、新用量;7.1、额外增加剂型;7.2、相似成份;8、其它。
二、日本药品的分类日本对药品的分类是比较详细的,如下图所示的是按药效进行的分类。
有些地方比我们国家的医疗保险药品目录的分类要更明确一些,如细分到“人工腎臓用剤”、“腹膜透析用剤”等。
如果按处方药、毒药等区分的话,可分为毒薬・劇薬、処方せん医薬品、指定医薬品等等,详见下表。
三、日本药品说明书在日本上市的每个药物一般都会有如下名称:治験番号:即早期研发阶段厂方取的代号,如抗真菌药利拉萘酯(liranaftate)的治験番号为M-732,处于研发早期或临床初期的药物一般仅有代号。

日本专利的检索方法介绍目前通过因特网检索日本专利的途径主要有:日本专利局(特许厅)的工业知识产权电子图书馆IPDL、日本专利情报机构的PATOLIS网上专利检索系统、日本野村综合研究所NRI-CyberPatent专利检索系统以及欧洲专利局EPO的专利检索系统ESP@CENET。
本文主要介绍日本专利局的IPDL检索系统,并对网上其它日本专利检索系统进行比较分析。
1 .日本专利信息的特点以及各种专利号的表达方式日本专利局创建于1885年,至今已有近120年的历史。
日本专利局给予保护的工业知识产权主要有四种,分别是:“特许”、“实用新案”、“意匠”和“商标”,其中前三项专利等同于我国的“发明专利”、“实用新型专利”和“外观设计专利”。
日本专利从申请、公开、审查到正式授予专利权要经历漫长的审批程序,其专利文献号码也随各种程序和年份的改变而改变,加上日本是一个使用日本天皇年号的国家,不同的天皇有不同的年号,使日本专利号的表达方式显得尤为复杂。
在目前国际化的潮流中,这种复杂的专利号表达方式给不懂日语的专利检索者造成了极大的障碍,为了解决这一问题,日本专利局在IPDL检索系统中将2000年以后的专利文献改变为国际通用的公元年号,但2000年以前的专利仍然以日本年号的表达方式进行检索。
在检索日本专利数据库时,尤其是从CA等其它大型数据库中检索到日本专利文摘信息,希望通过网上数据库获取专利全文时,对日本专利号各种表达方式的准确把握就显得更为重要。
2 .日本工业知识产权电子图书馆IPDL IPDL 专利检索系统是日本专利局官方开设的日本工业知识产权电子图书馆(The Industrial Property Digital Library),其目的是向全球因特网用户提供日本专利局已有的约4000余万份日本专利文献的免费检索途径。
不仅可以检索发明专利、实用新型专利、外观设计专利和商标,还可检索到各专利的法律状态。
该数据库目前可通过日文和英文两种工作语言进行检索。

日本新药信息检索目录一、日本的药品审批二、日本药品的分类三、日本药品说明书四、日本药品信息检索五、处于研发阶段的日本药品信息检索丁香园战友老鞋制作一、日本的药品审批日本製薬工業協会于平成18年(2006年)3月公布了《日本の薬事行政》(下载:http://www.jpma.or.jp/jpmalib/pdf/06yakuji.pdf;英文版可以从以下网址下载:http://www.jpma.or.jp/english/parj/pdf/2006.pdf)。
其中列出了日本新药从研发到批准、上市的整个过程,详见下图。
总的来看,日本药品的审批过程大抵与其它国家类似,包括非临床研究、若干期临床研究直至审批后上市,以及上市后的监控等。
不得不承认的是,日本对药品批准后的各种相关信息的公开程度堪称是最高的,据说是因为日本政府要求这些资料应该向每一位日本公民公开(涉及商业秘密的除外),当然基本上也就等于是对我们公开了。
这一点应该说做的比美国和欧盟要好,我指的是新药资料的“完整性”,并非是新药资料具体的“质量”或“研究水平”。
看看日本对药品申报资料的具体要求吧(见下表),呵呵,是不是感觉似曾相识,与我国药品注册管理办法的附件有几分相似呢(我指的是排列成表,以○、×、▼等标记)?日本的药品申报共分以下9类:1、新有效成份;2、新复方;3、新给药途径;4、新适应症;5、新剂型;6、新用量;7.1、额外增加剂型;7.2、相似成份;8、其它。
二、日本药品的分类日本对药品的分类是比较详细的,如下图所示的是按药效进行的分类。
有些地方比我们国家的医疗保险药品目录的分类要更明确一些,如细分到“人工腎臓用剤”、“腹膜透析用剤”等。
如果按处方药、毒药等区分的话,可分为毒薬・劇薬、処方せん医薬品、指定医薬品等等,详见下表。
三、日本药品说明书在日本上市的每个药物一般都会有如下名称:治験番号:即早期研发阶段厂方取的代号,如抗真菌药利拉萘酯(liranaftate)的治験番号为M-732,处于研发早期或临床初期的药物一般仅有代号。

http://www.pmda.go.jp/随便输入药品名,比如:シメチジン点击圆圈就是PDF文件日本原研参比制剂查询方法1、日本药品名称检索:http://www.kegg.jp/kegg/drug/drug_ja.html(可以通过英文药品名称、商品名查到药品名、商品名、生产单位、药品基本信息、原研品商品名及公司)http://moldb.nihs.go.jp/jan/(支持英文名、日文名、日文化学名、CAS号检索)检索结果:2、PMDA:http://www.pmda.go.jp/(检索上市品信息、再评价信息)3、Org.book:http://www.jp-orangebook.gr.jp/(药品再评价信息:检索药品溶出方法以及所用对照品信息、日本参比制剂信息等)收载品种信息:收载了已设定了溶出试验的品种(已确认溶出效果和原研药一致,获得批准的仿制药)。
1997年4月以前,批准的原研药及仿制药中,已发布了再评价结果的有638种成分(4588品目)(2012年1月现在)1995年4月以后申请的内服固体制剂,申请批准时已经要求进行溶出试验的评价,不再进行单独的质量再评价和橙皮书的收录。
橙皮书记载内容:1、药效组栏记载再评价对象的药品所属药效群分类的编号。
2、有效成分栏记载有效成分名称。
属复方制剂时记载复方的各有效成分名称。
3、剂型栏按片剂、胶囊剂、颗粒剂等剂型进行记载。
4、特性栏记载普通(普通制剂)、肠溶(肠溶制剂)、缓释(缓释制剂)、口腔(口腔内崩解制剂)5、含量栏每粒含量或每1g含量6、评价阶段栏按照所属各评价阶段进行记载评价阶段主要分为以下5个阶段(1)确定该药品开展再评价阶段(2)开始预试验阶段(3)指令开展再评价阶段(4)公共溶出试验方案的公示阶段(5)确定公共溶出试验方案阶段7、标准栏A、溶出试验的参比制剂在标准栏以「*」或者「+」来表示,在品质再评价结束后,也有参比制剂的批准文号被取消,标准栏没有「*」或者「+」标注的情况。
![[附教程]欧盟28国及美日上市药品检索方法](https://img.taocdn.com/s1/m/dd81f1124a7302768e993990.png)
[附教程]欧盟28国及美日上市药品检索方法自国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》以来,全国仿制药将分期分批开展质量和疗效一致性评价工作。
那么对原研上市药品开展调研,获取详细信息并准确寻找参比制剂,就显得比较重要了。
鉴于目前我国参比制剂的确定主要范围在美、日、欧(其它常用的如阿根廷、加拿大、印度等国的查询方法暂不在本文之列),本人结合自身检索经验和与同行的交流学习,整理了欧盟及美、日的药品检索方法,供同行交流探讨。
本文不仅仅提供信息检索途径,也是提供一种检索思维,希望对大家有所帮助。
一、翻译各国药品查询,语言是一大障碍,先推荐几个本人常用的翻译工具,根据需要自行选择:1、谷歌在线翻译(没被禁止,翻译速度挺快);2、MyMemory(/zh/);3、(http://www.excite.co.jp/world/chinese/)。
二、欧盟28国英文、简称及加入时间奥地利(AUT、Austria)比利时(BEL、Belgium )保加利亚(BUL、Bulgaria)克罗地亚(CRO、Croatia)塞浦路斯(CYP、Cyprus)捷克(CZE、Czech Republic)丹麦(DEN、Denmark)爱沙尼亚(EST、Estonia)芬兰(FIN、Finland)法国(FRA、France)德国(GER、Germany)英国(GBR、GreatBritain)希腊(GRE、Greece)匈牙利(HUN、Hungary)爱尔兰(IRL、Ireland )意大利(ITA、Italy )拉脱维亚(LAT、Latvia)立陶宛(LTU、Lithuania)卢森堡(LUX、Luxembourg)马耳他(MLT、Malta)荷兰(NED、Netherlands)波兰(POL、Poland)葡萄牙(POR、Portugal)罗马尼亚(ROM、Romania)斯洛伐克(SVK、Slovakia)斯洛文尼亚(SLO、Slovenia)西班牙(ESP、Spain)瑞典(SWE、Sweden )冰岛(ISL、Iceland EEA)挪威(NOR、Norway EEA)1965年4月8日,法国、联邦德国、意大利、荷兰、比利时和卢森堡6国在比利时首都布鲁塞尔又签署《布鲁塞尔条约》,1967年7月1日,《布鲁塞尔条约》生效,欧共体正式诞生;1973年英国、丹麦和爱尔兰加入欧共体;1981年希腊加入欧共体;1986年葡萄牙和西班牙加入欧共体;1993年11月1日,根据内外发展的需要,欧共体正式易名为欧洲联盟;1995年奥地利、瑞典和芬兰加入欧盟;2004年5月1日,马耳他、塞浦路斯、波兰、匈牙利、捷克、斯洛伐克、斯洛文尼亚、爱沙尼亚、拉脱维亚、立陶宛10国加入欧盟;2007年1月1日,罗马尼亚、保加利亚加入欧盟;2013年7月1日,克罗地亚正式加入欧洲联盟成为第28个成员国。
查询日本上市药物汇总信息及药物法规的方法作者:heavybird引言本文通过日本国家药物医疗器械研究所(/)官网,查询每年度日本上市的药物信息以及日本药物法规的一些具体内容,与大家进行交流和分享。
日本上市药物汇总信息的查询方法1、进入日本国家药物医疗器械研究所官网页面,网址:/2、点击右上角“English”,进入英文页面,网址:/english/index.html3、点击Reviews,进入页面,网址:/english/review-services /index.html4、点击Reviews,进入页面,网址:/english/review-services /reviews/0001.html5、点击Information for Approved Products,进入页面,网址:/english/review-services /reviews/approved-information /0001.html6、点击Drugs进入页面,网址:/english/review-services /reviews/approved-information /drugs/0003.html(1)点击List of Approved Products,进入查询页面,按年份查阅批准的药物信息,根据需要的具体年份进行批准药物信息汇总的PDF 下载,网址:/english/review-services /reviews/approved-information/drugs/0002.html(2)点击Review Reports查阅审评报告,具有英文和日文两个版本,可根据字母排序找到需要的药物进行PDF下载,网址:/english/review-services /reviews/approved-information/drugs/0001.html日本药物法规的查询方法1、返回上一层次的Reviews页面,网址:/english/review-services /index.html2、点击Regulatory Information,进入页面,网址:/english/review-services/regulatory-info/0002.html3、这里分成四个部分,每个部分都有法律法规的具体要求,仅以Notifications and Administrative Notices部分为例,点击进入页面,根据需要进行法规的下载,网址:/english/review-services /regulatory-info/0003.html个人体会1、查询日本上市药物汇总信息及药物法规的方法中,需要通过日本国家药物医疗器械研究所(/)官网的英文界面进入查询。
日本药学相关资料的查询前言日本医药化工在全球占有很重要的地位,并且资料公开程度高,因此在我们医药开发中经常会引用或 借鉴他们的文献资料。
但是受限于日本网站基本上只接受日文查询,对于没有任何日语基础的朋友来说, 查找资料会存在一定困难。
虽然资料的查找路径比较固定,但日文网站经常会改版,例如 PMDA 和 JPO 在今 年三月份均已改版,方法大致没变,但窗口大多和以前版本不一样。
因此,在以前写过一个相关资料检索 的基础上,并从无日语基础查找资料的方法和要点出发,在此做了一些总结。
主要涉及的资料,包括说明 书、IF 文件、审查报告书、申报资料概要、橙皮书以及专利,但对于某些需要一定日语基础的方法,在此 不做总结。
局限于笔者水平未能详尽, 请见谅并欢迎纠正及补充,任何相关问题可通过页脚中的方式联系。
在我们检索中,最核心的问题是要确保日文关键词的准确性。
常用的谷歌、百度之类网站翻译,实践 证明大多并不可信。
通常来说,简单化合物,如甲醇、乙腈、丙酮等都能通过网站翻译直接中日或者日中 翻译出来,但中药、植物名、复杂的化合物以及较新的化合物用网站翻译工具基本不对,若运用网站翻译 成段的句子就更不可取了。
中日互译的网站或工具书远不及英日互译的发达,因此我的建议是以英语为标 准,即先找出正确的英文通用名,再由英文通用名检索出日文名。
也推荐通过这个网址来查,http://moldb.nihs.go.jp/jan/,只要有 CAS 号就可以查到日文名和英文 名,也可以通过英文或日文名来互查。
另外日文假名间不能有空格,否则会视为两个单词。
由于同一个资料可以通过多个路径来检索,因此在此例举个别品种,选择较为简捷的路径以图文结合 解说。
丛林 2015 年 4 月 QQ 3706734051 / 27目录第一部分 药学资料 ........................................................................................................................................... 3 一 关键词语 ................................................................................................................................................... 3 二 说明书与 IF 文件 ...................................................................................................................................... 3 三 审查报告书及申报资料概要 ................................................................................................................... 6 第二部分 专利 ................................................................................................................................................. 9 第三部分 橙皮书 ............................................................................................................................................. 10 附件一 日本药品注册分类 ......................................................................................................................... 12 附件二 日本药效分类编号(2013 年更新版) ........................................................................................ 142 / 27第一部分 药学资料一 关键词语医療用医薬品:处方药 一般用医薬品:OTC ジェネリック:仿制药 添付文書:说明书 インタビューフォーム:IF 文件或综述资料 審査報告書:审查报告书 申請資料概要:申报资料概要 PMDA 网站:http://www.pmda.go.jp/二 说明书与 IF 文件IF 文件和说明书都会根据上市后收集安全性以及有效性逐步完善,并可能在较短的时间内就更新。
附教程欧盟国及美日上市药品检索方法文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688][附教程]欧盟28国及美日上市药品检索方法自国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》以来,全国仿制药将分期分批开展质量和疗效一致性评价工作。
那么对原研上市药品开展调研,获取详细信息并准确寻找参比制剂,就显得比较重要了。
鉴于目前我国参比制剂的确定主要范围在美、日、欧(其它常用的如阿根廷、加拿大、印度等国的查询方法暂不在本文之列),本人结合自身检索经验和与同行的交流学习,整理了欧盟及美、日的药品检索方法,供同行交流探讨。
本文不仅仅提供信息检索途径,也是提供一种检索思维,希望对大家有所帮助。
一、翻译各国药品查询,语言是一大障碍,先推荐几个本人常用的翻译工具,根据需要自行选择:1、谷歌在线翻译(没被禁止,翻译速度挺快);1965年4月8日,法国、联邦德国、意大利、荷兰、比利时和卢森堡6国在比利时首都布鲁塞尔又签署《布鲁塞尔条约》,1967年7月1日,《布鲁塞尔条约》生效,欧共体正式诞生;1973年英国、丹麦和爱尔兰加入欧共体;1981年希腊加入欧共体;1986年葡萄牙和西班牙加入欧共体;1993年11月1日,根据内外发展的需要,欧共体正式易名为欧洲联盟;1995年奥地利、瑞典和芬兰加入欧盟;2004年5月1日,马耳他、塞浦路斯、波兰、匈牙利、捷克、斯洛伐克、斯洛文尼亚、爱沙尼亚、拉脱维亚、立陶宛10国加入欧盟;2007年1月1日,罗马尼亚、保加利亚加入欧盟;2013年7月1日,克罗地亚正式加入欧洲联盟成为第28个成员国。
三、检索药品检索首先要获得药品的商品名和活性成分名,其中商品名一般是英文即可,而活性成分名一般为各国相应语言的名称,差别一般较大,有的即使是英文,不同国家可能也会存在微小差异,所以检索时应灵活运用,综合运用检索信息。
另外,在品种相应国家的企业官网也有许多信息可供参考。
日本新药信息检索
目录
一、日本的药品审批
二、日本药品的分类
三、日本药品说明书
四、日本药品信息检索
五、处于研发阶段的日本药品信息检索
丁香园战友老鞋制作
一、日本的药品审批
日本製薬工業協会于平成18年(2006年)3月公布了《日本の薬事行政》(下载:http://www.jpma.or.jp/jpmalib/pdf/06yakuji.pdf;英文版可以从以下网址下载:http://www.jpma.or.jp/english/parj/pdf/2006.pdf)。
其中列出了日本新药从研发到批准、上市的整个过程,详见下图。
总的来看,日本药品的审批过程大抵与其它国家类似,包括非临床研究、若干期临床研究直至审批后上市,以及上市后的监控等。
不得不承认的是,日本对药品批准后的各种相关信息的公开程度堪称是最高的,据说是因为日本政府要求这些资料应该向每一位日本公民公开(涉及商业秘密的除外),当然基本上也就等于是对我们公开了。
这一点应该说做的比美国和欧盟要好,我指的是新药资料的“完整性”,并非是新药资料具体的“质量”或“研究水平”。
看看日本对药品申报资料的具体要求吧(见下表),呵呵,是不是感觉似曾相识,与我国药品注册管理办法的附件有几分相似呢(我指的是排列成表,
×、▼等标记)?
日本的药品申报共分以下9类:1、新有效成份;2、新复方;3、新给药途径;4、新适应症;5、新剂型;6、新用量;7.1、额外增加剂型;7.2、相似成份;
8、其它。
二、日本药品的分类
日本对药品的分类是比较详细的,如下图所示的是按药效进行的分类。
有些地方比我们国家的医疗保险药品目录的分类要更明确一些,如细分到“人工腎臓用剤”、“腹膜透析用剤”等。
如果按处方药、毒药等区分的话,可分为毒薬・劇薬、処方せん医薬品、指定医薬品等等,详见下表。
三、日本药品说明书
在日本上市的每个药物一般都会有如下名称:
治験番号:即早期研发阶段厂方取的代号,如抗真菌药利拉萘酯(liranaftate)的治験番号为M-732,处于研发早期或临床初期的药物一般仅有代号。
一般名:即我们所谓的“通用名”、generic name,亦称为Japanese Accepted Names for Pharmaceuticals(JAN),以区别于USN、BAN或INN。
利拉萘酯的一般名为リ
ラナフタート。
販売名:即商品名,分为英文(洋名)和日文(和名)两种,如利拉萘酯霜剂的販売名分别为ZEFNART®CREAM 2%、ゼフナート®クリーム2%。
日本称药品说明书为“添付文書情報”。
与药品的一般名、販売名同时出现在说明书里面的通常还有以下一些内容:
作成又は改訂年月:说明书修订日期
日本標準商品分類番号:日本标准商品分类号
薬効分類名:药效分类
承認・許可番号:药品批准号
薬価基準収載年月:收录到药价基准目录的日期
販売開始年月:上市日期
規制区分:分为指定医薬品、処方せん医薬品等。
貯法・使用期限等:贮藏、有效期等
添加物:辅料
効能又は効果:适应症
用法及び用量:用法用量
使用上の注意:注意事项
高齢者への使用:老年患者用药
妊婦、産婦、授乳婦等への使用:孕妇、产妇及哺乳期妇女用药
小児等への使用:儿童用药
薬物動態:药代动力学
臨床成績:临床疗效
薬効薬理:药效、药理作用
作用機序:作用机理
有効成分に関する理化学的知見:有效成份及其理化性质
如何检索日本药品的说明书会在后面谈到。
此外,日本的药品说明书里面通常不包含毒理研究资料,所以这方面的资料需要通过其它途径去查找。
四、日本药品信息检索
查找已上市药物的基本思路:
n从“治験番号”查找“一般名、販売名”
一般有两种途径(查阅CA除外)。
1、TOXNET Î(英文通用名)Î Google或一般名检索网站Î(一般名)
仍以m-732为例。
登陆/,输入m-732,如下图。
搜索后点击CHEMID plus右边的链接。
即可得到m-732的英文通用名liranaftate及相关信息。
登陆
医薬品一
即可得到liranaftate的一般名、结构式、分子式、分子量等相关信息。
2、通过治験番号、一般名、販売名三者的相互索引来检索
日本株式会社シーマ・サイエンスジャーナル(www.cimasj.co.jp)出版新药研究开发的情报,对其出版的新药名称作了索引,通过三者其一可方便地检索到另外两个名称以及英文通用名、英文商品名。
索引可免费下载(http://www.cimasj.co.jp/pdf/ncindex.pdf )。
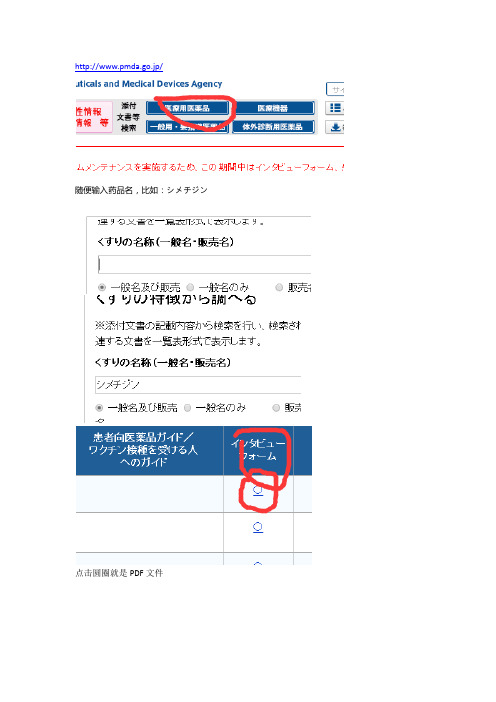
o从“一般名、販売名”查找“添付文書情報”
登陆添付文書情報检索网站
.pmda.go.jp/psearch/html/menu_tenpu_base.html
将一般名、販売名输入即可检索。
除了html 版本外,还有pdf 版本可供下载!
p 从“一般名、販売名” 从1999年(平成11年)至今的批准新药的申报相关资料均可以从网站上查找到。
主要有以下几个网址: 1、新薬の承認に関する情報
点击左侧按钮,即可进入历年批准新药的资料进行检索。
Liranaftate的申报资料就在这里
里面包括详细的药理、毒理、药代、临床等研究资料,有pdf版可供下载。
2、新薬の承認に関する情報
.pmda.go.jp/shinyaku/shinyaku_index.html
q从“一般名、販売名”查找厂商提供资料
进入 liranaftate的销售商鳥居薬品株式会社的网站,进入“医療関係者の皆様へ”栏目。
点击“制品基本情报”,查找liranaftate的商品名ゼフナートクリーム,有如下发现:
这里的インタビューフォーム(暂且译成“药品信息”)非常有用,看看是什么内容:
囊括了该药的药学、药效、毒理、临床等研究资料,比较全面。
五、处于研发阶段的日本药品信息检索
1、http://www.cimanet.jp/ver3/u/index.php(from )
这是一个提供日本上市药品信息以及在研药品信息专业的网站。
其中提供全日本在研药物信息的链接为:http://www.cimanet.jp/ver3/u/drug_grouplist.php 按照字母A~Z、0~9、片假名排序。
2、/chikeninfo/html/newmedicine/newmedicine.htm
注:个人认为日本厚生労働省网站(http://www.mhlw.go.jp/)上那些东西对我们搞新药检索的来说意义不大,所以我没有具体专注于作某个特定网站的介绍,而是着重于对日本新药的整体信息检索方法的探讨。