气体干燥和干燥剂选择
- 格式:docx
- 大小:103.78 KB
- 文档页数:5


溶剂干燥方法一些溶剂因为种种原因总是含有杂质,这些杂质如果对溶剂的使用目的没有什么影响的话,可直接使用。
可是在进行化学实验和进行一些特殊的化学反应时,必须将杂质除去。
虽然除去全部杂质是有困难的,但至少应该将杂质减少到对使用目的没有防碍的限度。
除去杂质的操作称为溶剂的精制,故溶剂的精制几乎都要进行脱水,其次再除去其他的杂质。
1溶剂的脱水干燥:溶剂中水的混入往往是由于在溶剂制造,处理或者由于副反应时作为副产物带入的,其次在保存的过程中吸潮也会混入水分。
水的存在不仅对许多化学反应,就是对重结晶,萃取,洗涤等一系列的化学实验操作都会带来不良的影响。
因此溶剂的脱水和干燥在化学实验中是很重要的,又是经常进行的操作步骤。
尽管在除去溶剂中的其他杂质时有时往往加入水分,但在最好还是要进行脱水,干燥。
精制后充分干燥的溶剂在保存过程中往往还必须加入适当的干燥剂,以防止溶剂吸潮。
溶剂脱水的方法有下列几种:(1)干燥剂脱水这是液体溶剂在常温下脱水干燥最常用使用的方法。
干燥剂有固体,液体和气体,分为酸性物质,碱性物质,中性物质以及金属和金属氢化物。
干燥剂的性质各有不同,在使用时要充分考虑干燥剂的特性和干燥剂的性质,才能有效达到干燥的目的。
在选择干燥剂时首先要确保进行干燥的物质与干燥剂不发生任何反应;干燥剂兼做催化剂时,应不使溶剂发生分解,聚合,并且干燥剂与溶剂之间不形成加合物。
此外,还要考虑倒干燥速度,干燥效果和干燥剂的吸水量。
在具体使用时,酸性物质的干燥最好选用酸性物质干燥剂,碱性物质的干燥用碱性干燥剂,中性物质的干燥用中性干燥剂。
溶剂中有大量水存在的,应避免选用与水接触着火(如金属钠等)或者发热猛烈的干燥剂,可以先选用氯化钙一类缓和的干燥剂进行干燥脱水,使水分减少后再使用金属钠干燥。
加入干燥剂后应搅拌,放置一夜。
温度可以根据干燥剂的性质,对干燥速度的影响加以考虑。
干燥剂的用量应稍有过剩。
在水分多的情况下,干燥剂因吸水吸收水分发生部分或全部溶解生成液状或泥状分为两层,此时应进行分离并加入新的干燥剂。

实验室常用的干燥剂及干燥的气体(1)按干燥剂的酸碱性可分为酸性干燥剂、中性干燥剂和碱性干燥剂三类:①酸性干燥剂包括浓硫酸、五氧化二磷、硅胶等。
②中性干燥剂有无水氯化钙等。
③碱性干燥剂包括碱石灰、氧化钙、固体氢氧化钠等。
(2)气体干燥剂的选择:①被干燥气体和干燥剂的酸碱性应一致。
②被干燥气体和干燥剂之间不发生反应。
如NH3易与CaCl2作用生成CaCl2·8NH3,故NH3不能用CaCl2干燥。
(3)常见气体的干燥与被干燥的气体:液态干燥剂装置固态干燥剂装置常见干燥剂:浓硫酸、无水氯化钙、碱石灰可干燥的气体浓硫酸:H2、O2、Cl2、SO2、CO2、CO、CH4、N2等无水氯化钙:H2、O2、Cl2、SO2、CO、CO2、CH4、HCl等碱石灰:H2、O2、CH4、NH3等不可干燥的气体浓硫酸:NH3、H2S、C2H4、HBr、HI等无水氯化钙:NH3等碱石灰:Cl2、HCl、H2S、SO2、CO2、NO2等无水硫酸铜(胆矾经过加热脱水处理后的白色粉末,化学式CuSO4,一遇水变蓝)通常实验用作证明有无水分存在。
无水硫酸铜在化学工业中用来制取其它铜盐的重要原料。
主要用于船底防污漆原料,干燥剂,催化剂等方面。
初中化学常见干燥剂有浓H2SO4、NaOH固体、CaO固体、碱石灰(CaO和NaOH固体),无水氯化钙,五氧化二磷。
另:①,干燥剂的选择,既要看干燥剂的性质还要看所干燥物质的性质,如浓硫酸,是酸所以不能干燥碱性气体;另外浓硫酸还具有强氧化性,因此不能用来干燥还原性的物质,如H2S,HI ,HBr等②对液体干燥剂来说,一般装在洗气瓶中(气体从长管进,短管出)。
而固体干燥剂装在干燥管或U形管中。

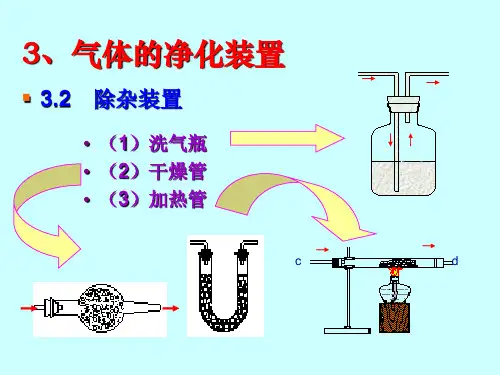
中学化学实验常见气体干燥剂的选择和使用气体的干燥是气体净化中重要的步骤,掌握中学常见的气体干燥剂、干燥装置、干燥剂选择原则,十分重要,为了便于同学复习和应用,现总结如下.一、干燥装置的基本类型和气体流动方向:盛装干燥剂状态液体干燥剂固体干燥剂装置示意图洗气瓶球形干燥管U形干燥管气体流动方向长管进气,短管出气U形干燥管,进气和出气没有区别;球形干燥管应该大口进气,小口出气(在干燥管的进出气口都要塞一团棉花,防止干燥剂流动)注意:1、固体干燥剂颗粒大小要适当,颗粒太大气体和干燥剂接触面小,不利于干燥效果不好;颗粒太小,气体不易通过,容易堵塞,一般以黄豆粒大小为宜。
2、液体干燥剂用量要适当,并控制好通入气体的速度,为了防止发生倒吸,在洗气瓶与反应容器之间应连接安全瓶。
二、气体的分类1、根据酸碱性,酸性气体:CO2、SO2、NO2、HCl、Cl2、H2S、HBr、HI等碱性气体:只有NH3中性气体:H2、O2、CH4、CO、CH2=CH2、C2H2、N2等2、根据常温氧化还原性强弱,强还原性气体:H2S、HBr、HI、SO2等一般性气体:H2、O2、CH4等三、气体干燥剂的类型及选择1、常用气体干燥剂按酸碱性可分为三类:①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶.酸性干燥剂能够干燥酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。
碱性干燥剂可以用来干燥碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙、无水硫酸铜等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
2、根据干燥剂的氧化性分两类①强氧化性干燥剂:浓硫酸②一般干燥剂:五氧化二磷、硅胶、生石灰、碱石灰、固体NaOH、CaCl2、CuSO4等3、干燥剂选择的基本原则:根据干燥剂和气体的性质选择,其基本原则是干燥剂只吸收气体中的水分,不吸收被干燥的气体,具体表现在:(1)在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,如不能用碱石灰、CaO和NaOH 干燥CO2、SO2、HCl、H2S、Cl2、NO2等;(2)显酸性的气体不能选用碱性干燥剂,如不能用P2O5、浓 H2SO4干燥 NH3;(3)还原性的气体不能选用有强氧化性的干燥剂,如不能用浓 H2SO4干燥 H2S、HBr、HI等;虽然H2、SO2、CO、CH4也有还原性,但是浓硫酸在常温下不能氧化它们,可以用浓硫酸干燥.(4)能与气体反应的物质不能选作干燥剂,如不能用无水氯化钙干燥NH3(因生成CaCl2·8NH3)。

关于初中化学常见气体干燥剂的总结陕西咸阳永寿县常宁中学李新茂邮编:713403气体的干燥是气体净化中重要的步骤,掌握中学常见的气体干燥剂、干燥装置、干燥剂选择原则,在中考中很重要,为了便于同学们复习,现总结如下。
一、气体的分类1、酸性气体:CO2、SO2、NO2、HCl、Cl2、H2S、等2、碱性气体:NH33、中性气体:H2、O2、CH4、CO、CH2=CH2、C2H2、N2等二、气体干燥剂的分类初中阶段主要是以酸碱性来分类的,分为三类,如下:1、酸性干燥剂:如浓硫酸、五氧化二磷等。
酸性干燥剂能够干燥酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等气体。
2、碱性干燥剂:如生石灰、碱石灰、固体NaOH等。
碱性干燥剂可以用来干燥碱性或中性的气体,如NH3、H2、O2、CH4等气体。
3、中性干燥剂:如无水氯化钙、无水硫酸铜等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
三、干燥剂的选择方法根据干燥剂和气体的性质选择,其基本方法是干燥剂只吸收气体中的水分,不吸收被干燥的气体,具体为:(1)在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,如不能用浓 H2SO4干燥 NH3;(2)显酸性的气体不能选用碱性干燥剂,如不能用碱石灰、CaO和NaOH干燥CO2、SO2、HCl、H2S、Cl2、NO2等;(3)能与气体反应的物质不能选作干燥剂,如不能用固体NaOH干燥CO2、SO2等。
四、干燥装置的基本类型和气体流动方向如图:液体干燥剂固体干燥剂洗气瓶球形干燥管U形干燥管长进,短出U形干燥管,进气和出气没有区别;球形干燥管应该大进气,小出气(在干燥管的进出气口都要塞一团棉花,防止干燥剂流动)注意:1、固体干燥剂颗粒大小要适当,利于气体和干燥接触和流动,一般以黄豆粒大小为宜。
2、液体干燥剂用量要适当,并控制好通入气体的速度,为了防止发生倒吸,在洗气瓶与反应容器之间应连接安全瓶。

1.排水法(1)难溶或微溶于水,且与水不发生化学反应的气体,都可以用排水法收集。
(2)一般能用排水法收集的气体,应尽量用此法,因为排水法收集的气体纯度大,但含一定的水蒸气。
2.排气法(1)不与空气发生反应,且密度与空气密度相差较大的气体,都可用排空气法收集,相对分子质量大于29的气体用向上排空气法收集,相对分子质量小于29的气体用向下排空气法收集。
(2)排空气集气法的特点是操作简单,但所收集到的气体纯度不高。
注意:A .用排水法收集气体时,导气管伸入集气瓶口即可,这样便于操作;用排空气法收集气体时,导气管伸入到集气瓶的底部,这样可充分排净集气瓶中的空气。
B.集满气体的集气瓶,盖上毛玻璃片后,是正放在桌面上还是倒放在桌面上,取决于气体的密度,为了减少集气瓶内的气体向空气中扩散,密度比空气小的气体,集满集气瓶后,盖上毛玻璃片,要倒置在桌面上;密度比空气大的气体,在正放在桌面上。
二、收集气体时验满的方法(1)排水法:集气瓶里的水要装满,瓶口处不能留有气泡,倒立在水槽里,到集气瓶中的水完全排出为止。
(2)排空气法:要把验满的工具放在靠近集气瓶口处,不能放在集气瓶内。
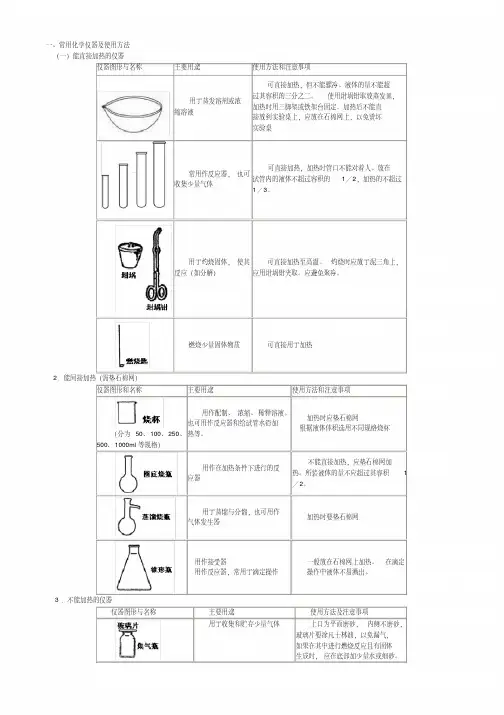
三、气体的干燥与除杂气体的干燥原则:浓硫酸、固体氢氧化钠、硫酸铜固体、氯化钙固体作干燥剂。
(1)选择干燥剂:选择干燥剂要根据气体和干燥剂的性质,干燥剂不能与被干燥的物质反应。
(2)选择干燥装置:干燥装置由干燥剂的状态来决定。
干燥时,装置要么是“长进短出”要么是“大口进、小口出”。
气体净化除杂原则:不减少被净化气体,不引进新的杂质。
除杂方法:酸性杂质用碱性试剂吸收,碱性杂质用酸性试剂吸收,或者用能与杂质生成沉淀或生成可溶性物质的试剂。
除杂顺序:一般来说,除杂在前,干燥在后。
四、氧气的制取2KClO3 =MnO2△=2KCl+3O2↑或2KMnO4=△=K2MnO4+MnO2+O2↑1、实验操作步骤:①连:按要求把仪器连接好②检:检查装置的气密性。

高中化学常用干燥剂的性能和用途:
1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H
2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:干燥能力强,干燥速度快,能再生,脱水温度200度。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能干燥酸性物质。
常用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、O2、N2等
6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K 烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
O2。
CO2。
CO 、N2。
Cl2、HCl 、H2S、 NH3、CH4等。

气体的净化和干燥方法
气体的净化和干燥是化学实验中常见的操作,以下是一些常见的方法:
1. 吸收法:利用气体与液体或固体接触时,气体中的杂质被吸收到液体或固体中的方法。
例如,用浓硫酸吸收水蒸气,用氢氧化钠溶液吸收二氧化碳等。
2. 过滤法:利用气体通过过滤器时,杂质被过滤器捕获的方法。
例如,用滤纸过滤气体中的灰尘等。
3. 干燥法:利用干燥剂吸收气体中的水蒸气的方法。
例如,用浓硫酸、氯化钙等干燥剂干燥气体。
4. 吸附法:利用吸附剂吸附气体中的杂质的方法。
例如,用活性炭、分子筛等吸附剂吸附气体中的有机物、硫化物等。
5. 燃烧法:利用燃烧将气体中的杂质转化为无害物质的方法。
例如,用燃烧的方法除去气体中的一氧化碳、氢气等。
在实际操作中,通常会根据气体的性质和实验要求选择合适的净化和干燥方法。
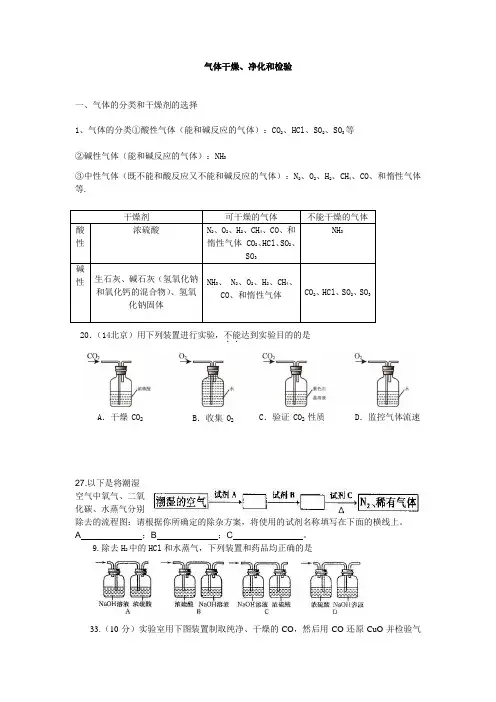
气体干燥、净化和检验一、气体的分类和干燥剂的选择1、气体的分类①酸性气体(能和碱反应的气体):CO2、HCl 、SO 2、SO 3等 ②碱性气体(能和碱反应的气体):NH 3③中性气体(既不能和酸反应又不能和碱反应的气体):N 2、O 2、H 2、CH 4、CO 、和惰性气体等.20.(14北京)用下列装置进行实验,不能..达到实验目的的是A .干燥 CO 2B .收集 O 2C .验证 CO 2 性质D .监控气体流速27.以下是将潮湿空气中氧气、二氧化碳、水蒸气分别除去的流程图:请根据你所确定的除杂方案,将使用的试剂名称填写在下面的横线上。
A ;B ;C 。
9.除去H 2中的HCl 和水蒸气,下列装置和药品均正确的是33.(10分)实验室用下图装置制取纯净、干燥的CO ,然后用CO 还原CuO 并检验气干燥剂 可干燥的气体 不能干燥的气体酸性 浓硫酸 N 2、O 2、H 2、CH 4、CO 、和惰性气体 CO 2、HCl 、SO 2、SO 3NH 3 碱性 生石灰、碱石灰(氢氧化钠和氧化钙的混合物)、氢氧化钠固体NH 3、 N 2、O 2、H 2、CH 4、CO 、和惰性气体CO 2、HCl 、SO 2、SO 3体产物。
已知草酸(H 2C 2O 4)在浓硫酸存在并加热的条件下,可分解生成一氧化碳、二氧化碳和水。
(1)写出A 、C 中有关反应的化学方程式。
(2)装置D 、E 的作用分别是什么?(3)要达到实验目的,装置中导管接口从左到右的连接顺序为:a 接 、 接 、 接 、 接 。
(4)从环保角度考虑,还需对以上装置进行改进,请简述改进措施。
(5)要制得6.4 g 铜,理论上至少需要20%的草酸溶液的质量是多少? 33. (10分)(1)H 2C 2O 4H 2O+CO 2↑+CO↑ CuO+COCu+CO 2 (2分)(2)D 的作用是检验二氧化碳;E 的作用是除去一氧化碳中的二氧化碳。
中学化学实验常见气体干燥剂的选择与使用气体的干燥就是气体净化中重要的步骤,掌握中学常见的气体干燥剂、干燥装置、干燥剂选择原则,十分重要,为了便于同学复习与应用,现总结如下。
一、干燥装置的基本类型与气体流动方向:盛装干燥剂状态液体干燥剂固体干燥剂装置示意图洗气瓶球形干燥管U形干燥管气体流动方向长管进气,短管出气U形干燥管,进气与出气没有区别;球形干燥管应该大口进气,小口出气(在干燥管的进出气口都要塞一团棉花,防止干燥剂流动)注意:1、固体干燥剂颗粒大小要适当,颗粒太大气体与干燥剂接触面小,不利于干燥效果不好;颗粒太小,气体不易通过,容易堵塞,一般以黄豆粒大小为宜。
2、液体干燥剂用量要适当,并控制好通入气体的速度,为了防止发生倒吸,在洗气瓶与反应容器之间应连接安全瓶。
二、气体的分类1、根据酸碱性,酸性气体:CO2、SO2、NO2、HCl、Cl2、H2S、HBr、HI等碱性气体:只有NH3中性气体:H2、O2、CH4、CO、CH2=CH2、C2H2、N2等2、根据常温氧化还原性强弱,强还原性气体:H2S、HBr、HI、SO2等一般性气体:H2、O2、CH4等三、气体干燥剂的类型及选择1、常用气体干燥剂按酸碱性可分为三类:①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。
酸性干燥剂能够干燥酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。
碱性干燥剂可以用来干燥碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙、无水硫酸铜等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
2、根据干燥剂的氧化性分两类①强氧化性干燥剂:浓硫酸②一般干燥剂:五氧化二磷、硅胶、生石灰、碱石灰、固体NaOH、CaCl2、CuSO4等3、干燥剂选择的基本原则:根据干燥剂与气体的性质选择,其基本原则就是干燥剂只吸收气体中的水分,不吸收被干燥的气体,具体表现在:(1)在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,如不能用碱石灰、CaO与NaOH干燥CO2、SO2、HCl、H2S、Cl2、NO2等;(2)显酸性的气体不能选用碱性干燥剂,如不能用P2O5、浓 H2SO4干燥 NH3;(3)还原性的气体不能选用有强氧化性的干燥剂,如不能用浓 H2SO4干燥 H2S、HBr、HI等;虽然H2、SO2、CO、CH4也有还原性,但就是浓硫酸在常温下不能氧化它们,可以用浓硫酸干燥。
各种常用干燥剂的性能和用途介绍1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成M g SO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
党用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、 O2、 N2等6、活性氧化铝(A l2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
O2 。
CO2 。
CO 、N2 。
Cl2、HCl 、H2S、 NH3、 CH4等由上述可知、对一些气体的干燥剂可作如下选择。
气体名称常用干燥剂气体名称常用干燥剂CO 浓H2SO4、CaCl2、P2O5 H2S CaCl2CO2 CaCl2、浓H2SO4、P2O5 N2 浓H2SO4、C aCl2、P2O5Cl2 CaCl2、浓H2SO4 NH3 CaO、KOH或碱石灰H2 CaCl2、P2O5 NO Ca(NO3)2HBr CaBr2、ZnBr2、 O3 CaCl2HCl CaCl2、浓H2SO4 SO2 浓H2SO4、CaCl2、P2O5HI CaI2液体适用干燥剂Drying Agents for Liquid s气体适用干燥剂Drying Agents for Gases干燥适用条件Applic ableCondit ion of Drying Agents常用干燥剂Common Drying Agents注:使用高氯酸盐时务必小心,碳、硫、磷及一切有机物都不能与之接触,否则会发生猛烈爆炸,造成危险。
(1)浓H2SO4:用于干燥H2、O2、N2、CO、CO2、SO2、HCl等气体,但不能干燥溶于水呈碱性的气体,如NH3。
(2)NaOH固体:用于于燥H2、O2、N2、CO、NH3等气体,但不能干燥溶于水呈酸性的气体,如CO2、SO2、HCl等气体。
(3)无水CuSO4:具有较强的吸水性,吸水后变蓝,生成CuSO4•5H2O,通常用无水CuSO4检验一些物质中是否含水。
(4)生石灰(CaO):易与水反应生成熟石灰Ca(OH)2,常用作食品袋中的干燥剂。
(5)碱石灰:CaO与NaOH的混合物,用法同NaOH固体。
(6)MgCl2、CaCl2:也有较强的吸水性,在一些实验中常用于吸收反应后生成的水蒸气(1)(2)1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
党用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、 O2、 N2等6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。
O2。
CO2。
CO 、N2。
Cl2、HCl 、H2S、 NH3、 CH4等由上述可知、对一些气体的干燥剂可作如下选择。
高中化学常用干燥剂标准化工作室编码[XX968T-XX89628-XJ668-XT689N]高中化学常用干燥剂有哪些1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、 O2、 N2等6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2 。
O2 。
CO2 。
CO 、N2 。
Cl2、HCl 、H2S、 NH3、 CH4等1 实验室中常用的干燥剂及其特性实验室中常用的干燥剂及其特性①无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快。
吸水后形成含不同结晶水的水合物CaCl2·nH2O(n= 1,2,4,6)。
最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。
但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。
同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。
如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO等,因此不能作为上述各类有机物的干燥剂。
气体干燥剂的选择:干燥剂(吸收水分使得气体干燥),选择干燥剂的原则是干燥剂只能吸收水分,不能与要干燥的气体发生反应,根据酸性气体(酸性气体指能与碱作用生成盐的气体)能与碱反应,碱性气体(碱性气体指能与酸作用生成盐的气体)能与酸反应的规律,酸性干燥剂可干燥酸性气体或中性气体,碱性干燥剂可干燥碱性气体或中性气体,中性干燥剂可干燥大部分气体。
1、气体的分类:酸性气体:CO2、SO2、H2S、NO2、Cl2中性气体:H2、O2、N2、CO碱性气体:NH3。
2、常用干燥剂的分类酸性干燥剂:浓H2SO4中性干燥剂:无水CaCl2、硅胶。
碱性干燥剂:生石灰、固体氢氧化钠、碱石灰(氧化钙和氢氧化钠的混合物)气体干燥剂的选择:干燥剂(吸收水分使得气体干燥),选择干燥剂的原则是干燥剂只能吸收水分,不能与要干燥的气体发生反应,根据酸性气体(酸性气体指能与碱作用生成盐的气体)能与碱反应,碱性气体(碱性气体指能与酸作用生成盐的气体)能与酸反应的规律,酸性干燥剂可干燥酸性气体或中性气体,碱性干燥剂可干燥碱性气体或中性气体,中性干燥剂可干燥大部分气体。
1、气体的分类:酸性气体:CO2、SO2、H2S、NO2、Cl2中性气体:H2、O2、N2、CO碱性气体:NH3。
2、常用干燥剂的分类酸性干燥剂:浓H2SO4、中性干燥剂:无水CaCl2、硅胶。
碱性干燥剂:生石灰、固体氢氧化钠、碱石灰(氧化钙和氢氧化钠的混合物)气体干燥剂的选择:干燥剂(吸收水分使得气体干燥),选择干燥剂的原则是干燥剂只能吸收水分,不能与要干燥的气体发生反应,根据酸性气体(酸性气体指能与碱作用生成盐的气体)能与碱反应,碱性气体(碱性气体指能与酸作用生成盐的气体)能与酸反应的规律,酸性干燥剂可干燥酸性气体或中性气体,碱性干燥剂可干燥碱性气体或中性气体,中性干燥剂可干燥大部分气体。
1、气体的分类:酸性气体:CO2、SO2、H2S、NO2、Cl2中性气体:H2、O2、N2、CO碱性气体:NH3。
气体干燥和干燥剂选择 Prepared on 22 November 2020
气体干燥、净化和检验
一、气体的分类和干燥剂的选择
1、气体的分类①酸性气体(能和碱反应的气体):CO
2、HCl 、SO 2、SO 3等
②(能和碱反应的气体):NH 3
③中性气体(既不能和酸反应又不能和碱反应的气体):N 2、O 2、H 2、CH 4、CO 、和等.
20.(14北京)用下列
装置进行实
验,不能..
达到实验目的的是 A .干燥CO 2 B .收集O 2 C .验证CO 2性质 D .监控气体流
速
27.以下是将潮湿空气中氧气、二氧化碳、水蒸气
分别除去的流程图:请根据你所确定的除杂方案,将使用的试剂名称填写在下面的横线上。
A ;B ;C 。
9.除去H 2中的HCl 和水蒸气,下列装置和药品均正确的是
33.(10分)实验室用下图装置制取纯净、干燥的CO ,然后用CO 还原CuO 并检验气体产物。
已知草酸(H 2C 2O 4)在浓硫酸存在并加热的条件下,可分解生成一氧化碳、二氧化碳和水。
干燥剂
可干燥的气体 不能干燥的气
体 酸性
浓硫酸
N 2、O 2、H 2、CH 4、CO 、和CO 2、HCl 、
SO 2、SO 3 NH 3
碱性 生石灰、碱石灰(氢氧化钠和氧化钙的混合
物)、氢氧化钠固体
NH 3、N 2、O 2、H 2、CH 4、CO 、和
CO 2、HCl 、SO 2、SO 3
(1)写出A、C中有关反应的化学方程式。
(2)装置D、E的作用分别是什么
(3)要达到实验目的,装置中导管接口从左到右的连接顺序为:a接、接、接、接。
(4)从环保角度考虑,还需对以上装置进行改进,请简述改进措施。
(5)要制得6.4 g铜,理论上至少需要20%的草酸溶液的质量是多少
33.(10分)(1)H2C2O4H2O+CO2↑+CO↑CuO+CO Cu+CO2(2分)(2)D的作用是检验二氧化碳;E的作用是除去一氧化碳中的二氧化碳。
(2分)
(3)h、i接b、c接d(或e)、e(或d)接f(全对得2分)
(4)将尾气点燃或进行收集等,防止一氧化碳污染空气。
(1分)
(5)解:设理论上至少需要20%的草酸溶液的质量为x。
H2C2O4~CO~Cu
9064
x×20%6.4 g
x=45 g(3分)
答:略。
52.(14上海)实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜。
制备氧化铜并检验产物,装置如下图所示(省略夹持仪器):
步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D,开始加热。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
甲
B 中发生反应的化学方程式为:
2
CO
3→2
请在中填入配平后的系数(10)。
C 中试剂是(11)。
A 的作用是吸收空气中的(12),防止对产物检验造成干扰。
选择t 3时停止加热的理由是(13)。
21.(14南京10分)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
【提出问题】生成的气体中是否含有一氧化碳 【实验与讨论】
①打开K ,缓缓通入干燥的氮气一段时间。
②关闭K ,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是。
B
【实验求证】
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A 中的
固体应选用,B 中溶液为澄清石灰水,若A 中黑色固体出现了红色,B 中澄清石灰水,可说明气体样品中含有一氧化碳。
【实验反思】
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、
氧元素的质量比(填“大于”、“等于”或“小于”)3∶8。
21.(本题共10分,化学方程式2分,【实验反思】2分,其余每空1分) (1)MgAgFe+CuSO 4=Cu+FeSO 4置换反应 (2)【实验与讨论】c
【实验求证】氧化铜(或CuO )变浑浊 【实验反思】大于
a b
c。