(整理)过氧化氢酶与过氧化物酶
- 格式:doc
- 大小:23.00 KB
- 文档页数:4

一.超氧化物歧化酶(SOD):超氧化物歧化酶,是一种新型酶制剂,是生物体内重要的抗氧化酶,广泛分布于各种生物体内,如动物,植物,微生物等。
SOD具有特殊的生理活性,是生物体内清除自由基的首要物质。
SOD在生物体内的水平高低意味着衰老与死亡的直观指标;现已证实,由氧自由基引发的疾病多达60多种。
它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞。
由于现代生活压力,环境污染,各种辐射和超量运动都会造成氧自由基大量形成;因此,生物抗氧化机制中SOD的地位越来越重要!超氧化物歧化酶(SOD)按其所含金属辅基不同可分为三种,第一种是含铜(Cu)锌(Zn)金属辅基的称(Cu.Zn—SOD),最为常见的一种酶,呈绿色,主要存在于机体细胞浆中;第二种是含锰(Mn)金属辅基的称(Mn—SOD),呈紫色,存在于真核细胞的线粒体和原核细胞内;第三种是含铁(Fe)金属辅基的称(Fe—SOD),呈黄褐色,存在于原核细胞中。
SOD是一种含有金属元素的活性蛋白酶。
超氧化物岐化酶(SOD)能催化如下的反应:O2-+H+→H2O2+O2,O2-称为超氧阴离子自由基,是生物体多种生理反应中自然生成的中间产物。
它是活性氧的一种,具有极强的氧化能力,是生物氧毒害的重要因素之一。
SOD是机体内天然存在的超氧自由基清除因子,它通过上述反应可以把有害的超氧自由基转化为过氧化氢。
尽管过氧化氢仍是对机体有害的活性氧,但体内的过氧化氢酶(CAT)和过氧化物酶(POD)会立即将其分解为完全无害的水。
这样,三种酶便组成了一个完整的防氧化链条。
目前,人们认为自由基(也称游离基)与绝大部分疾病以及人体的衰老有关。
所谓的自由基就是当机体进行代谢时,能夺去氧的一个电子,这样这个氧原子就变成自由基。
自由基很不稳定,它要在身体组织细胞的分子中再夺取电子来使自己配对,当细胞分子推陈出新一个电子后,它也变成自由基,又要去抢夺细胞膜或细胞核分子中的电子,这样又称会产生新的自由基。
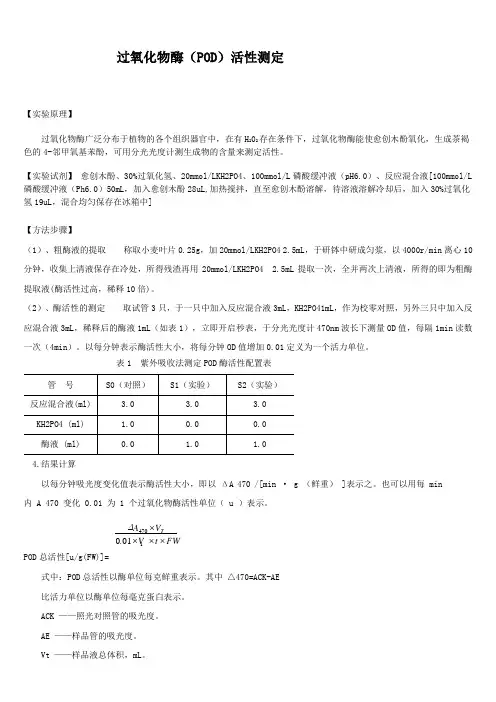
过氧化物酶(POD )活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H 202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】 愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L 磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL ,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL ,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取 称取小麦叶片0.25g ,加20mmol/LKH2PO4 2.5mL ,于研钵中研成匀浆,以4000r/min 离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL 提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定 取试管3只,于一只中加入反应混合液3mL ,KH2PO41mL ,作为校零对照,另外三只中加入反应混合液3mL ,稀释后的酶液1mL (如表1),立即开启秒表,于分光光度计470nm 波长下测量OD 值,每隔1min 读数一次(4min )。
以每分钟表示酶活性大小,将每分钟OD 值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD 酶活性配置表4.结果计算以每分钟吸光度变化值表示酶活性大小,即以 ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每 min内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD 总活性[u/g(FW)]=式中:POD 总活性以酶单位每克鲜重表示。
其中 △470=ACK-AE比活力单位以酶单位每毫克蛋白表示。
ACK ——照光对照管的吸光度。
AE ——样品管的吸光度。
Vt ——样品液总体积,mL 。





抗氧化酶(SOD、POD、CAT)活性测定方法抗氧化酶是生物体内重要的防御系统,它们通过清除自由基来保护细胞免受氧化损伤。
其中,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是三种主要的抗氧化酶。
测定这些酶的活性对于评估生物体的抗氧化能力具有重要意义。
本文将介绍几种常用的抗氧化酶活性测定方法。
1. 超氧化物歧化酶(SOD)活性测定方法SOD是一种能够催化超氧阴离子自由基(O2)歧化为氧气(O2)和过氧化氢(H2O2)的酶。
常用的SOD活性测定方法包括:氮蓝四唑(NBT)法:利用NBT在超氧阴离子自由基存在下被还原成蓝色化合物的特性,通过测定反应液的吸光度变化来计算SOD活性。
羟胺法:利用羟胺与超氧阴离子自由基反应硝酸盐,通过测定硝酸盐的量来计算SOD活性。
2. 过氧化物酶(POD)活性测定方法POD是一种能够催化过氧化氢(H2O2)分解为水和氧气的酶。
常用的POD活性测定方法包括:愈创木酚法:利用愈创木酚在过氧化物酶存在下被氧化红色化合物的特性,通过测定反应液的吸光度变化来计算POD活性。
邻苯三酚法:利用邻苯三酚在过氧化物酶存在下被氧化紫色化合物的特性,通过测定反应液的吸光度变化来计算POD活性。
3. 过氧化氢酶(CAT)活性测定方法CAT是一种能够催化过氧化氢(H2O2)分解为水和氧气的酶。
常用的CAT活性测定方法包括:紫外分光光度法:利用过氧化氢在紫外光下具有吸收的特性,通过测定反应液的吸光度变化来计算CAT活性。
酶偶联法:利用过氧化氢在过氧化物酶存在下被氧化水的特性,通过测定水的量来计算CAT活性。
抗氧化酶(SOD、POD、CAT)活性测定的实验步骤与注意事项实验步骤1. 样品准备提取酶:根据实验目的,选择合适的组织或细胞提取酶。
常用的提取缓冲液包括磷酸盐缓冲液、TrisHCl缓冲液等。
离心:将提取液离心,分离上清液和沉淀物。
上清液中含有目标酶,沉淀物则含有杂质。
蛋白质定量:使用 Bradford 法或 Lowry 法等蛋白质定量方法测定上清液中的蛋白质浓度。

过氧化物酶体的发现,过氧化物酶(形态结构、功能反应)过氧化物酶是由微生物或植物所产生的一类氧化还原酶,它们能催化很多反应. 过氧化物酶是以过氧化氢为电子受体催化底物氧化的酶。
主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。
简介氧化还原酶的一种。
过氧化物酶是由微生物或植物所产生的一类氧化还原酶,它们能催化很多反应. 过氧化物酶是以过氧化氢为电子受体催化底物氧化的酶。
主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。
过氧化物酶体过氧化物酶体是由一层单位膜包裹的囊泡, 直径约为0.5~1.0μm, 通常比线粒体小。
普遍存在于真核生物的各类细胞中,在肝细胞和肾细胞中数量特别多。
过氧化物酶体的标志酶是过氧化氢酶,它的作用主要是将过氧化氢水解。
过氧化氢(H2O2)是氧化酶催化的氧化还原反应中产生的细胞毒性物质,氧化酶和过氧化氢酶都存在于过氧化物酶体中,从而对细胞起保护作用。
植物体中含有大量过氧化物酶,是活性较高的一种酶。
它与呼吸作用、光合作用及生长素的氧化等都有关系。
在植物生长发育过程中它的活性不断发生变化。
一般老化组织中活性较高,幼嫩组织中活性较弱。
这是因为过氧化物酶能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度,而且发现早衰减产的水稻根系中过氧化物酶的活性增加,所以过氧化物酶可作为组织老化的一种生理指标。
此外,过氧化物同工酶在遗传育种中的重要作用也正在受到重视.催化从底物移去电子,并转给过氧化氢反应。
即:供体+H2O2→氧化的供体+2H2O,是一种血红素蛋白(hemoprotein)。
如过氧化氢酶便是过氧化物酶的一种。
过氧化氢酶可与葡萄糖氧化酶配合使用,脱除蛋清中的葡萄糖,代替了传统的自然发酵的方法,从而提高产品质量,缩短生产周期。
在医学上,也可作为工具酶,用于检验尿糖和血糖。

磷脂过氧化氢谷胱甘肽过氧化物酶磷脂过氧化氢和谷胱甘肽过氧化物酶是生物体内两种重要的氧化还原反应酶。
本文将从分子结构、生物学功能、代谢通路、调控机制等多个方面详细介绍这两种酶。
一、磷脂过氧化氢磷脂过氧化氢(phospholipid hydroperoxide, PLHP)是一种具有强氧化性的有机物,常常由脂肪酸、磷脂酰胆碱、脂肪酰肌醇等氧化生成。
PLHP会导致膜脂质的氧化损伤,严重的损伤可能导致生物膜的完整性失效。
1.分子结构磷脂过氧化氢酶是一种谷胱甘肽过氧化物酶家族(glutathione peroxidase,GPx)中的一个成员。
与一般的GPx不同的是,PHGPx有两个反应中心:一个是对PLHP的直接酶促还原,另一个是将草鱼卵黄急速酸化后形成的玉米油酸甘油磷酸(MPPC)还原为MPPOH的催化反应。
PHGPx 是一个多肽链蛋白,包括重链和轻链。
轻链含有一个谷胱甘肽,谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸三个氨基酸组成的三肽,是一种细胞内的重要抗氧化剂。
在还原反应中,谷胱甘肽经过金属茎德尔反应(metal-stimulated Delreaction)发生硫酯键的双反应,作为高效的氧化剂消耗过氧化氢类物质。
在是谷胱甘肽分子断环形式之后,还原次数可以在没有外源氧化剂的情况下进行数十次。
2.生物学功能在生物体内,磷脂过氧化氢可以经由多条代谢通路生成和消除。
PHGPx 所在的代谢通路是一种以半面体谷胱甘肽为还原试剂的代谢通路,这种代谢通路可以保护羊膜内皮细胞中的微血管系统,减少有害物质的产生,从而保护胎儿。
此外,PHGPx还具有改善思维能力、保护大脑神经细胞,调节生长发育和免疫功能等多种重要生物学功能。
3.代谢通路PHGPx代谢通路是由PHGPx、NADPH和谷胱甘肽三个组成部分组成的。
当细胞代谢产生PLHP,PHGPx催化PLHP和还原型谷胱甘肽反应,生成对应的水和还原型PLP。
在还原过程中,谷胱甘肽起到还原剂的作用。


生物氧化学习要求是如何生成的。
ATP的主要生成方式、氧化1.掌握生物氧化过程中体内水和CO2磷酸化的概念、呼吸链的组成及作用特点。
2.熟悉生物氧化的特点、反应方式及所需要的酶类。
氧化磷酸化的机制。
3.了解NADH及ATP的转运及非线粒体氧化体系的特点。
基本知识点物质在生物体内的氧化称生物氧化,主要指糖、脂肪、蛋白质在体内分解时逐步释放能量,以维持生命活动,并最终生成CO2和H2O的过程。
生物氧化主要在线粒体中进行,线粒体内膜存在多种有氧化还原功能的酶和辅酶排列组成的氧化呼吸链或称电子传递链,可将代谢物脱下的质子、电子逐步逐步传递给氧生成水,并释放物质氧化的能量。
组成呼吸链成分有四种复合体:NADH泛醌还原酶(复合体Ⅰ)、琥珀酸-泛醌还原酶(复合体Ⅱ)/ 泛醌细胞色素C还原酶(复合体Ⅲ)、细胞色素C氧化酶(复合体Ⅳ)。
通过测定呼吸链各组分的标准氧化还原电位等方法,可以推测出呼吸链各组分电子传递顺序。
根据传递顺序的不同体内存在两条呼吸链:NADH氧化呼吸链和琥珀酸氧化呼吸链。
排列顺序为:NADH氧化呼吸链:NADH→FMN→CoQ→Cytb→Cytc1→Cytc→Cytaa3→1/2O2琥珀酸氧化呼吸链琥珀酸→FAD→CoQ→Cytb→Cytc1→Cytc→Cytaa3→1/2O2体内ATP生成的主要方式是氧化磷酸化作用。
营养物质分解途径产生的NADPH+H+和FADH2提供的氢经4种复合体组分的电子传递链,最后与O2结合生成H2O,复合体Ⅰ、Ⅲ、Ⅳ有质子泵功能,可同时将H+从线粒体内膜基质侧转移到胞液侧,形成跨线粒体内膜的H+电化学梯度储存氧化释放的能量。
ATP 合酶利用顺梯度回流时释放出的势能,驱动F0-F1复合体旋转β亚基构象次序改变,催化ADP和Pi合成、释放ATP。
计算结果表明,每对氢经NADH氧化呼吸链传递产生约2.5个ATP,每对氢经琥珀酸氧化呼吸链传递产生约1.5个ATP。
氧化磷酸化抑制剂包括呼吸链抑制剂、解偶联剂和ATP合酶抑制剂。
关于重氮和偶氮,其英文前缀是有明显区别地,重氮是,偶氮是,在化学结构上也相差很大,试以氯化重氮苯和对氨基偶氮苯两种典型地结构式为例,分列于下:由上式可以看出,重氮化合物是一种盐,其中重氮苯基带正电荷.重氮基中地两个相联地氮原子只有一端与苯基相连;而偶氮基不带电荷,它不是盐,其中相联地两个氮原子地两端与两个苯基相连.重氮盐大都不稳定(易爆炸),多半要临时制备.例如,用氨基苯磺酸新鲜配制地亚硝酸钠,在酸性条件下,可在实验室内临时制成一种重氮盐(重氮化反应),这种重氮盐在与一种芳香胺或苯酚化合时,生成偶氮化合物,称为偶联反应.重氮基不是发色基团,故重氮盐本身无色,而偶氮基是发色基团,以致经常误用,如重氮盐说成偶氮盐,偶氮染料说成重氮染料等等.、网织红细胞,网状细胞网织红细胞和网状细胞地英文名称都是,均来源于拉丁文(网)加后缀(细胞)所构成,英译汉时要根据上下文地意思选用.不过,网状细胞是一个过时地名词.近代地研究早已明确,外周血中地单核细胞,进入组织以后就变成以前所谓地“网状内皮系统”()一词,改称为单核一巨噬细胞系统().同样,网状细胞也已改称为组织细胞(),网状细胞一词实际上已经废除.但目前不少临床医师和检验工作者仍在使用着.、球蛋白,珠蛋白,结合珠蛋白球蛋白()是大家熟知地α,β,γ免疫球蛋白()之类.珠蛋白()是构成血红蛋白(和肌红蛋白)地蛋白质部分.血红蛋白是由珠蛋白结合一个血红素(一种结合了一个铁原子地卟啉)辅基所构成地.结合珠蛋白又称触珠蛋白(),是一种能结合血红蛋白地蛋白质,它能将血浆中地游离血红蛋白带到单核一巨噬细胞系统进行处理.溶血性贫血时,血中浓度会降低.由于以上三个词地英文中均有这个词根,又因为球和珠这两个字外形十分相似,故在英译汉及中文书写中,经常会搞错或造成“笔误”.、过氧化氢酶,过氧化物酶过氧化氢酶又称触酶(),酶学委员会编号为1.11.1.;过氧化物酶()编号为.这两种酶都含有血红素辅基,其底物中都含有过氧化物,如过氧化氢,因而经常被有些同志混为一谈,甚至在论述其机理时说:“过氧化物酶作用于过氧化氢,使过氧化氢放出新生氧,氧化联苯胺,使呈蓝色……”,这显然是不对地,我们可以从下列反应式中看出.在这一反应中,实际上底物只有一种——,只不过一分子地作为氢(电子)地供体,它被氧化(脱氢)成,而另一个分子地则为氢地受体,在接受氢原子后被还原成水().在这个反应中,底物有两个,除了外,还有一个,它是氢地供体,在医学检验中多用芳香胺或苯酚类.过氧化物酶催化脱氢(氧化)后产生了发色基团(如醌式结构),从而有了颜色;同时使还原作.由上述反应式可知,()本反应必须有两个底物,如没有,反应不能进行.()本反应氧化底物,不是由于产生了新生氧,而是由于脱氧.血红蛋白具有过氧化物酶样地活性,而不是过氧化氢酶样活性.关于这一问题,作者在《临床检验杂志》年第期已有详细介绍,兹不赘述.、卟啉,紫质,胆色素原,卟胆原,紫质原,紫胆原卟啉()过去曾译成紫质(至今仍有些临床医生这样称呼),是构成血红素和细胞色素地骨架,它是一种由四个吡咯环组成地环状结构.当它螯合有个铁原子后,就是血红素.胆色素原()旧称卟胆原、紫质原或紫胆原,是一种单吡咯结构,它是卟啉生物合成过程中地一种中间体(即卟啉、血红素及其代谢物胆红素地前体).卟啉有很多异构体,例如,构成人类血红蛋白地辅基血红素地卟啉叫原卟啉Ⅸ;铅中毒时铅抑制了血红素地合成,患者尿中排出地主要是粪卟啉(原)Ⅲ(Ⅲ);而一些遗传性卟啉病患者尿中排出者则是卟啉地前体——胆色素原()和尿卟啉原Ⅰ.关于卟啉类及其前体物质地命名,在现代地生物化学教科书和生化词典上都已统一和规范.但由于其中涉及地代谢过程较复杂,专用名词甚多,加上一般临床上医生或老检验人员还不熟悉新地命名,以致造成当前新旧名称混淆、乱用地现象比较普遍.、构型、构象构型()是指原子在分子中呈光学不对称排布地一种立体结构,如氨基酸地型和型等,只有分子地共价键断裂,才能使一种构型变成另一种构型.构象()也是一种分子地立体结构,构象地改变并不改变其共价键结构(原子只在单链周围旋转).例如酶与底物,抗体与抗原,生物地受体与配体地相互作用,往往涉及酶、抗体、受体等蛋白质地构象改变.目前最常见地错误是将本该是构象地说成是构型.、稀释度,滴度和效价稀释度()是溶液被冲淡地程度.例如,血清加地生理盐水,则稀释度为:.滴度()是稀释度地倒数.例如上例中地:地稀释度,其滴度就是.效价是滴度地同义词.效价即滴度,两者通用.当前虽然专业地化学和免疫学词典和专著中对这些词地使用已规范化,但在不少书刊地文章中常见误用,如称效价:之类.二、常见地容易写错地字、拘橼酸钠错写成枸椽酸钠.、蓝色错写成兰色.兰是过去繁体字兰花地兰地简化汉字,一般只用于兰花.、写成(应为小写!).、还有一些过去曾经用过,但目前国内或国际上已有新规定,必须更改地字(词)或写法,部分同志由于习惯或消息闭塞,仍在用旧地名称或写法.现举其重要者如下:个人收集整理勿做商业用途抗生素英文,这个词原来就译成抗生素.但在“***”期间,在极左思潮地影响下,刮过一阵改“洋人”名词之风.有人提议修改了一大批中文译名,例如将本周氏蛋白()改为凝溶蛋白;将革兰氏染色(’ )改为固紫染色;将抗生素改为抗菌素等等.这种修改,有地十分荒谬.就抗生素而论,它不仅抗细菌,也有地抗立克次氏体、支原体、衣原体,甚至抗肿瘤和抗移植物排斥等,用抗生素这一译名是十分贴切地.目前这些擅改地名词大都改回来了,但至今仍有人在用抗菌素、凝溶蛋白之类地名称.与上述情况相反,有一些旧地名词、术语、符号、缩写等,国际上已有新地规定,要进行修改,国内亦已介绍,但由于已经习惯或消息闭塞,有些旧地名词,至今仍广泛流传.例如,(丙氨酸转氨酶),仍有人称它为谷丙转氨酶();天门冬氨酸转氨酶()仍有人叫谷草转氨酶();甚至国际上已改了几十年地乙型肝炎表面抗原(),至今仍有人叫它什么“澳抗”(澳大利亚抗原,即最初在澳大利亚发现此物个人收集整理勿做商业用途。
过氧化物酶和过氧化氢酶
过氧化物酶是一类重要的酶,它们分别可以催化各种过氧化物的生成
和转化,过氧化物酶包括过氧化氢酶、过氧化酶、脱氢酶等。
过氧化物酶
也被称为氧化酶,其主要功能表现为氧化还原反应,在细胞和组织中起着
重要的作用。
过氧化氢酶是一类重要的过氧化物酶,它可以催化过氧化物的生成和
转移。
过氧化氢酶的催化机制是,首先它将过氧化氢转化为一个活性的氢
离子,然后再将其与周边的过氧化物结合在一起,这样就可以消耗过氧化物,导致化合物的氧化反应。
过氧化氢酶也可以促进葡萄糖的氧化,以便
细胞可以利用葡萄糖通过这些氧化反应来获取能量,满足自身的能量需求。
土壤酶活性测定方法土壤脲酶的测定方法(苯酚钠—次氯酸钠比色法)一、原理脲酶存在于大多数细菌、真菌和高等植物里。
它是一种酰胺酶作用是极为专性的,它仅能水解尿素,水解的最终产物是氨和二氧化碳、水。
土壤脲酶活性与土壤的微生物数量、有机物质含量、全氮和速效磷含量呈正相关。
根际土壤脲酶活性较高,中性土壤脲酶活性大于碱性土壤。
人们常用土壤脲酶活性表征土壤的氮素状况。
土壤中脲酶活性的测定是以脲素为基质经酶促反应后测定生成的氨量,也可以通过测定未水解的尿素量来求得。
本方法以尿素为基质,根据酶促产物氨与苯酚-次氯酸钠作用生成蓝色的靛酚,来分析脲酶活性。
二、试剂1)甲苯2)10%尿素:称取10g尿素,用水溶至100ml。
3)PH6.7柠檬酸盐缓冲液:184g柠檬酸和147.5g氢氧化钾(KOH)溶于蒸馏水。
将两溶液合并,用1mol/LNaOH将PH调至6.7,用水稀释定容至1000ml。
4)苯酚钠溶液(1.35mol/L):62.5g苯酚溶于少量乙醇,加2ml甲醇和18.5ml丙酮,用乙醇稀释至100ml(A液),存于冰箱中;27gNaOH溶于100ml水(B液)。
将A、B溶液保存在冰箱中。
使用前将A液、B液各20ml混合,用蒸馏水稀释至100ml。
5)次氯酸钠溶液:用水稀释试剂,至活性氯的浓度为0.9%,溶液稳定。
6)氮的标准溶液: 精确称取0.4717g硫酸铵溶于水并稀释至1000ml,得到1ml含有0.1mg氮的标准液。
绘制标准曲线时,再将此溶液稀释10倍供用。
三、操作步骤标准曲线制作:分别吸取稀释后的标准液0、1、3、5、7、9、11、13ml,移于50ml容量瓶中,然后补加蒸馏水至20ml。
再加入4ml苯酚钠溶液和3ml次氯酸钠溶液,随加随摇匀。
20min后显色,定容。
1h内在分光光度计上于578nm波长处比色。
然后以氮工作液浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
称取5g土样于50ml三角瓶中,加1ml甲苯。
微生物过氧化氢酶是一种重要的工业酶制剂,可以催化分解过氧化氢生成水和氧气。
这一酶制剂在食品、纺织、医药等领域表现出广泛的应用潜力。
生物工程和基因工程技术的进步推动了微生物过氧化氢酶的发酵生产。
以下综述了微生物过氧化氢酶发酵生产的进展及其在纺织工业中的应用,同时讨论了微生物过氧化氢酶的发酵生产和纺织工业应用的未来趋势。
1 过氧化氢酶简介过氧化氢酶 (Hydrogen peroxide oxidoreductase,catalase EC1.11.1.6.) 是一类以过氧化氢为专一底物,通过催化一对电子的转移而最终将其降解为水和氧气的酶。
研究表明几乎所有的需氧微生物中都存在过氧化氢酶,只有少数好氧菌如过氧化醋杆菌Acetobacter peroxydas 不存在过氧化氢酶[1-4]。
除谢氏丙酸杆菌Propionibacterium shermanji 和巨大脱硫弧菌Desulfovibrio gigas 等微生物外,绝大多数厌氧微生物体内不存在过氧化氢酶[5]。
根据过氧化氢酶在结构和序列水平上的异同将其划分为3 个亚群,即单功能过氧化氢酶 (Monofunctional catalase or Typicalcatalase)、双功能过氧化氢酶 (Catalase-peroxidase) 和假过氧化氢酶 (Pseudocatalase or Mn-catalasee)。
大多数的过氧化氢酶由4 个相同的亚单位组成,分子量在240 kDa 左右,在亚基的活性部位各含一个血红素基团[6]。
来自哺乳动物以及某些真菌和细菌的过氧化氢酶还含有4 个紧密结合的NADPH 分子。
过氧化氢酶可被氰化合物、苯酚类、叠氮化物、过氧化氢、尿素及碱等物质所阻抑。
过氧化氢酶主要集中存在于细胞的过氧化物酶体中,另外线粒体和细胞质中也含有少量的过氧化氢酶。
过氧化氢酶能及时分解细胞内产生 (主要为SOD 歧化产物) 或由胞外进入细胞的过氧化氢。
植物体内的保护酶系统摘要植物在逆境条件下产生的活性氧自由基(ROS)会对植物的细胞膜以及蛋白质等大分子物质产生破坏作用,从而影响到植物的正常生长与发育。
同时在逆境条件下植物体内存在保护酶系统,即抗氧化酶系统,能够消除体内多余的自由基,植物体内的抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD),综述了3种抗氧化酶的主要特征及功能,以为植物体内保护酶系统的研究提供参考。
关键词逆境;自由基;保护酶;特征;功能植物生长在自然环境条件下,不可避免地受到多种逆境胁迫,如重金属、干旱、盐、高温、低温、高辐射、紫外线、养分缺乏和大气污染。
这些非生物胁迫均会产生次级胁迫,使植物直接或间接形成过量的活性氧自由基(ROS),而ROS对细胞膜系统、脂类、蛋白质和核酸等大分子具有很强的破坏作用。
逆境条件下植物体同时存在保护酶系统,能够清除体内多余的自由基,这一保护酶系统实际上是一个抗氧化系统,它由许多酶和还原性物质组成,其中超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxide enzyme,POD)是主要的抗氧化酶,植物通过抗氧化酶加强抗氧化作用提高对逆境的抗性,从而防止自由基毒害。
1超氧化物歧化酶植物在逆境胁迫条件下,会产生活性氧胁迫,活性氧的累积主要是由大量的超氧自由基所致,超氧自由基可通过酶促反应歧化生成H2O2和O2,或产生氧化活性更强的羟基自由基(·OH)。
对于清除超氧自由基起关键作用的是超氧化物歧化酶(SOD)[1]。
SOD是一种含金属的抗氧化酶,在植物界普遍存在且具有多种类型。
这些不同类型的SOD具有不同的分子质量和氨基酸序列,而且位于酶活性中心的金属原子也不同[2]。
根据SOD所结合的金属原子的不同,植物SOD可分为3种类型:Cu/Zn-SOD、Mn-SOD和Fe-SOD。
Cu/Zn-SOD分子量32 000,由2个亚基组成,每个亚基结合着1个Cu或Zn原子;Mn-SOD分子量84 000,由4个亚基构成,每个亚基各含1个Mn原子;Fe-SOD分子量42 000,由2个亚基构成,每个亚基结合1个Fe原子。
过氧化氢酶与过氧化物酶
朱忠勇(南京军区福州总医院, 福州350025)
过氧化氢酶和过氧化物酶, 是两种广泛存在于
动植物体内、含血红素(铁卟啉) 辅基的氧化还原酶。
由于它们作用的底物都有过氧化氢, 所以在一些医
学检验杂志或教科书上, 往往将它们混淆, 甚至对其
作用机理作不恰当的解释。
1过氧化氢酶
过氧化氢酶(Hydrogen Peroxidase) 又称触酶(Catalase) , 其系统名称(Systemat ic name) 是:
H2O 2: H2O 2氧化还原酶(H2O 2
÷H2O 2 O xido redu2
catase) , 国际酶学委员会的编号为EC 11111116, 其
催化反应式如下:
H2O 2+ H2O 2
触酶
2H2O + O 2
在这个反应中, 底物只有一种——过氧化氢。
实
际上是一分子的H2O 2作为氢(电子) 的供体, 被氧
化成O 2; 而另一分子H2O 2被还原为H2O。
2过氧化物酶
过氧化物酶(Peroxidase) 也有人简称过氧化酶,
其系统名称是: 供体: 过氧化氢氧化还原酶(Dono r:
H2 O 2O xido reductase) , 编号为EC 11111117。
其催化反应式为:
供体+ H2O 2
过氧化物酶
氧化的供体+ H2O
或更简明地表达为
RH2+ H2O 2
过氧化物酶
R + 2H2O
(供体) (氧化的供体)
在这个反应中, 底物有两个; 一个是H2O 2, 另一个
为一种氢(电子) 的供体(Dono r)。
在医学检验中, 多
用胺类(如联苯胺, 二氨基联苯胺, 联邻甲苯胺等)
作为供体(也可以用酚) , 因为这些物质脱氢后往往
会呈现颜色。
由上述两种反应可以清楚地看出, 两种酶的区
别是十分明显的。
触酶只有一种底物, 生成的是水和氧气。
而过氧化物酶则要两种底物, 其反应的实质是: 酶催化供体脱氢(氧化) , 同时催化脱下的氢使
H2O 2还原为H2O。
在这个反应中, 如果只有H2O 2, 没有供体, 反应不能进行。
在整个反应过程中不产生氧
气。
有些文章说“过氧化物酶能催化H2O 2放出新生
氧, 氧化联苯胺⋯⋯”是不对的。
过氧化氢酶是广泛分
布于植物及动物的一些组织、细胞(如人的红细胞、
肝脏、肾脏等) 中的酶, 其最简单的定性试验是, 加
入H2O 2后, 立即有大量氧气泡出现。
顺便说一说, 血红蛋白具有过氧化物酶样的作
用, 而不是过氧化氢酶的作用。
并且还应注意, 人体
内有些细胞含有真正的过氧化物酶, 如中性粒细胞、
单核细胞、嗜酸性细胞等, 如与血红蛋白同时存在,
会造成“潜血试验”阳性。
一般酶不耐热, 而血红蛋
白比较耐热, 可资区别。
另外用免疫学方法检测也可
区别。
还有一点, 过氧化物酶现多用作酶联免疫吸附
试验的标记酶, 常用的是自辣根中提取的辣根过氧
化物酶。
这个酶的质量指标之一是RZ (Reinbeit2
szah l) 值。
RZ 值是指将此酶溶于去离子水中, 配成
015~110mgöm l 溶液时, 在403 nm 和275 nm 分别
测定吸光度, 其A 403
öA
275的比值, 即RZ 值。
此值主
要反映酶蛋白中血红素的量, 并不表示酶活性。
当
然, 如产品中不含血红素的杂蛋白多时, RZ 值低; 反
之, RZ 值高, 故也可在一定程度上反映酶的纯度。
但
也存在RZ 值高而活性低的现象, Sigma 公司在其产
品目录中就提醒过这一点。
一般用作标记的辣根过
氧化物酶的RZ 值在310左右为宜。
(1997—11—25收稿)
过氧化物酶是由微生物或植物所产生的一类氧化还原酶,它们能催化很多反应。
过氧化物酶是以过氧化氢为电子受体催化底物氧化的酶。
主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。
氧化还原酶的一种。
过氧化物酶是由微生物或植物所产生的一类氧化还原酶,它们能催化很多反应. 过氧化物酶是以过氧化氢为电子受体催化底物氧化的酶。
主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚
类、胺类毒性的双重作用。
过氧化物酶体(peroxisome)又称微体(microbody),过氧化物酶体在1954年被发现时, 由于不知道这种颗粒的功能,将它称为微体(microbody)。
过氧化物酶体是由一层单位膜包裹的囊泡, 直径约为0.5~1.0μm, 通常比线粒体小。
与溶酶体不同,过氧化物酶体不是来自内质网和高尔基体,因此它不属于内膜系统的膜结合细胞器。
过氧化物酶体普遍存在于真核生物的各类细胞中,但在肝细胞和肾细胞中数量特别多。
过氧化物酶体含有丰富的酶类,主要是氧化酶,过氧化氢酶和过氧化物酶。
氧化酶可作用于不同的底物,其共同特征是氧化底物的同时,将氧还原成过氧化氢。
过氧化物酶体的标志酶是过氧化氢酶,它的作用主要是将过氧化氢(H2O2, Hydrogen Peroxide)水解。
过氧化氢(H2O2)是氧化酶催化的氧化还原反应中产生的细胞毒性物质,氧化酶和过氧化氢酶都存在于过氧化物酶体中,从而对细胞起保护作用。
过氧化氢酶,是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。
过氧化氢酶是过氧化物酶体的标志酶, 约占过氧化物酶体酶总量的40%。
过氧化氢酶存在于所有已知的动物的各个组织中,特别在肝脏中以高浓度存在。
过氧化氢酶在食品工业中被用于除去用于制造奶酪的牛奶中的过氧化氢。
过氧化氢酶也被用于食品包装,防止食物被氧化。
过氧化氢酶存在于红细胞及某些组织内的过氧化体中,它的主要作用就是催化H2O2分解为H2O与O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的-OH 过氧化氢酶的作用是使过氧化氢还原成水:2H2O2=O2 + 2H2O 中文名称:过氧化氢酶[1] 中文别名:自溶血性链球菌分离的过氧化氢酶;接触酶英文名称:CATALASE FROM MICROCOCCUS LYSODEIKTICUS 英文别名:Fungal catalase; catalase from bovine liver; catalase F. bov. liv.,cryst.susp. in H2O; Catalase from microorganisms; catalse from bovine liver; catalase from human erythrocytes; catalase from dog liver; catalase from mouse liver; catalase from bison liver; Catalase (bovine liver); Catalase, Human Erythrocytes; Catalase Aspergillus niger; Catalase from Corynebacterium glutamicum; Catalase Micrococcus lysodeikticus; Catalase CAS:9001-05-2[2] EINECS:232-577-1 触酶过氧化氢酶(CAT)是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。
它可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。
CAT作用于过氧化氢的机理实质上是H2O2的歧化,必须有两个H2O2先后与CAT相遇且碰撞在活性中心上,才能发生反应。
H2O2浓度越高,分解速度越快。
过氧化氢酶存在于所有已知的动物的各个组织中,特别在肝脏中以高浓度存在。
在投弹手甲虫(bombardier beetle)中,过氧化氢酶具有独特用途。
这种甲虫具有两套分开储存于腺体中的化学物。
大的腺体中储存着对苯二酚和过氧化氢,而小的腺体中储存着过氧化氢酶和辣根过氧化物酶。
当甲虫将两个腺体中的化学物质混合在一起时,就会释放出氧气,而氧气既可以氧化对苯二酚又可以作为助推剂。
过氧化氢酶也普遍存在于植物中,但不包括真菌,虽然有些真菌被发现在低pH值和温暖的环境下能够产生该酶。
绝大多数需氧微生物都含有过氧化氢酶[4]。
例外包括Streptococcus,一种没有过氧化氢酶的需氧细菌。
部分厌氧微生物,如Methanosarcina barkeri,也含有过氧化氢酶。
应用过氧化氢酶在食品工业中被用于除去用于制造奶酪的牛奶中的过氧化氢。
过氧化氢酶也被用于食品包装,防止食物被氧化。
在纺织工业中,过氧化氢酶被用于除去纺织物上的过氧化氢,以保证成品是不含过氧化物的。
它还被用在隐形眼镜的清洁上:眼镜在含有过氧化氢的清洁剂中浸泡后,使用前再用过氧化氢酶除去残
留的过氧化氢。
过氧化氢酶在美容业中的使用:一些面部护理中加入了该酶和过氧化氢,目的是增加表皮上层的细胞氧量。
过氧化氢酶在实验室中还常常被用作了解酶对反应速率影响的工具。