用化学沉淀法去除粗盐中的杂质离子 PPT
- 格式:pptx
- 大小:337.02 KB
- 文档页数:15



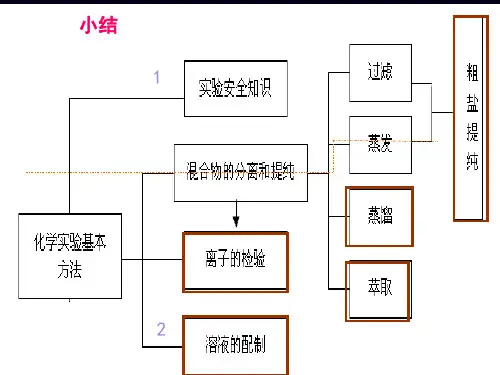
用化学沉淀法去除粗盐中的杂质离子实验目的1.用化学沉淀法去除粗盐中的Ca2+、Mg2+和SO2-4。
2.熟练掌握溶解、过滤、蒸发等操作,认识化学方法在物质分离和提纯中的重要作用。
实验仪器托盘天平、药匙、量筒、烧杯、胶头滴管、滤纸、坩埚钳、铁架台、石棉网、火柴。
除上述仪器外,还需要的仪器有分液漏斗、玻璃棒、漏斗、蒸发皿、酒精灯、坩埚。
实验药品粗盐、蒸馏水、0.1 mol·L-1氯化钡溶液(其作用是除去SO2-4)、20%的氢氧化钠溶液(其作用是除去Mg2+)、饱和碳酸钠溶液(其作用是除去Ca2+、Ba2+等)、6 mol·L-1盐酸、pH试纸。
实验步骤实验步骤实验操作①溶解用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒搅拌,使粗盐溶解,得到粗盐水①沉淀向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使SO2-4、Mg2+、Ca2+、Ba2+完全沉淀析出①过滤将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是引流,滤液呈碱性①中和向滤液中滴加盐酸,用玻璃棒搅拌,直到无气泡冒出,并用pH试纸检验,使滤液呈中性或微酸性①蒸发将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断搅拌。
当蒸发皿中出现较多固体时,停止加热。
利用蒸发皿的余热使滤液蒸干。
冷却后,得到除去杂质离子的精盐实验小组为探究氯气的化学性质做了以下实验,下列说法正确的是( )A .硬质玻璃管中产生白色的烟B .一段时间后,在b 中加入2Na S 溶液无明显现象C .一段时间后,d 中的上层清液可检验出有ClD .c 溶液变红不褪色,体现氯水的酸性 【答案】C【分析】干燥的氯气通入硬质玻璃管中,与Cu 反应生成棕黄色的CuCl 2固体;a 装置内进出气导管都短,起安全瓶作用,可防止倒吸;b 装置内氯气溶于水,得到黄绿色的氯水;c 装置中氯气溶于水生成的盐酸和次氯酸先后与紫色石蕊试液作用,使溶液先变红后褪色;d 装置中氯气与水反应生成盐酸,盐酸与硝酸银反应生成氯化银白色沉淀,上层清液为氯化银的饱和溶液,溶有Cl -;e 装置为尾气处理装置。





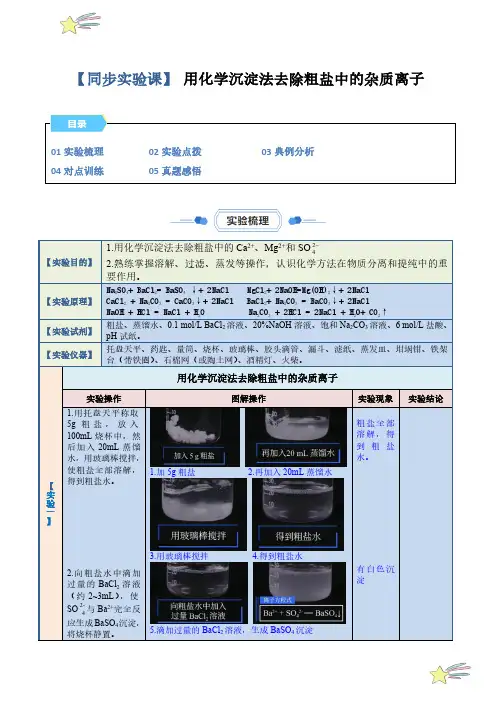
【同步实验课】 用化学沉淀法去除粗盐中的杂质离子水,用玻璃棒搅拌,沉淀,1.加5g 粗盐2.再加入20mL 蒸馏水3.用玻璃棒搅拌4.得到粗盐水5.滴加过量的BaCl 2溶液,生成BaSO 4沉淀6.沿烧杯壁再滴加2~3滴BaCl2溶液。
7.若溶液不出现浑浊,则表明SO2-已沉淀完全48.滴加过量的NaOH溶液,生成Mg(OH)2沉淀9.滴加过量Na2CO3溶液,使Ca2+、Ba2+生成沉淀10.沿烧杯壁再滴加2~3滴NaOH溶液11.若溶液不出现浑浊,则表明Mg2+已沉淀完全12.沿烧杯壁再滴加2~3滴Na2CO3溶液13.若溶液不出现浑浊,表明Ca2+、Ba2+已沉淀完全14.过滤15.向所得滤液中滴加盐酸16.用pH试纸检验,使滤液呈中性或微酸性。
17.将滤液倒入燕发皿中18.用酒精灯加热,用玻璃棒不断搅拌19.余热使滤液蒸干20.得到去除杂质离子的精盐一、问题与讨论:1.本实脸中加入试剂的顺序是什么?按照其他顺序加入试剂能否达到同样的目的?2.为什么每次所加的试剂都要略微过量?第7步加入盐酸的目的是什么?3.第6步和第7步的操作顺序能否颜倒?为什么?4.过滤和蒸发都适用于固体和液体混合物的分离,他们适用的对象一样吗?5.若有两种固体,要使它们分离开来,可以采用什么办法?二、规律与方法:1.粗盐提纯原理为2.除去可溶性杂质的一般思路和方法:(1)选择除杂试剂,依据是将可溶性杂质转化成沉淀、水或气体等易分离的物质,尽可能不引入新杂质;(2)安排试剂的用量(一般过量)和添加顺序,依据是过量的试剂必须靠后面添加的试剂除去。
3.洗涤沉淀的操作:向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复操作2~3次。
不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸。
4.检验沉淀是否洗涤干净的操作:取最后一次洗涤液进行检验(事先要确定沉淀中含有的离子,选择合适的试剂进行检验)。
5.检验沉淀是否完全的方法:取(或向)上层清液中继续滴加原沉淀剂,若无沉淀产生则沉淀完全。
