双原子分子的结构和性质
- 格式:pptx
- 大小:7.35 MB
- 文档页数:67


双原子氧气分子
氧气,我们生活中不可或缺的元素,以双原子分子的形式广泛存在于我们的周围。
其分子式为O2,这种双原子结构赋予氧气独特的化学性质,使它在生物、环境和工业领域都发挥着重要的作用。
一、氧气分子的构造
双原子氧气分子由两个氧原子通过共享电子形成的共价键连接。
这种共价键是氧气分子稳定存在的基础,也使得氧气分子能够参与众多的化学反应。
二、氧气分子的性质
1. 氧化性:氧气分子具有很强的氧化性,可以与许多元素直接化合,生成氧化物。
这种性质使得氧气在生物体的呼吸作用、燃烧过程以及工业生产中都有广泛的应用。
2. 顺磁性:氧气分子是顺磁性的,这意味着它在磁场中会被磁化。
这个特性在物理学和化学研究中都有重要的应用。
三、氧气分子的应用
1. 生物领域:对于人类和其他生物来说,氧气是至关重要的。
我们通过呼吸吸入氧气,然后在细胞内通过氧化磷酸化过程产生能量。
2. 环境领域:氧气在大气中的含量约为21%,对于维持地球生态系统的平衡起着关键作用。
同时,氧气也是臭氧层的重要组成部分,可以吸收太阳紫外线,保护地球生物免受紫外线的伤害。
3. 工业领域:氧气在工业上有广泛的应用,如钢铁冶炼、化工生产、火箭燃料等。
在这些过程中,氧气作为氧化剂参与化学反应,推动生产的进行。
总的来说,双原子氧气分子以其独特的结构和性质,在各个领域都发挥着重要的作用。
它是我们生活中不可或缺的一部分,也是我们理解和探索自然世界的关键元素之一。


同核双原子分子双原子分子是由一个原子核和两个电子构成的。
但是,两个原子核中的电子数目不一定相等。
如氢分子由一个原子核和两个质子构成,而其中的电子数却为三个,即电子层数为三。
但还有一些化合物,它们的两个原子核都是由一个质子和一个中子构成,但它们的电子层数却都为七个。
又如氯分子由一个原子核和三个质子构成,而其中的电子数却为六个,即电子层数为六。
当一个正离子与一个负离子结合时,就会出现多种同核双原子分子。
例如,二氧化硅分子由两个硅原子和一个氧原子构成,但这两个原子核中的电子数目并不相等,其中氧原子有四个电子,硅原子却只有一个电子。
二氧化硅分子由于存在多种同核双原子分子,才使得单晶硅片具有很高的折射率,可以应用于制造光学仪器和电子工业中,还可用于制作防辐射玻璃、 X射线屏幕等。
此外,二氧化硅还能被人们制成大理石和各种装饰品,如普通的文石可做成各种台面。
将精制的文石切磨成很小的薄片,贴到墙上,就变成了精美的壁纸。
把文石晶体掺进玛瑙里,经过加工后,便形成了非常美丽的珠宝——玛瑙珠。
还有,天然放射性铀235的衰变产物三铀氧钒具有“闪闪发光”的奇异色彩,很像黄金,所以又称三铀氧钒为黄金金属,即黄金铀。
一些黄金矿藏、铀矿床或冶炼厂的废水中,常含有大量的黄金铀,工业上可提取黄金,故而常被称为“天然放射性元素”。
此外,其它类似的有关黄金的同核双原子分子还有:铀、钍、镤、铒、铥、镱、镥等。
同样的事例也发生在含有稀有气体元素的化合物中,例如,氙原子的电子层结构为7S2,有3个电子层,所以有3个电子,由于含有稀有气体元素,因此有强烈的放射性,其放射性比镭强15倍。
在放射源中,它是强射线。
稀有气体元素还有氪、氡、氙、氡等,它们都是放射性元素,具有放射性。
虽然由于它们在空气中含量很少,但在人体内累积到一定程度时,仍可引起疾病。
此外,许多稀有气体元素在特定条件下还能够互相转化。
例如,氟有5个价态,即正5价、负5价、正4价、负4价和零价。

2组长:070601314组员:070601313070601315070601344070601345070601352第四章 双原子分子结构与性质1.简述 LCAO-MO 的三个基本原则,其依据是什么?由此可推出共价键应具有什么样的特征?答:1.(1)对称性一致(匹配)原则: φa = φs 而φb = φ pz 时, φs 和φ pz 在σˆ yz 的操作下对称性一致。
故 σˆ yz ⎰φs H ˆφ pz d τ = β s , pz ,所以, β s , pz ≠ 0 ,可以组合成分子轨道(2)最大重叠原则:在 α a 和α b 确定的条件下,要求 β 值越大越好,即要求 S ab 应尽可能的大(3)能量相近原则: 当α a = α b 时,可得 h = β ,c 1a = c 1b , c 1a =- c 1b ,能有效组合成分子轨道;2.共价键具有方向性。
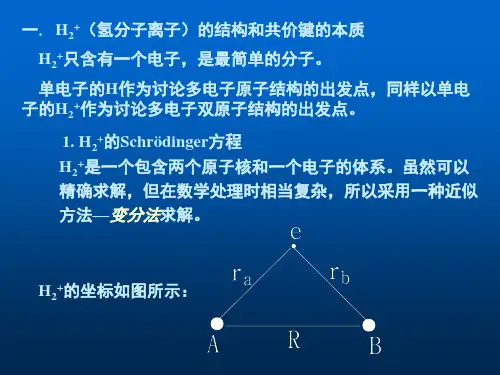
2、以 H 2+为例,讨论共价键的本质。
答:下图给出了原子轨道等值线图。
在二核之间有较大几率振幅,没有节面,而在核间值则较小且存在节面。
从该图还可以看出,分子轨道不是原子轨道电子云的简单的加和,而是发生了波的叠加和强烈的干涉作用。
图 4.1 H + 的 ψ 1(a)和 ψ 2(b)的等值线图研究表明,采用 LCAO-MO 法处理 H 2+是成功的,反映了原子间形成共价键 的本质。
但由计算的得到的 Re=132pm ,De=170.8kJ/mol ,与实验测定值Re=106pm、De=269.0 kJ/mol 还有较大差别,要求精确解,还需改进。
所以上处理方法被称为简单分子轨道法。
当更精确的进行线性变分法处理,得到的最佳结果为Re=105.8pm、De=268.8 kJ/mol,十分接近H2+的实际状态。
成键后电子云向核和核间集中,被形象的称为电子桥。
通过以上讨论,我们看到,当二个原子相互接近时,由于原子轨道间的叠加,产生强烈的干涉作用,使核间电子密度增大。

结构化学双原子分子结构双原子分子结构是指由两个原子构成的分子。
这种分子结构是化学中最简单的一种,但也是最基础的一种。
在双原子分子结构中,两个原子之间的化学键通常是共价键。
这种共享电子对形成了原子之间的化学键,使得分子能够保持稳定状态。
双原子分子结构的研究对于了解化学键和分子结构的性质具有重要意义。
最常见的双原子分子结构是氢分子(H2),由两个氢原子共享一个电子对形成共价键。
氢分子是最简单的分子,也是宇宙中最常见的分子之一、它的分子式为H2,由两个氢原子通过共价键连接在一起。
氢分子的形成是通过两个氢原子中的一个原子的一个电子迁移到另一个原子的空轨道上,形成一个共享的电子对。
这个共享的电子对使得氢分子能够保持稳定状态。
另一个重要的双原子分子结构是氧分子(O2),由两个氧原子共享两个电子对形成共价键。
氧分子是地球大气中的主要成分之一,也是生命的关键分子之一、它的分子式为O2,由两个氧原子通过共价键连接在一起。
氧分子的形成是通过两个氧原子中的每个原子的两个电子迁移到另一个原子的空轨道上,形成两个共享的电子对。
这两个共享的电子对使得氧分子能够保持稳定状态。
除了氢分子和氧分子,还有许多其他双原子分子结构,如氮分子(N2),氟分子(F2),氯分子(Cl2)等。
这些分子的形成原理与氢分子和氧分子类似,都是通过共享电子对形成稳定的化学键。
在双原子分子结构中,化学键的强度和键长是两个重要的性质。
化学键的强度取决于原子之间共享的电子对的数量和电子云的交互作用。
一般来说,共享电子对的数量越多,化学键越强。
键长是指两个原子之间的距离,它的长度取决于原子半径和化学键的强度。
一般来说,化学键越强,键长越短。
双原子分子结构在化学中有着广泛的应用。
它们在化学反应中起着关键的作用,能够通过键的形成和断裂改变分子的性质。
通过研究双原子分子结构,可以了解化学键的性质和分子的结构,从而为其他复杂分子的研究提供基础。
此外,双原子分子结构在材料科学、化学工程和生物化学等领域也有着重要的应用。

双原子分子的结构双原子分子是由两个原子组成的分子。
这些分子可以是同一种类型的原子,也可以是两种不同种类的原子。
在化学和物理学中,研究双原子分子的结构和性质是非常重要的。
双原子分子的结构可以使用带电的球体模型来描述。
一个带电的球体代表原子的正电荷核心和周围的负电子云。
在一对双原子分子中,两个原子之间通过共享电子而相互吸引。
由于双原子分子中只有两个原子,因此它们的结构比较简单。
主要有两种类型的双原子分子结构:线性和非线性。
线性类型的双原子分子是指两个原子组成的分子在平衡位置时处于一条直线上。
这些分子的最简单例子是氧气(O2)和氮气(N2)。
比较而言,非线性双原子分子是指由两个原子组成的分子不在一条直线上。
其中最常见的非线性分子是水(H2O)和二氧化碳(CO2)。
线性双原子分子的结构非常简单。
在这些分子中,两个原子之间的距离是相等的。
这种分子的结构描述通常包括键长(L)和键角(θ)。
键长是指原子核之间的距离,它测量的是两个原子之间的距离。
键角是指两个相邻键的方向之间的夹角,它描述了分子的几何构型。
对于线性分子,键角为180度。
非线性双原子分子的结构要复杂一些。
对于这些分子,键长和键角的测量方法也是不同的。
对于非线性双原子分子,键长是平均距离,因为原子核之间的距离在分子中会变化。
而键角的测量则需要考虑到分子的几何构型。
水分子的结构是一个典型的非线性双原子分子。
当两个氢原子与氧原子结合时,分子的几何构型呈V字形。
分子中存在的氢键使得分子在水相中具有许多独特的性质。
这些性质包括高的表面张力和卓越的溶解性。
二氧化碳(CO2)也是一个非线性双原子分子。
但与水不同的是,二氧化碳是一种线性三角形分子。
根据量子力学的计算,氧原子和碳原子之间的键长约为1.1625埃,而氧原子和中央的C-O键角约为180度。
总之,双原子分子的结构和性质对于化学和物理学的研究非常重要。
无论是线性还是非线性,双原子分子都具有自身独特的结构和性质,这些结构和性质使我们更好地理解分子之间相互作用的原理。



双原子分子在化学领域中,双原子分子是指由两个原子组成的分子。
这些原子可以是相同元素的原子,也可以是不同元素的原子。
双原子分子在自然界中广泛存在,具有重要的化学和物理性质。
本文将介绍双原子分子的形成、性质和应用。
形成双原子分子的形成涉及原子间的化学键结合。
当两个原子接近到一定距离时,它们之间会发生相互作用,形成化学键。
这种化学键可以是共价键、离子键或金属键。
在双原子分子中,最常见的是共价键,其中两个原子共享电子对。
根据原子间的相互吸引力和排斥力,双原子分子的几何构型可以是线性、角型或扭曲型。
性质双原子分子的性质取决于其组成原子的种类和结合方式。
一般来说,具有相同元素的双原子分子(如氧气、氮气)具有相似的化学性质,而由不同原子组成的双原子分子(如氯化氢、氮氧化合物)则具有更多多样性。
双原子分子的物理性质也受到影响,如分子大小、极性、电荷分布等。
双原子分子在化学反应中发挥重要作用。
它们参与了许多基础化学过程,如氧化还原反应、酸碱中和反应等。
另外,一些双原子分子在生物体系中也具有重要地位,如二氧化碳在植物光合作用中的作用。
应用双原子分子在化工、材料科学、生命科学等领域具有广泛的应用。
例如,氧气作为氧化剂参与燃烧反应;氧分子在医学领域应用于氧疗;氯化氢用于化学反应的催化剂等。
双原子分子的研究也有助于深入了解化学键的性质和分子结构。
总的来说,双原子分子作为化学界中最基本的分子单位之一,对于我们理解自然界的化学现象和开发新材料具有重要意义。
通过深入研究双原子分子的结构和性质,我们可以更好地利用其在各个领域的应用潜力。
以上是关于双原子分子的一些基本介绍,希望能对读者对此类分子有更深入的了解和兴趣。
第三章双原子分子的结构和性质习题第三章共价键和双原子分子的结构习题一、是非题1.在LCAO-MO 中,所谓对称性匹配就是指两个原子轨道的位相相同。
2.两个能量不同的原子轨道线性组合成两个分子轨道。
在能量较低的分子轨道中,能量较低的原子轨道贡献较大;在能量较高的分子轨道中,能量较高的原子轨道贡献较大。
3.凡是成键轨道都具有中心对称性。
二、填空题1.描述分子中_______________空间运动状态的波函数称为分子轨道。
2.由原子轨道有效地形成分子轨道的条件为。
3.设φA 和φB 分别是两个不同原子A 和B 的原子轨道,其对应的原子轨道能量为E A 和E B ,如果两者满足________,____________,______原则可线性组合成分子轨道=c A φA +c B φB 。
对于成键轨道,如果E A ______E B ,则c A ______c B 。
(注:后二个空只需填"=",">"或"等比较符号)4.C 2+的分子轨道为_________________,键级___________________;5.按照简单分子轨道理论:(1)HF 分子基组态电子排布为___________________________,键级_______________,磁性________________。
(2)O 2-离子基组态电子排布为_____________________________,键级_______________,磁性________________。
6.写出CN -的价电子组态及键级。
7.下列分子中,键能比其正离子的键能小的是____________________。
键能比其负离子的键能小的是________________________。
O 2,NO ,CN ,C 2,F 28.O 2的键能比O 2+的键能_____________。
C2分子结构概要C2分子是指由两个碳原子组成的分子,属于双原子分子的一种,具有线性分子结构。
每个碳原子通过一个σ键和三个σ键形成的共价键连接在一起,形成单键。
这两个碳原子之间的距离为1.242埃。
C2分子的总价电子数为12,每个碳原子贡献6个价电子。
C2分子的线性结构使得它具有高度对称性。
C2分子中的两个碳原子和两个相邻的氢原子的轨道杂化为sp杂化,形成了两组σ键。
每个碳原子的sp杂化将三个sp3杂化轨道与一个原子轨道混合,形成四个等能的sp3混合轨道,其中一个用来形成σ键与另一个碳原子的sp3轨道重叠,形成σ键。
另外两个sp3轨道与两个氢原子的1s轨道叠加形成σ键。
这样,C2分子中共有四个σ键。
除了σ键之外,C2分子还存在一个π键。
π键通过两个共面的p轨道重叠形成。
C2分子中每个碳原子的一个p轨道没有参与杂化,保持了原子的p轨道。
这两个p轨道相互平行,并且位于两个碳原子的中心轴上,并与σ键共面。
这两个p轨道之间的叠加形成了一个π键。
C2分子的生成与裂解是由于C-C键的形成和断裂。
对于生成C2分子,反应通常是通过两个碳原子的热激发或电子激发进行的。
而对于裂解C2分子,则需要提供足够的能量来克服C-C键的结合能。
由于C2分子的高度对称性,它具有许多特殊的性质和应用。
C2分子是一种非自由离子分子,因为它不带电,但在外电场中会呈现电偶极矩。
这使得C2分子具有在强电场中发生极化的能力,从而增加了其与其他分子之间相互作用的可能性。
C2分子的电偶极矩也使得它在传感器和电子器件中具有一定的应用价值。
此外,C2分子还具有一些反常的性质。
例如,C2分子的化学活性相对较高,可以发生多种与其他物质的反应。
C2分子的化学性质受外界因素的影响较大,如温度、压力等,可以与氢、氧、氮等元素形成化合物。
总之,C2分子是由两个碳原子通过四个σ键和一个π键相连接而成的分子,具有线性结构和高度对称性。
C2分子的形成和裂解可以通过外界激发和能量提供来实现。
2组长:070601314 组员:070601313070601315 070601344 070601345070601352第四章 双原子分子结构与性质1.简述 LCAO-MO 的三个基本原则,其依据是什么?由此可推出共价键应具有什么样的特征?答:1.(1)对称性一致(匹配)原则: φa = φs 而φb = φ pz 时, φs 和φ pz 在σˆ yz 的操作下对称性一致。
故 σˆ yz ⎰φs H ˆφ pz d τ = β s , pz ,所以, β s , pz ≠ 0 ,可以组合成分子轨道(2)最大重叠原则:在 α a 和α b 确定的条件下,要求 β 值越大越好,即要求 S ab 应尽可能的大(3)能量相近原则: 当α a = α b 时,可得 h = β ,c 1a = c 1b , c 1a =- c 1b ,能有效组合成分子轨道;2.共价键具有方向性。
2、以 H 2+为例,讨论共价键的本质。
答:下图给出了原子轨道等值线图。
在二核之间有较大几率振幅,没有节面,而在核间值则较小且存在节面。
从该图还可以看出,分子轨道不是原子轨道电 子云的简单的加和,而是发生了波的叠加和强烈的干涉作用。
图 4.1 H +的 ψ 1(a)和 ψ 2(b)的等值线图研究表明,采用 LCAO-MO 法处理 H 2+是成功的,反映了原子间形成共价键的本质。
但由计算的得到的Re=132pm,De=170.8kJ/mol,与实验测定值Re=106pm、De=269.0 kJ/mol 还有较大差别,要求精确解,还需改进。
所以上处理方法被称为简单分子轨道法。
当更精确的进行线性变分法处理,得到的最佳结果为Re=105.8pm、De=268.8 kJ/mol,十分接近H2+的实际状态。
成键后电子云向核和核间集中,被形象的称为电子桥。
通过以上讨论,我们看到,当二个原子相互接近时,由于原子轨道间的叠加,产生强烈的干涉作用,使核间电子密度增大。