多克隆抗体的制备及抗体效价测定教案
- 格式:ppt
- 大小:2.40 MB
- 文档页数:50

多克隆抗体制备多抗一般制备流程:完全抗原的准备→兔子的免疫→效价检测和终放→抗体亲和纯化→抗体的浓缩和保存。
【晶莱生物】具体实验步骤如下:1.兔子的准备挑选健康的6周大小的新西兰大白兔两只(约2Kg),使其适应新的生活环境,至少稳定几天再进行首次取血.预采血(作阴性参照用)1.1 将兔子小心的放入固定的架中,使兔子平静;1.2小心剃去兔耳上的毛以使血管清晰可见(也可不剃);1.3如果有必要,可用小棉球沾酒精涂抹血管部位,使血管膨胀;1.4用注射器从耳静脉抽取约10ml血液(约5ml血清);1.5小心抽出针头,适当按压伤口以免流血,然后用酒精棉球消毒伤口;1.6将收集的血液置于37`C灭活30min,最后置于4`C过夜使其凝结释放血清;1.7将凝结好的血液在10000r/min离心10min; h.收集上清,即为血清。
2. 兔子的免疫2.1注射两只兔子的抗原为1ml,抗原缓冲溶液必须不含对兔子有害的化学试剂.每只兔子初次免疫400ug抗原比较适合,也可适当减少以获得更好的结果,后续免疫每次为100ug即可。
2.2 将1ml的佛氏完全佐剂与准备好的1ml抗原充分混匀,呈乳白色;2.3 小心从笼中取出兔子,每只兔子免疫4个部位(背部和大腿根部均可),每个部位250ul,针头呈45度角插入皮下1-2cm,注射完后停留数秒以防止抗原外流。
2.4 免疫周期为20天,免疫完后7-10天取血(包括中途测试取血和最终放血),总共免疫4-5次。
3.效价检测3.1 2个参照:阴性参照为预取血血清,均以1抗起始浓度稀释(封闭稀释液);阳性参照为以前阳性血清3.2 于96孔板中每孔滴加100ul,1ug/ml抗原,于4℃过夜,也可以37℃孵育2小时。
3.3倒掉抗原溶液,每孔加入200ul的封闭液,4℃过夜或者37℃孵育2小时。
3.4倒去封闭液,在吸水纸上拍打尽量吸干残留液体,用洗涤液洗板三次,每次尽量拍干残留液体,若要放置一段时间, 37℃烘干并用封口袋封好于-20℃存放。

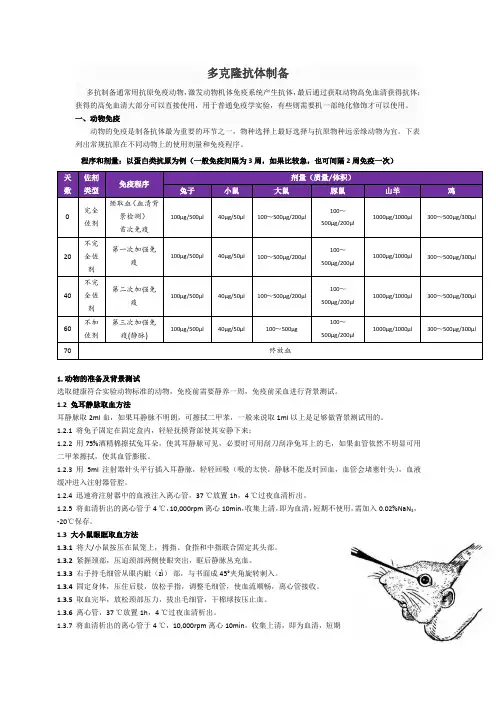
多克隆抗体制备多抗制备通常用抗原免疫动物,激发动物机体免疫系统产生抗体,最后通过获取动物高免血清获得抗体;获得的高免血清大部分可以直接使用,用于普通免疫学实验,有些则需要机一部纯化修饰才可以使用。
一、动物免疫动物的免疫是制备抗体最为重要的环节之一,物种选择上最好选择与抗原物种远亲缘动物为宜。
下表列出常规抗原在不同动物上的使用剂量和免疫程序。
程序和剂量:以蛋白类抗原为例(一般免疫间隔为3周,如果比较急,也可间隔2周免疫一次)天数佐剂类型免疫程序剂量(质量/体积)兔子小鼠大鼠豚鼠山羊鸡0 完全佐剂预取血(血清背景检测)首次免疫100μg/500μl40μg/50μl100~500μg/200μl100~500μg/200μl1000μg/1000μl300~500μg/300μl20 不完全佐剂第一次加强免疫100μg/500μl40μg/50μl100~500μg/200μl100~500μg/200μl1000μg/1000μl300~500μg/300μl40 不完全佐剂第二次加强免疫100μg/500μl40μg/50μl100~500μg/200μl100~500μg/200μl1000μg/1000μl300~500μg/300μl60 不加佐剂第三次加强免疫(静脉)100μg/500μl40μg/50μl100~500μg100~500μg/200μl1000μg/1000μl300~500μg/300μl70 终放血1.动物的准备及背景测试选取健康符合实验动物标准的动物,免疫前需要静养一周,免疫前采血进行背景测试。
1.2 兔耳静脉取血方法耳静脉取2ml血,如果耳静脉不明朗,可擦拭二甲苯,一般来说取1ml以上是足够做背景测试用的。
1.2.1 将兔子固定在固定盒内,轻轻抚摸背部使其安静下来;1.2.2 用75%酒精棉擦拭兔耳朵,使其耳静脉可见,必要时可用刮刀刮净兔耳上的毛,如果血管依然不明显可用二甲苯擦拭,使其血管膨胀。


![多克隆抗体的制备[1]](https://uimg.taocdn.com/e1ba29e00242a8956bece4b5.webp)
多克隆抗体的制备1. 器材:剪刀(剪兔毛用)一把、弯头眼科手术镊子(游离血管用)一把、直头眼科手术剪(剪血管用)一把,手术刀架,手术刀片,注射器(1ml、10ml,25ml)附针头,兔子固定架,灭菌三角烧瓶(200ml)或平皿(直径18cm)、弯头止血钳四把,直头止血钳两把,手术缝合线,塑料放血管,纱布等。
2. 试剂:生理盐水(或PBS),弗氏完全佐剂(Freund’s complete adjuvant, FCA) Sigma F-5881,弗氏不完全佐剂(Freund’s incomplete adjuvant, FIA) Sigma F-5506,二甲苯,酒精棉,脱脂棉,2% NaN33. 兔子的选择:兔子的重量应在四斤以上,两耳光滑,明显可见耳静、动脉,健康。
4. Pre-bleeding:抗原注射以前需要收集一些正常血清,已备检测抗体时作为阴性对照。
待兔子在新环境中稳定,大概需要四天左右时间,可以进行耳动脉取血。
取血量约5ml足矣。
免疫用的抗原必须纯化,否则影响抗体的质量。
抗原经FCA或FIA充分乳化后才能注射。
将抗原液与佐剂等比例混合后,置于混合器上使之剧烈振荡使抗原充分乳化,乳化过程比较费时、费力,但若乳化不充分,会影响免疫的效果,振荡后,1000rpm离心一分钟,如水相和油相不分层即可注射。
首次免疫用FCA,以后都用FIA。
免疫方法可采用背部多点注射法。
即于家兔脊柱两旁选4-6点皮下注射,每点注0.1ml,间隔2周后再于上述部位选不同点注射(不要选择临近位点,否则溃疡愈合不好)。
每次免疫的抗原量约100μg。
免疫次数在四五次即可,抗原用量大可以减少次数。
免疫一周后,可以耳动脉取血检测抗体效价。
因为起初几次免疫产生的抗体的效价比较低,头两次取血,够检测用即可。
在三次免疫后,可以获得较高效价的抗体,每次取血量可以在40ml,不要取太多,否则会造成兔子贫血。
最后一次取血可以采用颈动脉放血,具体操作如下:a.家兔仰卧于兔架上固定头部,用纱布固定四肢。
实验九 多克隆抗体的制备,纯化及免疫电泳【实验目的】⒈ 加深对抗体基本知识的了解。
⒉ 了解多克隆抗体的制备及纯化的基本方法。
⒊ 了解免疫电泳的基本过程和实验依据。
一、多克隆抗体的制备【实验原理】当将抗原注射入实验动物体内时,一系列抗体生成细胞会不同程度的与抗原结合,受抗原刺激后在血液中产生不同类型的抗体,这种由一种抗原刺激产生的抗体称为多克隆抗体。
多克隆抗体中不同的抗体分子可以以不同的亲和能力与抗原分子表面不同的部分—抗原决定簇相结合。
将抗原导入敏感动物体内后,可刺激网状内皮细胞系统,尤其是淋巴结和脾脏中的淋巴细胞大量增殖。
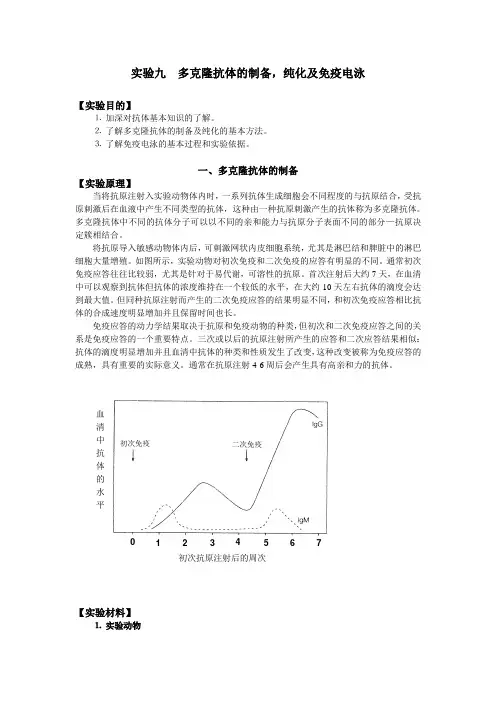
如图所示,实验动物对初次免疫和二次免疫的应答有明显的不同。
通常初次免疫应答往往比较弱,尤其是针对于易代谢,可溶性的抗原。
首次注射后大约7天,在血清中可以观察到抗体但抗体的浓度维持在一个较低的水平,在大约10天左右抗体的滴度会达到最大值。
但同种抗原注射而产生的二次免疫应答的结果明显不同,和初次免疫应答相比抗体的合成速度明显增加并且保留时间也长。
免疫应答的动力学结果取决于抗原和免疫动物的种类,但初次和二次免疫应答之间的关系是免疫应答的一个重要特点。
三次或以后的抗原注射所产生的应答和二次应答结果相似:抗体的滴度明显增加并且血清中抗体的种类和性质发生了改变,这种改变被称为免疫应答的成熟,具有重要的实际意义。
通常在抗原注射4-6周后会产生具有高亲和力的抗体。
【实验材料】⒈ 实验动物初次抗原注射后的周次0 1 2 3 4 5 6 7初次免疫 二次免疫血清中抗体的水平成年兔。
⒉实验器材特制兔盒;刀片;25G针头;1ml注射器;20 ml 血液收集管;药铲;离心机以及塑料离心管;加样器及加样管;烧杯。
⒊实验试剂⑴抗原;乙醇;20mM 磷酸缓冲溶液pH7.2。
⑵福氏完全佐剂和福氏不完全佐剂:【实验方法】⒈抗原的制备抗原制备的主要目的在于在免疫动物体内产生最强、最适当的抗体。
由于纯化的抗原适合产生抗体,因此在注射前通常采用一些经典的方法,比如柱层析、分级萃取、亚细胞分离等进行抗原的分离和纯化。




多克隆抗体的制备1.蛋白纯化:重组蛋白表达形式为包涵体时,可通过切胶进行蛋白纯化。
表达重组蛋白的细菌(200ml菌液为例)4500r/min离心20min,菌体沉淀用15ml PBS 悬起,4500r/min离心15min,共清洗3次。
沉淀用4ml PBS悬起,通过超声处理进行裂解。
超声条件为超声时间3s,间隔3s,全程时间为30min,4℃(置于冰水混合物中),功率为400W。
超声后10000r/min离心5min,沉淀用500µl PBS悬起,后加入400µl 2×SDS凝胶加样缓冲液、100µl DTT混合,立即加入沸水中煮10min。
将500µl 处理后样品进行SDS聚丙烯酰胺凝胶电泳(每块凝胶加入500µl 样品)。
凝胶用H2O、PBS清洗后,将凝胶放入预冷的0.25M KCl中显色(或低温显色)30s左右,可见不同位置出现白色的蛋白条带。
将目的蛋白位置的凝胶条切下(尽量避免同时切下其他蛋白条带),PBS(预冷)清洗后,将胶条碾碎放入EP管中(大约占1/2),加入PBS 浸没胶粒(PBS加入量控制在可使胶粒完全溶于其中,上下颠倒可缓慢流动)。
反复冻融3次,10000r/min离心3min,吸取的上清即为纯化后蛋白(可多次离心后小心吸取上清,避免吸到胶粒)。
取纯化后蛋白进行SDS-PAGE电泳,鉴定蛋白的纯化度并测定其浓度。
纯化蛋白置于4℃短暂保存。
2.蛋白复性将纯化蛋白置于已处理的透析袋中(透析袋于2% NaHCO3中煮沸10min,H2O冲洗后于1mM EDTA中煮沸10min,可于4℃1mM EDTA保存),放入复性液(配方:20mM Tris-HCl pH 8.0;0.1mM氧化型谷胱甘肽;0.9mM还原型谷胱甘肽)中,4℃作用1h。
更换复性液,4℃作用2h。
再放入TE缓冲液(配方:10mM Tris-HCl;1mM EDTA pH8.0)中,4℃作用2h或过夜。
泰实验九 多克隆抗体的制备,纯化及免疫电泳【实验目的】⒈ 加深对抗体基本知识的了解。
⒉ 了解多克隆抗体的制备及纯化的基本方法。
⒊ 了解免疫电泳的基本过程和实验依据。
一、多克隆抗体的制备【实验原理】当将抗原注射入实验动物体内时,一系列抗体生成细胞会不同程度的与抗原结合,受抗原刺激后在血液中产生不同类型的抗体,这种由一种抗原刺激产生的抗体称为多克隆抗体。
多克隆抗体中不同的抗体分子可以以不同的亲和能力与抗原分子表面不同的部分—抗原决定簇相结合。
将抗原导入敏感动物体内后,可刺激网状内皮细胞系统,尤其是淋巴结和脾脏中的淋巴细胞大量增殖。
如图所示,实验动物对初次免疫和二次免疫的应答有明显的不同。
通常初次免疫应答往往比较弱,尤其是针对于易代谢,可溶性的抗原。
首次注射后大约7天,在血清中可以观察到抗体但抗体的浓度维持在一个较低的水平,在大约10天左右抗体的滴度会达到最大值。
但同种抗原注射而产生的二次免疫应答的结果明显不同,和初次免疫应答相比抗体的合成速度明显增加并且保留时间也长。
免疫应答的动力学结果取决于抗原和免疫动物的种类,但初次和二次免疫应答之间的关系是免疫应答的一个重要特点。
三次或以后的抗原注射所产生的应答和二次应答结果相似:抗体的滴度明显增加并且血清中抗体的种类和性质发生了改变,这种改变被称为免疫应答的成熟,具有重要的实际意义。
通常在抗原注射4-6周后会产生具有高亲和力的抗体。
【实验材料】⒈ 实验动物初次抗原注射后的周次0 1 2 3 4 5 6 7初次免疫 二次免疫血清中抗体的水平成年兔。
⒉实验器材特制兔盒;刀片;25G针头;1ml注射器;20 ml 血液收集管;药铲;离心机以及塑料离心管;加样器及加样管;烧杯。
⒊实验试剂⑴抗原;乙醇;20mM 磷酸缓冲溶液pH7.2。
⑵福氏完全佐剂和福氏不完全佐剂:【实验方法】⒈抗原的制备抗原制备的主要目的在于在免疫动物体内产生最强、最适当的抗体。
由于纯化的抗原适合产生抗体,因此在注射前通常采用一些经典的方法,比如柱层析、分级萃取、亚细胞分离等进行抗原的分离和纯化。
实验一多克隆抗体的制备(可溶性抗原)上海师范大学实验报告专业、年级生物科学班级姓名学号课程名称免疫学实验名称多克隆抗体的制备(可溶性抗原)实验日期基本原理免疫动物是通过给待免疫的动物注射抗原,使其获得相应的抗体的过程。
抗原给予的方法不仅对免疫应答的起始有较大影响,而且决定着对新注射抗原的免疫吞噬和吞噬后加工处理的细胞类型,并影响对其发生免疫应答的外周淋巴器官。
材料(一)动物:健康雄性家兔2只(二)器材:剪刀、镊子、注射器(2ml、50ml)附针头(9号、6号)、称量瓶(10ml)、量筒、动物固定架、灭菌三角烧瓶(200ml)、手术器械一套、血管夹、黑丝线、塑料放血管等。
(三)试剂1.灭菌生理盐水;2.纯化人IgG(10mg/ml);3.消毒酒精及碘酒;4.弗氏不完全佐剂(FCA)5.弗氏完全佐剂(FIA)6.弗氏完全佐剂乳化抗原(FCA-IgG)的制备:吸2ml FCA于研钵中,逐滴加入1mg/ml 纯化人IgG 1 ml,边滴入边研磨直至形成均一性的乳状液,取1滴滴于冷水面上不散开为合格。
7. 弗氏不完全佐剂乳化抗原(FIA-IgG)的制备:吸2ml FIA于研钵中,逐滴加入1mg/ml纯化人IgG 1 ml,边滴入边研磨直至形成均一性的乳状液,取1滴滴于冷水面上不散开为合格。
免疫方法1.用剪刀剪去家兔两后脚掌的部分毛,以酒精及碘酒消毒皮肤;2.第一次免疫: 用2ml注射器吸取弗氏完全佐剂(FCA)乳化的抗原(人IgG)下称FCA-IgG)液1ml,每侧脚掌皮下各注入0.5ml。
3.第二次免疫:间隔14天后,于两侧腘窝及鼠蹊部肿大的淋巴结内注入FIA-IgG,每个淋巴结注0.1ml,其余注入淋巴结附近皮下共1ml。
如淋巴结未肿大或肿大不明显时,直接注入两侧腘窝及鼠蹊部皮下。
4.间隔10天后,从耳静脉采血0.5~1.0ml,分离血清,以双相琼脂扩散试验测定免疫血清的抗体效价(即试血)。
效价至少应达到1∶16以上时才能放血。
第1篇一、实验目的1. 学习多克隆抗体的制备方法;2. 掌握多克隆抗体的纯化、鉴定及效价检测技术;3. 熟悉多克隆抗体的应用。
二、实验原理多克隆抗体是由多个B细胞克隆产生的抗体,具有特异性强、亲和力高、产量高等特点。
多克隆抗体制备过程主要包括抗原免疫、抗体提取、纯化、鉴定及效价检测等步骤。
三、实验材料1. 实验动物:小鼠(6周龄);2. 抗原:目的蛋白;3. 试剂:免疫球蛋白G(IgG)亲和层析柱、蛋白纯化试剂盒、SDS-PAGE凝胶、Western Blot试剂盒、酶标仪、凝胶成像系统等;4. 仪器:离心机、PCR仪、电泳仪、Western Blot仪、酶标仪等。
四、实验方法1. 抗原免疫(1)取抗原溶液,加入等体积的福氏完全佐剂,混匀;(2)将混合液注射入小鼠腹腔,免疫剂量根据抗原量和小鼠体重确定;(3)免疫后第2周,重复注射抗原和福氏不完全佐剂,加强免疫;(4)免疫后第3周,采集小鼠血清,进行抗体效价检测。
2. 抗体提取(1)将小鼠血清与蛋白提取缓冲液(pH 7.4)按1:4比例混合;(2)4℃条件下,以15000 rpm离心30分钟,收集上清液;(3)上清液经0.22μm滤膜过滤,得到抗体溶液。
3. 抗体纯化(1)将抗体溶液加入IgG亲和层析柱;(2)用蛋白纯化试剂盒进行梯度洗脱,收集抗体峰;(3)将抗体峰浓缩至适当体积,得到纯化抗体。
4. 抗体鉴定(1)SDS-PAGE电泳:将纯化抗体样品与标准蛋白进行SDS-PAGE电泳,比较分子量;(2)Western Blot:将纯化抗体样品与目的蛋白进行Western Blot检测,观察抗体特异性。
5. 抗体效价检测(1)将抗原溶液与纯化抗体溶液按一定比例混合;(2)加入底物溶液,酶标仪检测吸光度值;(3)根据吸光度值,计算抗体效价。
五、实验结果1. 抗原免疫:小鼠在免疫后第3周,血清抗体效价达到最高值。
2. 抗体提取:纯化抗体溶液经SDS-PAGE电泳,分子量与目的蛋白一致。