一、钠的性质
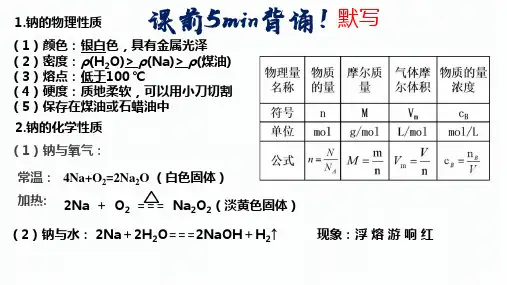
(一)钠的物理性质
钠是 银白 色金属,具有金属光泽, 质地 柔软 ,可用刀切割,密度 小 , 熔点
低
,是热和电的 良导体
。
利用钠的导电性和 低熔点,在科技研究 中有何应用?
钠钾合金为液体, 用于中子反应堆 的热交换剂
(二)钠的化学性质
易失电子,强还原性
化学性质活泼
1.与氧气反应:
常温:
热稳定性 盐酸
碳酸
稳定
Na2CO3+2HCl= 2NaCl+H2O+CO2↑ Na2CO3+ H2O+CO2= 2NaHCO3
与 酸
碱性
碱性较强Na2CO3 > NaHCO3弱碱性
名称 Na2CO3 碳酸钠 与氯化钙反 有沉淀 应
NaOH 不能反应
NaHCO3碳酸氢钠 有沉淀
NaHCO3+NaOH=Na2CO3+H2O
5、31.2gNa2O2与一定量的CO2作用后,质量增加到36.8g,吸 收的CO2在标准状况下的体积是 A.4.5L B.3.3L C.2.2L D.1.1L
目标检测 钠及其化合物 1、关注钠及其化合物在生产、生活中的应用
(1)钠的用途:钠与钾的合金用于原子反应堆的热 交换剂,充入钠蒸气的高压钠灯用于道路和广场的 照明。 (2)Na2CO3的用途:在玻璃、肥皂、食品等工业 中有着广泛的应用,热的纯碱溶液可用于除去物品 表面的油污。
• 1.⑴把CO2通入足量的NaOH溶液中,反应的离子方程式为 ___________________; • ⑵若在上述溶液中继续通入CO2直到过量,则发现有细小晶体析出, 发生反应的化学方程式为___________________;