化工热力学 第3章例题
- 格式:doc
- 大小:51.00 KB
- 文档页数:2

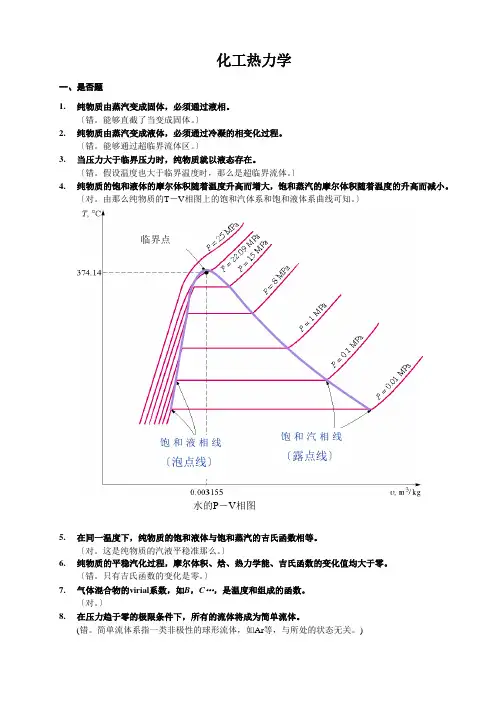
化工热力学一、是否题1. 纯物质由蒸汽变成固体,必须通过液相。
〔错。
能够直截了当变成固体。
〕2. 纯物质由蒸汽变成液体,必须通过冷凝的相变化过程。
〔错。
能够通过超临界流体区。
〕3. 当压力大于临界压力时,纯物质就以液态存在。
〔错。
假设温度也大于临界温度时,那么是超临界流体。
〕4. 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸汽的摩尔体积随着温度的升高而减小。
〔对。
由那么纯物质的T -V 相图上的饱和汽体系和饱和液体系曲线可知。
〕5. 在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。
〔对。
这是纯物质的汽液平稳准那么。
〕6. 纯物质的平稳汽化过程,摩尔体积、焓、热力学能、吉氏函数的变化值均大于零。
〔错。
只有吉氏函数的变化是零。
〕 7. 气体混合物的virial 系数,如B ,C …,是温度和组成的函数。
〔对。
〕8. 在压力趋于零的极限条件下,所有的流体将成为简单流体。
(错。
简单流体系指一类非极性的球形流体,如Ar 等,与所处的状态无关。
)饱和液相线〔泡点线〕饱和汽相线〔露点线〕水的P -V 相图 临界点二、选择题1. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,那么气体的状态为〔 〕(C 。
参考P -V 图上的亚临界等温线。
)A. 饱和蒸汽B. 超临界流体C. 过热蒸汽2. T 温度下的过冷纯液体的压力P〔A 。
参考P -V 图上的亚临界等温线。
〕 3. T 温度下的过热纯蒸汽的压力P〔B 。
参考P -V 图上的亚临界等温线。
〕 4. 纯物质的第二virial 系数B〔A 。
virial 系数表示了分子间的相互作用,仅是温度的函数。
〕5. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到〔A 。
要表示出等温线在临界点的拐点特点,要求关于V 的立方型方程〕 6. 关于纯物质,一定温度下的泡点压力与露点压力是 (A) A 相同的 B 不同的7. 关于纯物质,一定温度下泡点与露点,在P -T 图上是 (A) A 重叠的 B 分开的8. 关于纯物质,一定温度下泡点与露点,在P-V 图上是 (B) A 重叠的 B 分开的 9. 泡点的轨迹称为 (A) A 饱和液相线 B 饱和汽相线 10. 露点的轨迹称为 (B) A 饱和液相线 B 饱和汽相线 11. 关于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii jik a a yy a 中的相互作用参数k ij ,i =j 时,其值 (A)A 为1B 为0C 从实验数据拟合得到,在没有实验数据时,近似作零处理A. >()T P sB. <()T P sC. =()T P sA. >()T P sB. <()T P sC. =()T P sA 仅是T 的函数B 是T 和P 的函数C 是T 和V 的函数D 是任何两强度性质的函数A. 第三virial 系数B. 第二virial 系数C. 无穷项D. 只需要理想气体方程纯物质的P -V 相图P C V C12. 关于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii jik a a yy a 中的相互作用参数k ij ,i ≠j 时,其值 ( C )A 为1B 为0C 从实验数据拟合得到,在没有实验数据时,近似作零处理 三、运算题1. 由饱和蒸汽压方程,在合适的假设下估算水在25℃时的汽化焓。

化工热力学课后答案(填空、判断、画图)第1章 绪言一、是否题1. 封闭体系的体积为一常数。
(错)2. 封闭体系中有两个相βα,。
在尚未达到平衡时,βα,两个相都是均相敞开体系;达到平衡时,则βα,两个相都等价于均相封闭体系。
(对) 3. 理想气体的焓和热容仅是温度的函数。
(对)4. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T 1和T 2,则该过程的⎰=21T T V dT C U ∆;同样,对于初、终态压力相等的过程有⎰=21T T P dT C H ∆。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)二、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。
2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的功为()f i rev V V RT W ln =(以V 表示)或()i f rev P P RT W ln = (以P 表示)。
3. 封闭体系中的1mol 理想气体(已知igP C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则A 等容过程的 W = 0 ,Q =()1121T P P R C igP⎪⎪⎭⎫ ⎝⎛--,U =()1121T PP R C igP⎪⎪⎭⎫⎝⎛--,H =1121T P P C ig P ⎪⎪⎭⎫ ⎝⎛-。
B 等温过程的 W =21lnP P RT -,Q =21ln P PRT ,U = 0 ,H = 0 。
第2章P-V-T关系和状态方程一、是否题1. 纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。
(错。
可以通过超临界流体区。
)2. 当压力大于临界压力时,纯物质就以液态存在。
(错。
若温度也大于临界温度时,则是超临界流体。

化工热力学课后答案第1章 绪言一、是否题1. 封闭体系的体积为一常数。
(错)2. 封闭体系中有两个相βα,。
在尚未达到平衡时,βα,两个相都是均相敞开体系;达到平衡时,则βα,两个相都等价于均相封闭体系。
(对)3. 理想气体的焓和热容仅是温度的函数。
(对)4. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T 1和T 2,则该过程的⎰=21T T V dT C U ∆;同样,对于初、终态压力相等的过程有⎰=21T T P dT C H ∆。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)二、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。
2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的功为()f i rev V V RT W ln =(以V 表示)或()i f rev P P RT W ln = (以P 表示)。
3. 封闭体系中的1mol 理想气体(已知igP C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则A 等容过程的 W = 0 ,Q =()1121T P P R C igP⎪⎪⎭⎫ ⎝⎛--,错误!未找到引用源。
U =()1121T PP R C igP⎪⎪⎭⎫⎝⎛--,错误!未找到引用源。
H = 1121T P P C ig P ⎪⎪⎭⎫ ⎝⎛-。
B 等温过程的 W =21lnP P RT -,Q =21ln P PRT ,错误!未找到引用源。
U = 0 ,错误!未找到引用源。
H = 0 。
C 绝热过程的 W =()⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡-⎪⎪⎭⎫ ⎝⎛--11211igPC RigPP P R V P R C ,Q = 0 ,错误!未找到引用源。

化工热力学课后答案第1章绪言—、是否题1. 封闭体系的体积为一常数。
(错)2. 封闭体系中有两个相, 。
在尚未达到平衡时,, 两个相都是均相敞开体系;达到平衡时,则,两个相都等价于均相封闭体系。
(对)3. 理想气体的焓和热容仅是温度的函数。
(对)4. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)5. 封闭体系的1mol 气体进行了某一过程, 其体积总是变化着的, 但是初态和终态的体积相T 2等,初态和终态的温度分别为 T [和丁2,则该过程的 UC V dT ;同样,对于初、终态T iT 2压力相等的过程有 HC p dT 。
(对。
状态函数的变化仅决定于初、 终态与途径无关。
)T 1二、填空题状态函数的特点是: ________ 。
封闭体系中,温度是 T 的1mol 理想气体从(P , V )等温可逆地膨胀到(P ,V f ),则所做的 功为 W revRTl nV i V f (以 V 表示)或 W rev RT l nP f P (以 P 表示)。
C PP T1T 1。
1.3. 封闭体系中的imol 理想气体(已知C pg ),按下列途径由T 、P i 和V 可逆地变化至P 2,则A 等容过程的 W = _,Q= Cp 1RP 2 P 2P i/C Pg RP 1 1 T 1 , H=B等温过程的RTln l,^RTln t,U= 0 ,H=_0 ___ 。
解:EOSW revV 2 b RTl n丄 V 1 bRTln 纟V 1999In 2 1.0007222. 对于c P为常数的理想气体经过一绝热可逆过程,状态变化符合下列方程解: 3. 解: T 1 P 1(1),其式又是如何?以上a 、b 、 理想气体的绝热可逆过程,C ;gRdTT 22a Rb TT 1aln 旦 b T 2T1RT dV V cT dTCigC !,试问,对于C P a bTcT 2的理想气体,上述关系c 为常数。



第 3章均相封闭体系热力学原理及其应用一、是否题1. 体系经过一绝热可逆过程,其熵没有变化。
2. 吸热过程一定使体系熵增,反之,熵增过程也是吸热的。
3. 热力学基本关系式 dH=TdS+VdP只适用于可逆过程。
4. 象 dU=TdS-PdV等热力学基本方程只能用于气体,而不能用于液体或固相。
5. 当压力趋于零时, ((0, , ≡-P T M P T M ig (M 是摩尔性质。
6.[](0ln , P PR P T S S ig+-与参考态的压力 P 0无关。
纯物质逸度的完整定义是,在等温条件下, f RTd dG ln =。
7. 理想气体的状态方程是 PV=RT, 若其中的压力 P 用逸度 f 代替后就成为了真实流体状态方程。
8. 当0→P 时, ∞→P f 。
9. 因为⎰⎪⎭⎫⎝⎛-=PdP P RT V RT 01ln ϕ,当0→P 时, 1=ϕ,所以, 0=-P RT V 。
10. 逸度与压力的单位是相同的。
11. 吉氏函数与逸度系数的关系是 ((ϕln 1, , RT P T G P T G ig ==-。
12. 由于偏离函数是两个等温状态的性质之差, 故不可能用偏离函数来计算性质随着温度的变化。
13. 由于偏离函数是在均相体系中引出的概念, 故我们不能用偏离函数来计算汽化过程的热力学性质的变化。
14. 由一个优秀的状态方程,就可以计算所有的均相热力学性质随着状态的变化。
二、选择题1. 对于一均匀的物质,其 H 和 U 的关系为(B 。
因 H =U +PVA. H ≤UB. H>UC. H=UD. 不能确定2. 一气体符合 P=RT/(V-b 的状态方程从 V 1等温可逆膨胀至 V 2,则体系的∆S 为(C 。
b V b V R b V R dV T P dV V S S V V V V V V V T --=-=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂=⎰⎰⎰12ln 212121∆ A. bV bV RT --12lnB. 0C. bV bV R --12lnD. 12lnV V R 3. 对于一均相体系, VP T S T T S T ⎪⎭⎫⎝⎛-⎪⎭⎫⎝⎛∂∂∂∂等于(D 。

化⼯热⼒学答案(3章)3-1. 物质的体积膨胀系数β和等温压缩系数k 的定义分别为:1P V V T β=,1TV k V P =- ?。
试导出服从Vander Waals 状态⽅程的β和k 的表达式。
解:Van der waals ⽅程2 RT a P V b V=--由Z=f(x,y)的性质1y x z z x y x y z =- ? ?得 1T P VP V T V T P=- ? ? ???? ⼜ ()232TP a RTV VV b =-- VP R T V b= ?-所以 ()2321P a RT V V b V T RV b -??-??=-??-()()3232P RV V b V T RTV a V b -= ?-- 故 ()()22312PRV V b V V T RTV a V b β-==--()()222312T V V b V k V P RTV a V b -=-= ?-- 3-2. 某理想⽓体借活塞之助装于钢瓶中,压⼒为,温度为93℃,反抗⼀恒定的外压⼒ MPa ⽽等温膨胀,直到两倍于其初始容积为⽌,试计算此过程之U ?、H ?、S ?、A ?、G ?、TdS ?、pdV ?、Q和W 。
解:理想⽓体等温过程,U ?=0、H ?=0∴ Q =-W =21112ln 2V V V V RTpdV pdV dV RT V==== J/mol ∴ W = J/mol⼜ PP dT V dSC dP T T=- ?理想⽓体等温膨胀过程dT =0、P V R T P= ? ∴ R dS dP P=-∴ 222111ln ln ln2S P P P S P SdS R d P R PR ?==-=-=??=(mol·K)A U T S ?=?-?=-366×= J/(mol·K)G H T S A ?=?-?=?= J/(mol·K)TdS T S A =?=??= J/(mol·K)21112ln 2V V V V RTpdV pdV dV RT V==== J/mol 3-3. 试求算1kmol 氮⽓在压⼒为、温度为773K 下的内能、焓、熵、V C 、p C 和⾃由焓之值。


《化工热力学》综合复习资料第2章 流体的p-V-T 关系一、试用Pitzer 三参数普遍化方法计算水蒸汽在107.9×105Pa 、593K 下的比容。
第3章 流体的热力学性质一、丙烷气体的始态为1.013×105Pa 、400K(可以视为理想气体),终态为3.013×105Pa 、500K 。
已知丙烷在理想气体状态下的摩尔热容为:T C ig p 1775.099.22+= (J/mol.K)试采用三参数普遍化关系式计算始态至终态的焓变与熵变。
二、用三参数普遍化方法计算1kmol 的1,3-丁二烯,从25atm 及130℃压缩至125atm 和280℃时的ΔH 、ΔS 、ΔU 和ΔV 。
已知理想气体状态下的定压热容(cal/mol.K)与温度(K)的函数关系为: 26310649.1710224.53432.5T T C ig p--⨯-⨯+=第5章 化工过程的能量分析一、1.57MPa 、484℃的过热水蒸气推动透平作功,并在0.0687MPa 下排出。
此透平既不绝热也不可逆,输出的轴功相当于可逆绝热膨胀功的85%。
由于隔热不好,每kg 的蒸汽有7.12kJ 的热量散失于20℃的环境中。
求此过程的理想功、损失功及热力学效率。
二、某炼厂有一台蒸汽透平,已知水蒸汽入口的温度为440℃,压力为40×105Pa ,流率为4000kg/h ,蒸汽排出的压力为7.0×105Pa 。
(1) 假定透平绝热可逆操作,试计算透平的功率;(2) 若透平绝热操作,输出的轴功等于绝热可逆轴功的82.65%。
则蒸汽的出口温度为多少?并计算过程的有效能(火用 )损失。
三、有一逆流式换热器,利用废气加热空气,空气由0.1MPa ,293K 被加热到398K ,空气流量为1.5kg.s –1;而废气从0.13MPa 、523K 冷却到368K 。
空气的等压热容为1.04kJ.kg –1.K –1,而废气的等压热容为0.84 kJ.kg –1.K –1,假定空气与废气通过换热器的压力与动能变化可忽略不计,而且换热器与环境无热量交换,环境状态为0.1MPa 、293K 。
3-1. 物质的体积膨胀系数β和等温压缩系数k 的定义分别为:1PV V T β∂⎛⎫=⎪∂⎝⎭,1TV k V P ∂⎛⎫=- ⎪∂⎝⎭。
试导出服从 状态方程的β和k 的表达式。
解: 方程2RT aP V b V=-- 由()的性质1y xz z x y x y z ⎛⎫∂∂∂⎛⎫⎛⎫⋅⋅=- ⎪⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭得 1T P VP V T V T P ∂∂∂⎛⎫⎛⎫⎛⎫⋅⋅=- ⎪⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ 又 ()232TP a RTV V V b ∂⎛⎫=-⎪∂⎝⎭- VP R T V b∂⎛⎫=⎪∂-⎝⎭所以 ()2321P a RTV V b VT R V b ⎡⎤∂-⎛⎫-⋅⋅=-⎢⎥⎪∂⎝⎭-⎢⎥⎣⎦()()3232P RV V b V T RTV a V b -∂⎛⎫= ⎪∂⎝⎭-- 故 ()()22312PRV V b V V T RTV a V b β-∂⎛⎫==⎪∂⎝⎭--()()222312T V V b V k V P RTV a V b -∂⎛⎫=-= ⎪∂⎝⎭-- 3-2. 某理想气体借活塞之助装于钢瓶中,压力为34.45,温度为93℃,反抗一恒定的外压力3.45 而等温膨胀,直到两倍于其初始容积为止,试计算此过程之U ∆、H ∆、S ∆、A ∆、G ∆、TdS ⎰、pdV ⎰、Q 和W 。
解:理想气体等温过程,U ∆=0、H ∆=0 ∴ 21112ln 2V V V VRTpdV pdV dV RT V===⎰⎰⎰2109.2 ∴ 2109.2 又 P PdTV dS C dP T T ∂⎛⎫=- ⎪∂⎝⎭ 理想气体等温膨胀过程0、P V R T P∂⎛⎫= ⎪∂⎝⎭∴ R dS dP P=-∴ 222111ln ln ln2S P P P SP S dS R d P R PR ∆==-=-=⎰⎰=5.763(·K)A U T S ∆=∆-∆366×5.7632109.26 (·K)G H T S A ∆=∆-∆=∆2109.26 (·K)TdS T S A =∆=∆⎰2109.26 (·K)21112ln 2V V V V RTpdV pdV dV RT V===⎰⎰⎰=2109.2 3-3. 试求算1氮气在压力为10.13、温度为773K 下的内能、焓、熵、V C 、p C 和自由焓之值。
第二章 流体的压力、体积、浓度关系:状态方程式2-1 试分别用下述方法求出400℃、4.053MPa 下甲烷气体的摩尔体积。
(1) 理想气体方程;(2) RK 方程;(3)PR 方程;(4) 维里截断式(2-7)。
其中B 用Pitzer 的普遍化关联法计算。
[解] (1) 根据理想气体状态方程,可求出甲烷气体在理想情况下的摩尔体积idV 为33168.314(400273.15)1.381104.05310id RT V m mol p --⨯+===⨯⋅⨯ (2) 用RK 方程求摩尔体积将RK 方程稍加变形,可写为0.5()()RT a V b V b p T pV V b -=+-+ (E1)其中2 2.50.427480.08664c c c cR T a p RT b p ==从附表1查得甲烷的临界温度和压力分别为c T =190.6K, c p =4.60MPa ,将它们代入a, b 表达式得2 2.56-20.560.427488.314190.6 3.2217m Pa mol K 4.6010a ⨯⨯==⋅⋅⋅⨯ 53160.086648.314190.6 2.9846104.6010b m mol --⨯⨯==⨯⋅⨯ 以理想气体状态方程求得的idV 为初值,代入式(E1)中迭代求解,第一次迭代得到1V 值为5168.314673.152.9846104.05310V -⨯=+⨯⨯ 350.563353.2217(1.38110 2.984610)673.15 4.05310 1.38110(1.38110 2.984610)-----⨯⨯-⨯-⨯⨯⨯⨯⨯⨯+⨯ 3553311.381102.984610 2.1246101.389610m mol -----=⨯+⨯-⨯=⨯⋅ 第二次迭代得2V 为353520.563353553313.2217(1.389610 2.984610)1.381102.984610673.154.05310 1.389610(1.389610 2.984610)1.381102.984610 2.1120101.389710V m mol ------------⨯⨯-⨯=⨯+⨯-⨯⨯⨯⨯⨯⨯+⨯=⨯+⨯-⨯=⨯⋅1V 和2V 已经相差很小,可终止迭代。
2习题第1章 绪言一、是否题1. 孤立体系的热力学能和熵都是一定值。
(错。
和,如一体积等于2V 的绝热刚性容器,被一理想的隔板一分为二,左侧状态是T ,P 的理想气体,右侧是T 温度的真空。
当隔板抽去后,由于Q =W =0,,,,故体系将在T ,2V ,0.5P 状态下达到平衡,,,)2. 封闭体系的体积为一常数。
(错)3. 封闭体系中有两个相。
在尚未达到平衡时,两个相都是均相敞开体系;达到平衡时,则两个相都等价于均相封闭体系。
(对)4. 理想气体的焓和热容仅是温度的函数。
(对)5. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)6. 要确定物质在单相区的状态需要指定两个强度性质,但是状态方程 P=P (T ,V )的自变量中只有一个强度性质,所以,这与相律有矛盾。
(错。
V 也是强度性质)7. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T 1和T 2,则该过程的;同样,对于初、终态压力相等的过程有。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)8. 描述封闭体系中理想气体绝热可逆途径的方程是(其中),而一位学生认为这是状态函数间的关系,与途径无关,所以不需要可逆的条件。
(错。
) 9. 自变量与独立变量是一致的,从属变量与函数是一致的。
(错。
有时可能不一致)10. 自变量与独立变量是不可能相同的。
(错。
有时可以一致)三、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。
2. 单相区的纯物质和定组成混合物的自由度数目分别是 2 和 2 。
3. 封闭体系中,温度是T 的1mol 理想气体从(P ,V )等温可逆地膨胀到(P ,V ),则所做的功为i i f f(以V 表示)或 (以P 表示)。
4. 封闭体系中的1mol 理想气体(已知),按下列途径由T 1、P 1和V 1可逆地变化至P,则mol ,温度为 和水 。