人教版高中化学必修一原子结构模型的演变
- 格式:docx
- 大小:24.19 KB
- 文档页数:4



高中化学教案原子结构模型的演变教案通常包括教材简析、教学目的、教学准备、教学过程及练习设计等步骤,下文为您提供的是教案“高中化学教案:原子结构模型的演变”的内容!教学设计一、学习目标1.通过原子结构模型演变的学习,了解原子结构模型演变的历史,了解科学家探索原子结构的艰难过程。
认识实验、假说、模型等科学方法对化学研究的作用。
体验科学实验、科学思维对创造性工作的重要作用。
2.了解钠、镁、氯等常见元素原子的核外电子排布情况,知道它们在化学反应过程中通过得失电子使最外层达到8电子稳定结构的事实。
通过氧化镁的形成了解镁与氧气反应的本质。
了解化合价与最外层电子的关系。
3.知道化学科学的主要研究对象,了解化学学科发展的趋势。
二、重点、难点重点:原子结构模型的发展演变镁和氧气发生化学反应的本质难点:镁和氧气发生化学的本质三、设计思路教学重点:用过滤和结晶分离混合物的一般原理。
教学难点:利用结晶方法,分离几种可溶固体物质的混合物的原理。
教学过程:引言:在生产生活中,人们所接触到的物质很多都是混合物,为了适应各种不同的需要,常常要把混合物里的几种物质分开,得到较纯净的物质,这叫做混合物的分离,过滤和结晶是最常用的混合物分离的方法。
(板书)第四节过滤和结晶一、过滤1.定义:过滤是把溶于液体的固态物质跟液体分离的一种方法。
2.原理:过滤时,液体穿过滤纸上的小孔,而固态物质留在滤纸上,从而使固体和液体分离。
3.操作方法:例如:粗盐提纯(请学生设计实验步骤)展示粗盐,让学生看到粗盐上的沙子等不溶性固体物质,以利于学生思考。
(演示实验)粗盐提纯归纳出:(1)步骤:①在烧杯中溶解粗盐②过滤(2)注意事项:一贴:滤纸紧贴漏斗内壁二低:滤纸低于漏斗边缘0.5cm滤液低于滤纸边缘三靠:漏斗下端紧靠烧杯内壁玻璃棒靠在三层滤纸处烧杯靠在玻棒上倾倒液体(3)玻璃棒的作用溶解——加速溶解过滤——引流让学生总结过滤作为分离物质的一种方法的适用范围。

高中化学学习材料(灿若寒星**整理制作)课题:原子结构模型的演变教学目的:1.通过对原子结构模型演变历史的了解,认识假说、实验等科学方法在人类探索原子结构奥秘过程中的作用;2.了解钠镁铝等活泼金属元素和氟氧等活泼非金属元素的原子的核外电子分层排步的情况,知道这类原子在化学反应过程中常通过电子得失使最外层达到8电子稳定结构的事实;3.通过氧化镁的形成、氯化钠的形成初步了解钠与氯、镁与氧气反应的本质。
教学过程:[引入] 人类的文明程度也体现在对微观世界的研究上。
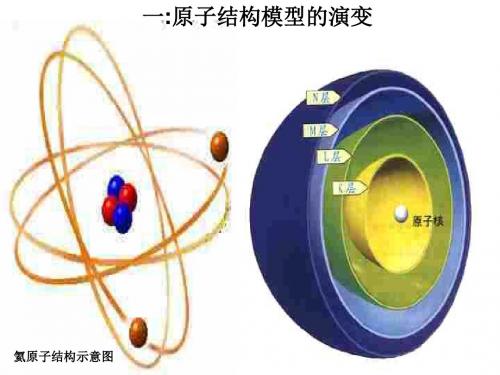
[阅读] P26图1-24,回顾原有的微粒与物质的相关知识,[练习](1)有人说:“物质都是由分子构成的”,对吗?为什么?(2)元素的种类和原子的种类 ( )A .前者大B .后者大C .相等D .不能确定[过渡] 人类对原子结构的认识是逐渐深入的,科学实验是揭示原子结构奥秘的基石,而假想是探索的潜动力[阅读] P26交流与讨论,各人发表感想与启迪[小结]一、原子结构模型的演变(1)化学认识中的继承、积累、突破和革命:原子学说、α粒子散射实验(2)实验方法是科学研究的一种重要方法,实验手段的不断进步是化学发展的一个关键。
(3)科学研究、科学发现是无止境的。
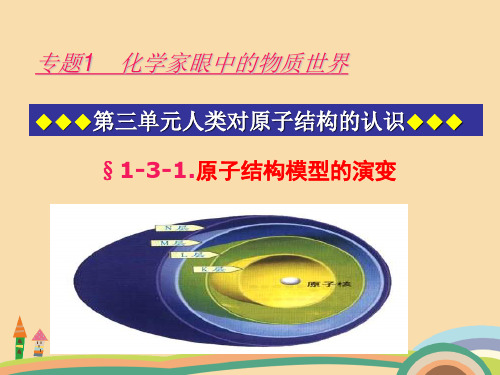
(4)对于多电子原子,可以近似认为原子核外电子是分层排步的。
观察图1-30二、原子的稳定结构1.原子结构示意图的书写:要求学生必须掌握1-20号元素的原子结构示意图的书写[活动]比较氖原子与Mg 、O 原子的结构示意图,说出异同,推测性质。
[活动]比较氖原子与Mg 2+、O -原子的结构示意图,说出异同,推测性质。
2.八电子稳定结构:(配以电子式的书写讲授)(1) 等活泼金属原子在化学反应时易失去电子形成最外层为8电子道尔顿 原子结构模型 汤姆生 原子结构模型 卢瑟福 原子结构模型 波尔 原子结构模型结构的阳离子(介绍Na、Mg、Al电子式的书写)(2)等活泼非金属原子在化学反应时易失去电子形成最外层为8电子结构的阴离子(介绍N、O、F电子式的书写)(3)等最外层为8电子结构的原子化学性质很不活泼。
第3单元课时1原子结构模型的演变一、学习目标1. 通过原子结构模型演变的学习,了解原子结构模型演变的历史,了解科学家探索原子结构的艰难过程。
认识实验、假说、模型等科学方法对化学研究的作用。
体验科学实验、科学思维对创造性工作的重要作用。
2.了解钠、镁、氯等常见元素原子的核外电子排布情况,知道它们在化学反应过程中通过得失电子使最外层达到8电子稳定结构的事实。
通过氧化镁的形成了解镁与氧气反应的本质。
了解化合价与最外层电子的关系。
3.知道化学科学的主要研究对象,了解化学学科发展的趋势。
二、教学重点及难点原子结构模型的发展演变、镁和氧气发生化学反应的本质教学案【知识引入】观看视频:扫描隧道显微镜下的一粒沙子。
今天我们还将进入更加微观的层次,了解人类对于原子结构的认识。
你认为我们可以通过什么样的方法去认识原子的内部结构呢?直接法和间接法,直接法努力的方向是观察技术的提高和观察工具的改进,而间接法则依赖精巧的实验和大胆的假设。
事实上直到今天即使借助扫描隧道显微镜也无法观察到原子的内部结构,所以在人们认识原子结构的过程中,实验和假设以及模型起了很大的作用。
【课堂探究】一、中国古代物质观(板书)[提出问题]我们通常接触的物体,总是可以被分割的(折断粉笔)。
但是我们能不能无限地这样分割下去呢?[介绍]《中庸》提出:“语小,天下莫能破焉”。
惠施的人也说道“其小无内,谓之小一”。
墨家则提出:“端,体之无序最前者也。
”二、西方原子鼻祖[介绍]德谟克利特认为就像用一块块砖头砌墙一样,物质是由不可分割的原子构成。
道尔顿在《化学哲学的新体系》一书中指出在化学反应中原子既不会产生,也不会被消灭,他们只是被分开,再重新组合,你鼻尖上的某个碳原子可能正是亿万年前恐龙尾巴上的呢。
书中他系统地阐述了其原子学说。
道尔顿的原子学说是建立在大量实验事实基础上的,成功地解释了化学定律。
当然我们现在知道受当时的科学发展水平限制,这个理论仍有一些不完善的地方。
课题:原子结构模型的演变
教学目的:1.通过对原子结构模型演变历史的了解,认识假说、实验等科学方法在人类探
索原子结构奥秘过程中的作用;
2.了解钠镁铝等活泼金属元素和氟氧等活泼非金属元素的原子的核外电子分层
排步的情况,知道这类原子在化学反应过程中常通过电子得失使最外层达到8
电子稳定结构的事实;
3.通过氧化镁的形成、氯化钠的形成初步了解钠与氯、镁与氧气反应的本质。
教学过程:
[引入] 人类的文明程度也体现在对微观世界的研究上。
[阅读] P26图1-24,回顾原有的微粒与物质的相关知识,
[练习](1)有人说:“物质都是由分子构成的”,对吗?为什么?
(2)元素的种类和原子的种类 ( )
A .前者大
B .后者大
C .相等
D .不能确定
[过渡] 人类对原子结构的认识是逐渐深入的,科学实验是揭示原子结构奥秘的基石,而假
想是探索的潜动力
[阅读] P26交流与讨论,各人发表感想与启迪
[小结]
一、原子结构模型的演变
(1)化学认识中的继承、积累、突破和革命:
原子学说、α粒子散射实验
(2)实验方法是科学研究的一种重要方法,实验手段的不断进步是化学发展的一个关键。
(3)科学研究、科学发现是无止境的。
(4)对于多电子原子,可以近似认为原子核外电子是分层排步的。
观察图1-30
二、原子的稳定结构
1.原子结构示意图的书写:要求学生必须掌握1-20号元素的原子结构示意图的书写
[活动]比较氖原子与Mg 、O 原子的结构示意图,说出异同,推测性质。
[活动]比较氖原子与Mg 2+、O -原子的结构示意图,说出异同,推测性质。
2.八电子稳定结构:(配以电子式的书写讲授)
(1) 等活泼金属原子在化学反应时易失去电子形成最外层为8电子结构的阳离子(介绍Na 、Mg 、Al 电子式的书写)
(2) 等活泼非金属原子在化学反应时易失去电子形成最外层为8电子结构的阴离子(介绍N 、O 、F 电子式的书写)
(3) 等最外层为8电子结构的原子化学性质很不活泼。
(介绍Ne 、Ar )
(4)许多原子有达到最外层为8电子结构的倾向,最外层为8电子结构是一种比较稳定的结构。
介绍CO 2、Cl 2、N 2电子式的书写
(5)八电子稳定结构只是一个经验性的规律,有许多情况无法使用这个规律来解释。
如BeCl 2、H 2、He 、NO
[练习] 完成P29问题解决。
得出(6)、(7)
道尔顿 原子结构模型 汤姆生 原子结构模型 卢瑟福 原子结构模型 波尔 原子结构模型
(6)原子的最外层电子数影响元素的化合价,最外层电子数=价电子数(最高正化合价)。
(7)最高正化合价+最低负化合价的绝对值= 8
[随堂训练]
1.“原子结构模型”是科学家根据自己的认识,对原子结构的形象描摹,一种模型代表了人类某一阶段对原子结构的认识。
人们对原子结构的描摹,按现代向过去顺序排列为:原子模型、汤姆生原子模型、原子模型、电子云模型、玻尔原子模型。
2.用化学方法不能实现的是()
A.生成一种新分子B.生成一种新离子
C.生成一种新原子D.生成一种新单质
3.1999年度诺贝尔化学奖授予开创“飞秒(10-15s)化学”新领域的科学家泽维尔,诺贝尔奖委员会对该技术的评语是:“使运用激光光谱技术观测化学反应时分子中原子运动成为可能”。
你认为该技术不能观测到的是()A.原子中原子核的内部结构
B.化学反应中原子的运动
C.化学反应中生成物粒子的形成
D.化学反应中反应物粒子的分解
4.已知最外层电子数相等的元素原子具有相似的化学性质。
氧元素原子的核外电子分层排布示意图为,下列原子中,与氧元素原子化学性质相似的是()
氖碳镁硫
A B C D
[课后作业]
1.自从下列哪项发现或学说开始,化学才开始成为一门科学()
A.阿伏加德罗提出原子——分子学说B.拉瓦锡确定空气的组成
C.道尔顿提出近代原子学说D.汤姆逊发现电子
2.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。
他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。
下列说法正确的是( )
A 化学不再是纯实验科学
B 化学不再需要实验
C 化学不做实验,就什么都不知道
D 未来化学的方向还是经验化
3.(2005年高考上海卷)以下命题,违背化学变化规律的是
A.石墨制成金刚石B.煤加氢变成人造石油
C.水变成汽油D.干冰气化
4. 首次将量子化概念应用到原子结构,并解释了原子稳定性的科学家是( )
A. 道尔顿
B. 爱因斯坦
C. 玻尔
D. 普朗克
5.在饮用水中添加含钙、镁、锌、硒等的矿物质,可以改善人体营养,增强体质。
其中的“钙、镁、锌、硒”是指()
A.分子B.原子C.离子D.元素
6. 下列说法正确的是()
A.原子是不可再分的粒子
B.相对原子质量就是原子的实际质量
C.分子是保持物质性质的最小粒子
D.与元素化学性质关系密切的是原子的最外层电子数
7.下列说法错误的是()
A.铅笔不含铅B.水银不含银C.白金不是金D.火碱不是碱
8.下列现象能证明分子在化学变化中可分的是()
A. 100 mL水和100 mL酒精混合后总体积小于200 mL
B.打开盛装浓盐酸瓶盖,浓盐酸逐渐减少
C.气态氧在加压降温时变为淡蓝色的液态氧
D.在1000℃时,甲烷可分解为石墨和氢气
9.下图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是()
A、B、C、D、
10.在原子中,下列关系中一定正确的是()
A.质子数=核电荷数
B.相对原子质量=质子数+中子数
C.质子数≠中子数
D.相对原子质量=质子数+核外电子数
11.许多科学家在化学的发展方面起了重大作用。
其中,研究空气成分,得出“空气是由氧气和氮气组成”结论的科学家是,提出分子概念的科学家是,提出近代原子学说的科学家是,最早发现电子的科学家是。
12.在1911年前后,物理学家卢瑟福把一束变速运动的α粒子(相对原子质量约为4的带2个单位正电荷的质子粒),射向一片极薄的金箔。
他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟能让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的。
但也有极少数的α粒子发生偏转,或被笔直地弹回。
根据以上实验现象能得出关于金箔中Au原子结构的一些结论。
试写出其中的三点:
(1)______________________________________________________________
(2)______________________________________________________________
(3)______________________________________________________________
13.“法轮功”魔头李洪志在某次“带功”报告会上吹嘘,“一次我拿一根纯铝棒经意念发功后,经高能物理研究所测试,铝棒的成分都发生了变化,变成了铁,还有铜和金的成分……”试用化学的观点从能量和核变化的角度分析其荒谬之处。
14.在2400多年前,古希腊哲学家德谟克利特在一首诗中表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消灭。
看起来万物是死了,但是实则犹生;正如一场春雨落地,霎时失去踪影;可是草木把它吸收,长成花叶果实,——依然欣欣向荣。
”请你从分子和原子的观点,说明物质不灭的原因。
15. 1808年英国科学家道尔顿提出了近代原子学说,1811年意大利科学家阿伏加德罗提出了分子的概念,二十世纪奥地利和德国物理学家泡利、洪特分别提出了核外电子排布的“泡利不相容原理”、“洪特规则”,1869年俄国化学家门捷列夫发现了元素周期律,十九世纪荷兰物理学家范德华首先研究了分子间作用力。
从此化学从“实验经验型”上升到对物质结构的理论探究。
这对科学的发展有何重要意义?。