复习课:微粒构成物质(公开课)
- 格式:ppt
- 大小:2.06 MB
- 文档页数:29

初三化学“微粒构成物质复习课”教学设计教学依据课标分析:1.课标要求:“微粒构成物质”是初中阶段形成微粒观的重要阶段。
微粒观的建立是化学学科中的一条重要思想,是课程标准中的“物质构成的奥秘”这一核心主题中的重要内容。
微粒观主要内容在教材中编排在第三单元,其余少部分穿插在其他单元。
初中阶段学生构建微粒观可以分为三个阶段:第一阶段,以分子、原子等基本粒子的概念的建立为标志,让学生认识物质是由这些肉眼看不到的微粒构成的;微粒在不断运动的;微粒间有一定的间隔;微粒间存在相互作用,这种相互作用使微粒聚集构成物质;物质的宏观状态、特性是由构成物质的微粒的种类、排列方式以及运动决定的;物质的变化是微粒之间相互作用的结果。
第二阶段,以化合价、质量守恒定律概念建立为标志,学习者要从宏观和微观相结合的视角定量的解释物质的化学变化。
第三阶段,学习者能自觉地应用为例观解释一些现象。
而本节课正是进入第一阶段后的一节复习课,在这一阶段学生要完成对微粒构成物质的比较全面的认识,不仅仅是知道两个名词,记忆两段概念那么简单。
在这一阶段学生要从习惯了的宏观视角走进微观视角,从全新的角度去观察物质、变化,还要从静态到动态、从定性到定量多角度的多层面的去体会、感知、描述,逐渐习惯运用微观与宏观相结合的思考方式和表达方式,学会运用“微粒模型图”这种表达微观特征的技术手段。
这些都将对他们后面两个阶段乃至于高中阶段的学习有着重要的影响。
2.本节课如何落实课标:在这节复习课上采用的大量时间让学生识图、画图,将自己对微观世界的认识描绘出来,就是希望学生能主动地把对“微粒构成物质”的主动认识调动出来,并能运用有效的方式表达出来,能将物质宏观层面的表面与微观粒子的特征形成对应,在这样的表达中活动深化对微观世界的认识。
学情分析1.学生已有的认识初三是化学的初始阶段,学生已经学习了对物质进行简单的分类,但这些分类还都是停留在宏观层面的。
学生见过并记忆了一些物质的化学式,但是为什么这样书写化学式,化学式与物质构成之间的关系学生并不清楚。


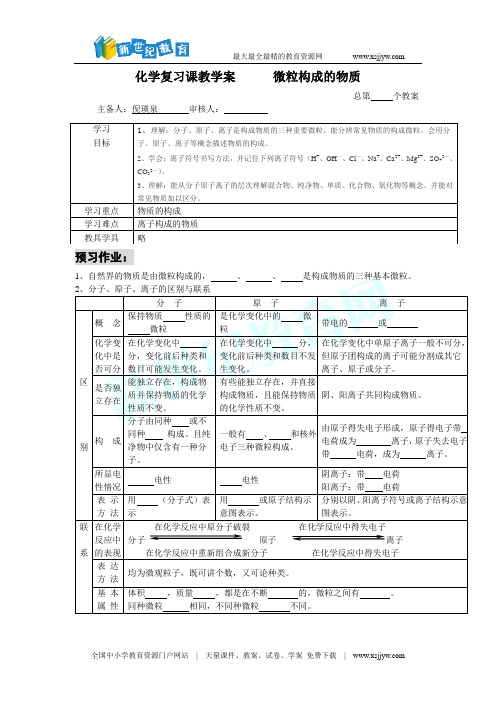
化学复习课教学案微粒构成的物质总第个教案主备人:倪瑛泉审核人:预习作业:1、自然界的物质是由微粒构成的,、、是构成物质的三种基本微粒。
3、物质的组成(构成) 单 质分 子 CO 2元 素 物 质 原 子 Hg化合物 离 子 NaCl4、原子的结构 ①每个质子相对原子质量约等于1,约等于一个 原子的质量。
质子 ②每个质子带一个单位的 电荷。
③决定 种类。
原子核 ①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原 中子 ② 电荷。
③决定同类元素中的不同种原子。
子 ①质量约等于 (或 )质量的1/1836。
②每个电子带一个单位的 电荷。
③核外电子分层排布, 最外层电子数决定 的性质。
原子中:核电荷数 = 数 = 数相对原子质量≈质子数 + 中子数。
(为什么?)阳离子:核电荷数=质子数>核外电子数阴离子:核电荷数=质子数<核外电子数5、 物质组成、构成的描述(1)、物质由元素 成:如:水是由氢元素和氧元素组成的。
(2)、物质由粒子(分子、原子、离子) 成。
例如:水是由水 构成的。
金是由金 构成的。
氯化钠是由 和 构成的。
(3)、分子是由原子 的:如:水分子是由氢原子和氧原子构成的;每个水分子是由二个氢 和一个氧 构成的。
例题精讲有A 、B 、C 三种粒子:已知A 带1个单位负电荷,其核外电子排布与氩原子相同;B 粒子的第一、第三两电子层的电子数相等;每个C 粒子中有3个原子核,其质子数总和为10。
(1) 写出A 、B 、C 的符号:A ,B ,C 。
(2) B 粒子的原子结构示意图是 ,A 粒子的核电荷数是 。
(3) 写出B 与稀硫酸反应的化学方程式: ;金属钠与C 反应的化学方程式: 。
练习巩固宏观组成 微观构成1、1994年12月科学家发现了一种新元素,它的原子核内有111个质子,161个中子,则该元素原子的核外电子数是( )A 、111B 、272C 、50D 、1612、一种原子的核内有6个质和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是( )A 、核电荷数B 、核外电子数C 、原子的质量D 、元素的种类3、某元素R 原子的核电荷数为1~18之间,已知R 2- 的核外有x 个电子,则R 原子的核内质子数及与钠化合时的化学式分别是 ( )A . x 、Na 2RB . 2x 、NaRC . ( x -2)、Na 2RD . ( x +2)、Na 2R4、一种物质不能用化学方法再分成两种或多种更简单的物质,这种物质是( )A 、化合物B 、混合物C 、空气D 、单质5、画出下列微粒的结构示意图Mg 2+ Na S 2-Ar Al 3+ Cl -6、读下表完成填空①可形成XY 2型化合物的元素是 。


《微粒构成物质》复习课【教学目标】1、认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒;2、能用微粒的观点解释某些常见的现象;3、知道原子的构成,初步认识核外电子在化学反应中的作用;4、知道原子可以结合成分子,知道同一元素的原子和离子可以相互转化。
【教学重点】分子、原子、离子等都是构成物质的微粒【教学难点】知道同一元素的原子和离子可以相互转化【教学过程】环节一情境引入——钠与氯气的反应1、尝试写钠与氯气反应的方程式:______ ___。
环节二由钠(Na)引发的思考2、再写出几种由原子直接构成的金属:______ _ _ __。
3、在原子的构成中存在的等式是: ______ ___、______ ___。
钠原子的结构示意图:,钠离子的结构示意图:,钠原子的相对原子质量为23,则中子数为______。
4、原子最外层电子数与______ ___关心最密切。
环节三由氯气引发的思考5、再写出几种由分子构成的物质:______ _ _ __。
6、氯原子的结构示意图:,氯离子的结构示意图:。
环节四氯化钠的形成7、氯化钠由什么微粒构成:______ _ _ ;再写出几种由离子构成的物质______ _ ____ ___ _ _ 。
环节五微粒间的相互转化8、镁原子______,镁离子______;铝原子______,铝离子______。
环节六微观与宏观练习:18、27(课后完成)9、用分子、原子、离子、质子、中子、电子、原子核、物质等,编织成一个有意义、有结构的知识网络。
10、总结归纳:由分子构成的物质一般是:______ ___;由原子构成的物质一般是:______ ___;由离子构成的物质一般是:______ ___;。
第三单元微粒构成物质(复习课)【学习目标】1.认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
2.能用微粒(分子)的观点解释某些常见的现象。
3.知道原子的构成,会分析原子结构示意图。
4.知道元素的简单分类,了解元素周期表。
【学习过程】活动一知识归纳请大家将:物质、元素、分子、原子、离子、质子、中子、电子、原子核、核外电子等概念建立相应的知识网络。
活动二基础知识1.从宏观角度分析,物质都是由元素组成的.例如氧气是由元素组成的,氧化铜是由元素组成的,水、二氧化碳、氧气中都含有元素.从微观角度分析,①物质都是由构成的,构成物质的粒子有、和。
如水是由构成的,汞是由构成的;氯化钠是由构成的。
②分子都是由构成的,如二氧化碳分子由构成的。
2.分子(微粒)的基本特征:(1);(2),且温度越高,;(3),气体分子间的间隔,容易被。
(4)分子是由构成的;同种分子相同;由分子构成的物质,3.构成原子的微粒有、、。
普通氢原子没有。
在原子中,核电荷数= = ,所以整个原子不显电性。
4.原子的质量主要集中在上;又由于构成原子的质子和中子的相对质量都约等于,所以相对原子质量= + 。
5.钠原子核内有11个质子,它的核电荷数是,钠原子核外有个电子;钠原子的相对原子质量为23,则钠原子核内有个中子。
核外电子在原子核外是排布的,可用原子结构示意图表示。
钠原子结构示意图为,它的最外层电子数为个,在化学反应中容易电子,带电,形成离子。
因此,元素的化学性质与的排布,特别是有密切关系。
6.当物质发生物理变化时,分子本身没有变,只改变了;当物质发生化学变化时,分子分解成,原子重新构成。
原子是化学变化中的。
在化学变化中,分子是的,原子是的。
分子是保持物质的最小粒子,由原子直接构成的物质,是保持物质化学性质的最小粒子。
7.元素是的总称;元素种类是由决定;元素的化学性质是由决定;地壳中含量前四名的元素是,地壳中含量最多的金属元素和非金属元素所形成的化合物为。
微粒构成物质
等、共价化合
元素是原子和总体和个体的关系,元素是一类原子的总称。
年本专题命题难度不大,规律性知识的总结和应用方面的命题可能会有所增加。
一种元素,它是单质.又如,金刚石和石墨的混合物,分析元素组成时,只含有一种元素碳元素,但是它是混合物.
确.
点评:本题主要考查了如何根据图中信息进行正确的判断方面的知识.判断模型所表示的物质属于单质还是化
气态,在这一过程中构成干冰的
分子没有变化,分子间隙变大
型图的应用;利用分子与原子的性质分析和解决问题;反应类型的判定;常见化学反应中的质
考点:根据化学反应方程式的计算;有关化学式的计算和推断.专题:有关化学方程式的计
个银
.
氢氧化钠和碳酸钠溶于水后均能使无色酚酞变红
、硫酸铜、小苏打、纯碱等物质都是由金属离子和酸根离子组
,某同学回忆起氢气与氧化铜反应。