1相平衡习题
- 格式:doc
- 大小:341.00 KB
- 文档页数:13



物理化学第六章相平衡习题一、选择题1. 若A和B能形成二组分理想溶液,且T B*>T A*,则A和B在达平衡的气、液相中的物质的量分数()。
(A)y A>x A,y B<x B;(B)y A<x A,y B>x B;(C)y A>x A,y B>x B;(D)y A<x A,y B<x B。
2. 液态完全互溶的两组分A、B组成的气液平衡系统中,在外压一定下,于该气液平衡系统中加入组分B(l)后,系统的沸点下降,则该组分在平衡气相中的组成y B()它在液相中的组成x B。
(A)大于(B)小于(C)等于(D)无法确定3. 在温度T下,CaCO3(s),CaO(s)及CO2的平衡系统压力为p,已知它们之间存在CaCO3(s)==CaO(s)+CO2(g)反应,若往该平衡系统中加入CO2(g), 当重新达到平衡时,系统的压力()。
(A)变大;(B)变小;(C)不变;(D)可能变大也可能变小。
4. A(低沸点)与B(高沸点)两种纯液体组成的液态完全互溶的气液平衡系统。
在一定温度下,将B(l) 加入平衡系统中时,测得系统的压力增大,说明此系统()。
(A)一定具有最大正偏差;(B)一定具有最大负偏差;(C)有可能是最大正偏差也有可能是最大负偏差;(D)数据不够,无法确定。
5. 组分A(s)与组成B(s)组成的凝聚系统相图中,若己知形成以下四种化合物:A2B(稳定),AB(稳定),AB2(不稳定),AB3(稳定)则该相图中有()最低共熔点和()条三相线。
(A) 3,3 (B)4,4 (C) 3,4;(D) 4,5。
6. 将克拉佩龙方程应用于H2O(s)和H2O(l)两相平衡,随着压力的增长,H2O的凝固点将()(A)升高(B)降低(C)不变(D)无法判断7. 将过量的NaHCO3(s)放入一真空密闭容器中,在50℃下,NaHCO3按下式进行分解:2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(g),系统达平衡后,则其组分数C=();F=()。


物理化学考试题库及答案第五章相平衡练习题一、判断题:1.1.在一个给定的系统中,物种数可以因分析问题的角度的不同而不同,但独立组分数是一个确定的数。
2.单组分系统的物种数一定等于1。
3.自由度就是可以独立变化的变量。
4.相图中的点都是代表系统状态的点。
5.恒定压力下,根据相律得出某一系统的f = l,则该系统的温度就有一个唯一确定的值。
6.单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述。
7.根据二元液系的p~x图可以准确地判断该系统的液相是否是理想液体混合物。
8.在相图中总可以利用杠杆规则计算两相平畅时两相的相对的量。
9.杠杆规则只适用于T~x图的两相平衡区。
10.对于二元互溶液系,通过精馏方法总可以得到两个纯组分。
11.二元液系中,若A组分对拉乌尔定律产生正偏差,那么B组分必定对拉乌尔定律产生负偏差。
12.恒沸物的组成不变。
13.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A 的摩尔分数成正比。
14.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
15.三组分系统最多同时存在5个相。
二、单选题:O、K+、Na+、Cl- 、I- 体系的组分数是:1.H2(A) K = 3 ;(B) K = 5 ;(C) K = 4 ; (D) K = 2 。
2.2.克劳修斯-克拉伯龙方程导出中,忽略了液态体积。
此方程使用时,对体系所处的温度要求:(A) 大于临界温度;(B) 在三相点与沸点之间;(C) 在三相点与临界温度之间;(D) 小于沸点温度。
3.单组分固-液两相平衡的p~T曲线如图所示,则:(A) V m(l) = V m(s) ;(B) V m(l)>V m(s) ;(C) V m(l)<V m(s) ;(D) 无法确定。
4.蒸汽冷凝为液体时所放出的潜热,可用来:(A)(A)可使体系对环境做有用功;(B)(B)可使环境对体系做有用功;(C)(C)不能做有用功;(D) 不能判定。

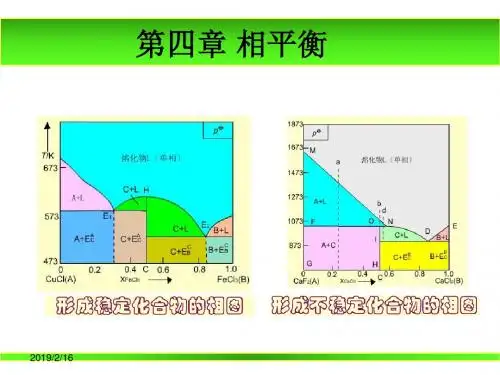
一、选择题 ( 共11题 20分 ) 1. 2 分 (2738) 2738二级相变符合的爱伦菲斯方程式是: ( ) (A ))/(d /d α∆∆=TV C T p V (B ))/(d /d α∆∆=TV C T p p(C )p p /ln(d )/(d /)α∆∆=TV C T V (D )p p /ln(d )/(d /)α∆∆=TV C T p2. 2 分 (2645)2645组分A 和B 可以形成四种稳定化合物:A 2B ,AB ,AB 2,AB 3,设所有这些化合物都有相合熔点。
则此体系的低共熔点最多有几个? ( ) (A)3 (B)4 (C)5 (D)63. 2 分 (2404) 2404在 101 325 Pa 的压力下,I 2在液态水和 CCl 4中达到分配平衡 (无固态碘存在),则该体系的自由度数为: ( )(A) f *= 1 (B) f *= 2 (C) f *= 0 (D) f *= 34. 2 分 (2644)2644水与苯胺的最高临界溶点温度为T 。
在某工艺中需用水萃取苯胺中的某物质时,操作的最佳温度应该是: ( ) (A)T > T 0 (B)T < T 0(C)T = T 0 (D)视具体情况而定5. 2 分 (2401) 2401当乙酸与乙醇混合反应达平衡后,体系的独立组分数 C 和自由度 f 应分别为:( ) (A) C = 2,f = 3(B) C = 3,f = 3 (C) C = 2,f = 2 (D) C = 3,f = 46. 2 分 (2635)2635在二组分液体从高温冷却时,有时会产生包晶现象。
请问包晶属于什么状态?( ) (A)热力学平衡态 (B)流动体系稳定态 (C)热力学不稳定状态 (D)流动体系不稳定态8. 2 分 (2637)2637组分A 与B 可形成共沸混合物E ,现欲将A+B 的体系进行共沸蒸馏,将二组分分离,则E 应该是: ( ) (A)最高恒沸混合物 (B)最低恒沸混合物 (C)A 和B 均可 (D)A 和B 均不可9. 2 分 (2640)2640恒沸混合物在气、液两相平衡共存时的自由度为: ( ) (A)0 (B)1 (C)2 (D)3*. 1 分 (2437) 2437在通常情况下,对于二组分物系能平衡共存的最多相为: ( ) (A) 1 (B) 2 (C) 3 (D) 411. 1 分 (3139) 3139一定温度压力下,化学反应吉布斯氏自由能Δr G m =(∂G /∂ξ)T ,p ,1n 与标准化学反应吉布斯自由能Δr G 相等的条件是: ( )(A) 反应体系处于平衡 (B) 反应体系的压力为p (C) 反应可进行到底 (D) 参与反应的各物质均处于标准态二、填空题 ( 共10题 20分 ) 13. 2 分 (2312) 2312研究多相体系的状态如何随 、 、 等变量的改变而发生变化,并用图形来表示体系的状态的变化,这种图称为状态图或称为相图。

3溶液和相平衡班级 姓名 分数一、选择题 ( 共15题 30分 )1. 2 分 (2030)20301000 g 水中加入0.01 mol 的食盐,其沸点升高了0.01 K ,则373.15 K 左右时,水的蒸气压随温度的变化率 d p /d T 为: ( )(A) 1823.9 Pa·K -1 (B) 3647.7 Pa·K -1(C) 5471.6 Pa·K -1 (D) 7295.4 Pa·K -12. 2 分 (2738)2738二级相变符合的爱伦菲斯方程式是: ( )(A ))/(d /d α∆∆=TV C T p V(B ))/(d /d α∆∆=TV C T p p(C )p p /ln(d )/(d /)α∆∆=TV C T V(D )p p /ln(d )/(d /)α∆∆=TV C T p3. 2 分 (1817)1817298 K 时,HCl(g,M r =36.5)溶解在甲苯中的亨利常数为245 kPa ⋅kg ⋅mol -1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:( )(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa4. 2 分 (2328)2328用什么仪器可以区分固溶体和低共熔混合物? ( )(A)放大镜 (B)超显微镜(C)电子显微镜 (D)金相显微镜5. 2 分 (1914)1914在恒温恒压下形成理想液体混合物的混合吉布斯自由能Δmix G ≠ 0,恒温下Δmix G 对温度T 进行微商,则: ( )(A) (∂Δmix G /∂T )T < 0(B) (∂Δmix G /∂T )T > 0(C) (∂Δmix G /∂T )T = 0(D) (∂Δmix G /∂T )T ≠ 06. 2 分 (2635)2635在二组分液体从高温冷却时,有时会产生包晶现象。

复旦物理化学1000题相平衡72
摘要:
一、引言
二、相平衡的定义和基本原理
三、相平衡的应用领域
四、相平衡在化学反应中的作用
五、相平衡对环境和经济的影响
六、结论
正文:
一、引言
相平衡是物理化学中的一个重要概念,涉及气相、液相和固相之间的相互转化。
在自然界和人类活动中,相平衡现象普遍存在,理解和掌握相平衡对于解决实际问题具有重要意义。
二、相平衡的定义和基本原理
相平衡是指在一定温度和压力下,多相体系中各相的组成和分布保持不变的状态。
相平衡的基本原理是热力学第二定律,即熵增原理。
在相平衡状态下,各相的熵值达到最大,且各相之间的化学势相等。
三、相平衡的应用领域
相平衡在许多领域有广泛应用,如地质学、材料科学、环境科学和化工等。
在地质学中,相平衡研究有助于揭示岩石相变、成矿作用等地质过程。
在材料科学中,相平衡原理可用于研究材料的制备、性能和稳定性等。
四、相平衡在化学反应中的作用
相平衡在化学反应中起关键作用。
在相平衡状态下,化学反应可以进行到最大限度,反应速率最大。
同时,相平衡也决定了化学反应的方向和限度。
五、相平衡对环境和经济的影响
相平衡现象对环境和经济发展具有重要影响。
例如,地球大气中的温室气体增加导致气候变暖,进而影响农业、水资源和生态系统。
此外,相平衡原理在石油、天然气和矿产资源开发中也有重要作用。
六、结论
相平衡是物理化学中的基本概念,具有广泛的应用价值。

物理化学答案——第五章-相平衡[1]第五章相平衡⼀、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙⽅程mmH dp dT T V ?=?相相(克拉贝龙⽅程,适⽤于任何纯物质的两相平衡)2ln mH d p dT RT=相(克劳修斯—克拉贝龙⽅程,适⽤与其中⼀相为⽓相,且服从理想⽓体状态⽅程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --?=?≈??(T b 为该液体的正常沸点)3.相律f+Φ=C+n C=S-R-R ′ f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压⼒有⼀个固定,f * 称为“条件⾃由度”)*4. Ehrenfest ⽅程2112()p p C C dpdT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数)基本概念1.相:体系中物理性质和化学性质完全均匀的部分,⽤Φ表⽰。
相的数⽬叫相数。
2.独⽴组分数C =S -R -R ′,S 为物种数,R 为独⽴化学反应计量式数⽬,R ′为同⼀相中独⽴的浓度限制条件数。
3.⾃由度:指相平衡体系中相数保持不变时,所具有独⽴可变的强度变量数,⽤字母 f 表⽰。
单组分体系相图相图是⽤⼏何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最⼩为零,Φ最多应为 3 ,因相数最少为 1 ,故⾃由度数最多为 2 。
在单组分相图中,(如图5-1,⽔的相图)有单相的⾯、两相平衡线和三相平衡的点,⾃由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙⽅程求得。
图5-1⼆组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最⼩为零,则Φ最多为 4 ,⽽相数最少为 1 ,故⾃由度最多为 3 。
为能在平⾯上显⽰⼆组分系统的状态,往往固定温度或压⼒,绘制压⼒-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,⾃然f*最⼩为 0 ,Φ最多为 3,所以在⼆组分平⾯图上最多出现三相共存。
物理化学习题三《相平衡、化学势与化学平衡》部分一 判断题1、二组分完全互溶双液系理想溶液,若P A *> P B *则Y A <X A ( ) 2、等温等压条件下,0>=∆∑BB B mr u v G 的化学反应一定不能进行。
( ) 3、一个含有K +、Na +、NO 3-及SO 42-离子的不饱和水溶液,其组分数K 为4。
( ) 4、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
( )5、在水的三相点,物种数S 和组分数C 相等,都等于1,自由度数等于F=0。
( )6、定温、定压及W /=0时,化学反应达平衡,反应物的化学势之和等于产物的化学势之和。
( ) 7、由CaCO 3(s)、CaO(s)、BaCO 3(s)、及CO 2(g )构成的平衡物系的自由度为0。
( ) 8、I 2(s )= I 2(g )平衡共存,因S = 2, R = 1, R /= 0所以C = 1。
( ) 9、对于放热反应C B A +=2,提高转化率的方法只能降低温度或减小压力。
( )10、下列反应的平衡常数0K 为22CO O C =+为01k ;222CO O CO =+为02K ;CO O C =+221为03K ,则三个平衡常数间的关系为:020103/k k k =。
( )11、某化学反应00<∆m r H ,00<∆m r S ,则反应的标准平衡常数10>K ,且随温度升高而减小。
( )12、反应)()()()(222323g CO g O H s CO Na s NaHCO ++=的平衡常数p K 与分解压力P 的关系为P/2。
( )13、反应)()(2)(42g CH g H C →+石墨,在873K 时的0m r H ∆=-8805.23J·mol -1,减小H 2的压力,可获得更大的平衡产率。
( )14、二元溶液中A 组分若在某浓度区间内服从拉乌尔定律,B 组分也必在该浓度区间内服从拉乌尔定律。
相平衡一.填空题2.A,B两液体混合物T-x图上出现最高点。
则该混合物对拉乌尔定律产生偏差,最高点的自由度为。
负、03.在一透明的真空容器中装入足够量的纯液体,若对其不断加热,可见到_现象,若使容器不断冷却,又可见到_现象。
临界、三相共存4.碳酸钠和水可形成三种水合物:,,。
在100k P a下,能与碳酸钠水溶液,冰平衡共存的含水盐有_种,这种(或这些)含水盐是。
5.碳在高温下还原氧化锌达到平衡后,体系中有五种物质存在,已知存在如下两个独立化学反应:则的平衡压力,之间的关系为_,组分数_,相数_,自由度数_,举出独立变量如下。
、T或p6.盐A B(s)与水可以形成以下几种稳定水合物:,,和,这个盐水体系的组分数_有个低共熔点,最多可有_相同时共存。
2、5、37.一体系如图6-26所示,其中半透膜只允许O2通过(左边存在反应),则此系统有_相,它们分别是_,该系统的自由度数为。
8.有理想气体反应在等温和总压不变的条件下进行,若原料气体中A与B的物质的量之比为1:2,达平衡时系统的组分数为C=,自由度数F=_,当温度一定时,增大压力则Kθ_(填增大,减小或不变)平衡将_移动(填向左,向右或不)。
C=1;F=0;不变;向右9.含有K2S O4和N a N O3的水溶液,其组分数C=_,若在温度一定的条件下,此系统最多能有相共存。
3;310.在密闭容器中,N a C l的饱和溶液与其水蒸气呈平衡,并且存在着从溶液中析出的细小N a C l晶体,则系统的组分数为C=,相数P,自由度数F=。
2;3;111.在101.325k P a外压下,水的沸点为100℃,氯苯的沸点为130℃,水和氯苯组成的完全不互溶系统的共沸点一定100℃;(填大于小于或等于)小于12.液相完全互溶的二组分系统气-液平衡相图及其蒸气压-组成曲线上若出现最高点,该点的气相组成为γB,液相组成为x B则γB x B(填大于小于或等于)等于13.碳酸钠和水可形成三种水合物:,,。
第六章 相平衡 章末复习一、内容提要1. 几个重要概念(1)相:系统内部物理和化学性质完全均匀的部分称为相。
相数(P ):系统中想的数目称为相数,用符号P 表示。
气态混合物:只有一个相;固体:一个固体就是一个相;液体:有一、二、三相。
(2)相图:用来表示多相系统的状态随温度、压力和组成变量的改变而改变的图形称为相图。
相图有平面相图和立体相图之分。
(3)自由度数(f ):能够维持现有系统的相数不变,而可以独立改变的温度、压力及组成等变量的数目称为自由度数,用符号f 表示。
(4)组分数(C ):系统的组分数等于系统中所有物种的数目S 减去独立的化学平衡数R ,再减去独立的限制条件'R ,即'C S R R =--(5)相律:表明自由度与组分数、相数及温度、压力之间的相互关系,用公式表示为2f C P =-+。
指定温度或压力时,*1f C P =-+;指定温度和压力时,**f C P =-2. 相图相图的识别:点、线和面水的三相点温度:273.16K ,压力:610.62Pa ,是水的特性,不随压力而改变。
水的冰点温度:273.15K ,压力:101325Pa , 随压力的改变而改变。
3. 克拉贝龙方程 d p H d T T V∆=∆ (适用于任何纯物质的两相平衡系统) 克劳修斯-克拉贝龙方程2ln d p H dT RT ∆= 或 211211ln ()p H p R T T ∆=- (适用于物质两相平衡,其中有一相为气相的系统)4. 二组分系统的相图两液体混合物对拉乌尔定律产生偏差情况:最大正偏差:在p x -图上,有最高点,在T x -图上,有最低点;最大负偏差:在p x -图上,有最低点,在T x -图上,有最高点。
5. 杠杆规则利用杠杆原理,求算任何两相区各相的量的方法称为杠杆规则。
如果横坐标用摩尔分数 表示,并已知混合物的总的物质的凉,则可以求出各相所含各组分的物质的量。
物理化学第六章相平衡习题一、选择题1. 若A和B能形成二组分理想溶液,且T B*>T A*,则A和B在达平衡的气、液相中的物质的量分数()。
(A) y A>x A,y B<x B;(B) y A<x A,y B>x B;(C) y A>x A,y B>x B;(D) y A<x A,y B<x B。
2. 液态完全互溶的两组分A、B组成的气液平衡系统中,在外压一定下,于该气液平衡系统中加入组分B(l)后,系统的沸点下降,则该组分在平衡气相中的组成y B()它在液相中的组成x B。
(A)大于(B)小于(C)等于(D)无法确定3. 在温度T下,CaCO3(s),CaO(s)及CO2的平衡系统压力为p,已知它们之间存在CaCO3(s)==CaO(s)+CO2(g)反应,若往该平衡系统中加入CO2(g), 当重新达到平衡时,系统的压力()。
(A)变大;(B)变小;(C)不变;(D)可能变大也可能变小。
4. A(低沸点)与B(高沸点)两种纯液体组成的液态完全互溶的气液平衡系统。
在一定温度下,将B(l) 加入平衡系统中时,测得系统的压力增大,说明此系统()。
(A)一定具有最大正偏差;(B)一定具有最大负偏差;(C)有可能是最大正偏差也有可能是最大负偏差;(D)数据不够,无法确定。
5. 组分A(s)与组成B(s)组成的凝聚系统相图中,若己知形成以下四种化合物:A2B(稳定),AB(稳定),AB2(不稳定),AB3(稳定)则该相图中有()最低共熔点和()条三相线。
(A) 3,3 (B)4,4 (C) 3,4;(D) 4,5。
6. 将克拉佩龙方程应用于H2O(s)和H2O(l)两相平衡,随着压力的增长,H2O的凝固点将()(A)升高(B)降低(C)不变(D)无法判断7. 将过量的NaHCO3(s)放入一真空密闭容器中,在50℃下,NaHCO3按下式进行分解:2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(g),系统达平衡后,则其组分数C=();F=()。
(A) 3,2;(B) 3,1;(C) 2,0;(D) 2,1。
8. 在上题中已达平衡的系统中加入CO2(g)时,系统重新达平衡后,则系统的组分数C=();F=()。
(A) 3,2;(B) 3,1;(C) 2,0;(D) 2,1。
9. 二元合金处于低共熔温度时体系的自由度为()。
(A) 0;(B) 1;(C) 2;(D) 3。
10.压力升高时,单组分体系的熔点将如何变化()。
:(A)升高;(B)降低;(C) 不变;(D)不一定。
11.硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在p下,能与硫酸水溶液共存的化合物最多有几种()。
:(A) 1 种;(B) 2 种;(C) 3 种;(D) 0 种。
12.在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为()。
(A) 1 ;(B) 2 ;(C) 3 ;(D) 0 。
13.NaCl水溶液和纯水,经半透膜达到渗透平衡,该体系的自由度数是()。
(A) F= 1 ;(B) F = 2 ;(C) F = 3 ;(D) F = 4 。
14.对于下列平衡系统:①高温下水被分解;②同①,同时通入一些H2(g) 和O2(g);③H2和O2同时溶于水中,其组分数C和自由度数F的值完全正确的是()。
(A) ①C = 1,F= 1 ②C = 2,F= 2 ③C = 3,F= 3 ;(B) ①C = 2,F= 2 ②C = 3,F= 3 ③C = 1,F = 1 ;(C) ①C= 3,F= 3 ②C = 1,F= 1 ③C = 2,F = 2 ;(D) ①C = 1,F= 2 ②C = 2,F= 3 ③C = 3,F = 3 。
15.在下列体系中自由度数F = 2的体系是()。
(A) 298K时,H2O(l)H2O(g) ;(B) S(s)S(l)S(g) ;(C) C2H5OH(l) 与H2O(l) 的混合物;(D) 一定量的PCl5(g) 分解平衡时:PCl5(g) = PCl3(g) + Cl2(g) 。
16.某体系中有Na2CO3水溶液及Na2CO3·H2O(s)、Na2CO3·7H2O(s)、Na2CO3·10H2O(s)三种结晶水合物。
在p 下,F=C-P+ 1 = 2 - 4 + 1 = -1,这种结果表明()(A)体系不是处于平衡态;(B) Na2CO3·10 H2O(s) 不可能存在;(C)这种情况是不存在的;(D) Na2CO3·7H2O(s) 不可能存在。
17.相图与相律之间是()(A)相图由实验结果绘制得出,相图不能违背相律;(B)相图由相律推导得出;(C)相图由实验结果绘制得出,与相律无关;(D)相图决定相律。
18.下列叙述中错误的是()(A) 水的三相点的温度是,压力是Pa ;(B) 三相点的温度和压力仅由系统决定,不能任意改变;(C) 水的冰点温度是0℃,压力是101325 Pa ;(D) 水的三相点F= 0,而冰点F = 1 。
19.Na2CO3可形成三种水合盐:Na2CO3·H2O、Na2CO3·7H2O、NaCO3·10H2O,在常压下,将Na2CO3投入冰-水混合物中达三相平衡时,若一相是冰,一相是Na2CO3水溶液,则另一相是()(A) Na2CO3;(B) Na2CO3·H2O ;(C) Na2CO3·7H2O;(D) Na2CO3·10H2O。
20.如图6-1,对于右边的步冷曲线对应是哪个物系点的冷却过程()(A) a点物系;(B) b点物系;(C) c点物系;(D) d点物系。
21.如图6-2,对于形成简单低共熔混合物的二元相图,当物系的组成为x,冷却到t℃时,固液二相的重量之比是()(A)w(s)∶w(l) = ac∶ab ;(B) w(s)∶w(l) = cb∶ab ;(C)w(s)∶w(l) = ac∶cb ;(D) w(s)∶w(l) = cb∶ac 。
22.如图6-3,对于形成简单低共熔混合物的二元相图,当物系点分别处于C、E、G点时,对应的平衡共存的相数为()。
(A) C点1,E点1,G点1 ;(B) C点2,E点3,G点1 ;(C) C点1,E点3,G点3 ;(D) C点2,E点3,G点3 。
23.在相图上,当物系处于哪一个点时只有一个相()(A) 恒沸点;(B) 熔点;(C) 临界点;(D) 低共熔点。
24.如图6-4,A与B是两组分恒压下固相部分互溶凝聚体系相图,图中有几个单相区()(A) 1个;(B) 2个;(C) 3个;(D) 4个。
25.有一形成不稳定化合物的双组分A与B凝聚体系,系统的组成刚巧与不稳定化合物的组成相同,当其从液态冷却到转熔温度,系统内建立如下平衡:液相+ A(s) = AxBy(不稳定化合物),如果在此时系统由外界吸取热时,则上述的平衡将()(A) 向左移动;(B) 向右移动;(C) 不移动;(D) 无法判定。
26.A与B可以构成2种稳定化合物与1种不稳定化合物,那么A与B的体系可以形成几种低共熔混合物()(A) 2种;(B) 3种;(C) 4种;(D) 5种。
27.如图6-5,A与B是两组分恒压下固相部分互溶凝聚体系相图,有几个两固相平衡区()(A) 1个;(B) 2个;(C) 3个;(D) 4个。
28.在第一种物质中加入第二种物质后,二者的熔点发生什么变化()(A) 总是下降;(B) 总是上升;(C) 可能上升也可能下降;(D) 服从拉乌尔定律。
29.如图6-6是FeO与SiO2的恒压相图,那么存在几个稳定化合物()(A) 1个;(B) 2个;(C) 3个;(D) 4个。
30.A及B二组分组成的凝聚体系能生成三种稳定的化合物,则于常压下在液相开始冷却的过程中,最多有几种固相同时析出()(A) 4种;(B) 5种;(C) 2种;(D) 3种。
31.在温度为T时,A(l) 与B(l) 的饱和蒸气压分别为和,A与B完全互溶,当xA = 时,pA = ,pB = ,则此二元液系常压下的T~x相图为:()32.两组分理想溶液,在任何浓度下,其蒸气压()(A) 恒大于任一纯组分的蒸气压;(B) 恒小于任一纯组分的蒸气压;(C) 介于两个纯组分的蒸气压之间;(D) 与溶液组成无关。
33.设A和B可析出稳定化合物A x B y和不稳定化合物A m B n,其T~x图如图6-7所示,其中阿拉伯数字代表相区,根据相图判断,要分离出纯净的化合物A m B n,物系点所处的相区是()(A) 9 ;(B) 7 ;(C) 8 ;(D) 10 。
34.液体A与B形成蒸气压正偏差很大的溶液,在精馏塔中精馏时,塔釜得到的是()(A) 恒沸混合物;(B) 纯A ;(C) 纯B ;(D) 纯A或纯B 。
35.图6-8是A、B两组分恒压下固相部分互溶凝聚体系相图,图中有几个两相区()(A) 1个;(B) 2个;(C) 3个;(D) 4个。
36.水蒸气蒸馏通常适用于某有机物与水组成的()(A) 完全互溶双液系;(B) 互不相溶双液系;(C) 部分互溶双液系;(D) 所有双液系。
37.A与B是两种互不相溶的两种液体,A的正常沸点80℃,B的正常沸点120℃。
把A、B混合组成一个体系,那么这个混合物的正常沸点为()(A) 小于80℃;(B) 大于120℃;(C) 介于80℃与120℃之间;(D) 无法确定范围。
38.体系中含有H2O、H2SO4·4H2O、H2SO4·2H2O、H2SO4·H2O、H2SO4,其组分数C为:()(A) 1;(B) 2;(C) 3;(D) 4。
39.在410 K,Ag2O(s)部分分解成Ag(s)和O2(g),此平衡体系的自由度为:()(A) 0 ;(B) 1 ;(C) 2 ;(D) -1。
40.一个水溶液包含n个溶质,该溶液通过一半透膜与纯水相平衡,半透膜仅允许溶剂水分子通过,此体系的自由度为()。
(A) n;(B) n-1;(C) n+1;(D) n+2。
41.绝热条件下,的NaCl加入的碎冰中,体系的温度将如何变化()(A) 不变;(B) 降低;(C) 升高;(D) 不能确定。
42.图6-9中,从P点开始的步冷曲线为()。
图6-943.图6-9中,生成固体化合物的经验式为()(A) CCl4·C4H10O2。
(B) CCl4·(C4H10O2)2。