氮气转变为氮氧化物的条件以及各种气体在水中的溶解度
- 格式:doc
- 大小:117.00 KB
- 文档页数:2

氮的氧化物溶于水的计算氮的氧化物指的是氮与氧元素形成的化合物,包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)。
这些化合物在大气中存在,并且会溶解于水中,通过以下计算可以了解氮的氧化物在水中的溶解性和相关的化学反应。
首先,我们来讨论一氧化氮(NO)。
一氧化氮是一种无色气体,其溶解度随温度和帕斯卡定律成正相关。
根据Henry定律,气体在液体中的溶解度与气体分压成正比。
换句话说,溶解度可以通过气体的分压来确定。
NO在水中的溶解度可以通过以下公式计算:溶解度(mol/L) = K * P其中,K是Henry定律的Henry常数,P是NO的分压。
当NO的分压为1 atm时,其在25°C下的溶解度约为0.0013 mol/L。
随着温度的升高,溶解度会增加,因为温度升高会使气体分压增加。
接下来,我们转向二氧化氮(NO2)。
二氧化氮是一种红棕色气体,其在水中会发生一系列复杂的反应。
首先,二氧化氮会与水反应生成硝酸(HNO3)和亚硝酸(HNO2):2NO2+H2O->HNO3+HNO2其中,硝酸是一种强酸,亚硝酸是一种较弱的酸。
此外,二氧化氮还可以通过以下反应转化为一氧化氮:2NO2<->2NO+O2最后,我们来讨论三氧化二氮(N2O3)。
N2O3+H2O->2HNO2与二氧化氮类似,硝酸是一种强酸,亚硝酸是一种较弱的酸。
总结起来,氮的氧化物在水中会发生一系列的化学反应,包括一氧化氮的溶解、二氧化氮和三氧化二氮的与水反应。
这些反应导致水溶液中存在硝酸和亚硝酸,这些化合物在环境中有重要的生物地球化学循环作用。
然而,需要注意的是以上只是理论计算,实际情况可能受到多种因素的影响,包括温度、压力、其他溶质的存在等。
因此,在实际实验中需要综合考虑这些因素来确定氮的氧化物在水中的溶解度和化学反应行为。


水在氮循环中的作用氮循环是指地球上氮元素在不同环境中的转化和循环过程。
水在氮循环中扮演着重要的角色,参与着氮的转化和迁移。
本文将从水的溶解作用、水的运输作用和水的化学反应作用三个方面来探讨水在氮循环中的作用。
一、水的溶解作用水是一种极好的溶剂,可以溶解许多物质,包括氮化合物。
在大气中,氮气(N2)可以通过闪电和紫外线照射等方式与氧气(O2)反应生成一氧化氮(NO)。
一氧化氮进一步与氧气反应形成二氧化氮(NO2),这些氮化物随着降雨被溶解在水中,形成硝酸(HNO3)和亚硝酸(HNO2)。
这些溶解在水中的氮化物称为氮酸盐,它们可以通过水的循环被输送到地表水和土壤中。
二、水的运输作用水是地球上最重要的运输介质之一,它可以将溶解在其中的氮酸盐从大气中带到地面。
降雨中的氮酸盐可以直接进入土壤,也可以通过水流进入河流、湖泊和海洋。
这些水体中的氮酸盐可以为水生生物提供营养,促进生物的生长和繁殖。
同时,水的流动还可以将氮酸盐从一个地区运输到另一个地区,实现氮元素的迁移和分布。
三、水的化学反应作用水在氮循环中还参与了一系列的化学反应。
在土壤中,水分解反应可以将硝酸根离子(NO3-)还原为一氧化氮和亚氮酸盐。
这些反应由土壤中的微生物催化,称为反硝化作用。
另一方面,水也可以促进氨氧化反应的进行。
氨氧化是指氨氧化细菌将氨氧化为亚硝酸盐的过程,这是氮循环中的一个重要步骤。
水的存在可以提供合适的环境条件和媒介,促进氨氧化反应的进行。
总结起来,水在氮循环中的作用主要体现在溶解作用、运输作用和化学反应作用三个方面。
水的溶解作用使得氮化合物能够从大气中溶解到水中,形成溶解态的氮酸盐。
水的运输作用通过降雨和水流的方式将氮酸盐从大气中带到地表水和土壤中,并实现氮元素的迁移和分布。
水的化学反应作用参与了反硝化和氨氧化等关键反应过程,调节着氮循环的速率和方向。
水的作用使得氮元素能够在不同的环境中进行转化和循环,维持着地球生态系统的平衡和稳定。


水中氮气溶解度嘿,各位小伙伴们!今天咱们来聊一个特别有意思的话题——水中氮气的溶解度。
别觉得这个话题很无聊,其实它可有趣了!就像是水和氮气在玩捉迷藏一样。
想象一下,氮气就像是一群调皮的小精灵,它们想要钻进水里玩耍。
但是水可不是那么好说话的房东,它对接纳这些小精灵可是有自己的规矩呢!水温对氮气溶解度的影响可大啦!当水变热的时候,这些氮气小精灵就变得特别活跃,就像是夏天的孩子们一样坐不住,纷纷从水里跑出来。
相反,水变凉了,它们就安静下来,乖乖待在水里。
这就是为啥冷水能溶解更多的氮气!压力也是个关键因素呢!压力越大,就像是有个看门大爷在使劲儿往下压,逼着氮气小精灵们往水里钻。
这就是为什么深海里溶解的氮气比表面水里多得多,那可真是挤破头也要往里钻啊!来个生动的例子吧!你们喝过汽水没?打开瓶盖时那些往上冒的气泡,就是因为压力突然变小,气体忍不住要往外跑。
氮气在水里也是这个道理,压力一小,立马就想溜之大吉!说到实际应用,这个知识可重要啦!比如说养鱼的同学要注意了,鱼缸里的水温变化会影响溶解氧气和氮气的量,可得照顾好那些小家伙们的"呼吸环境"。
还有潜水员们也得懂这个道理。
他们上浮的时候不能太快,要不然体内溶解的氮气会突然形成气泡,就像是摇晃过的汽水突然打开瓶盖,那可不是闹着玩的!自然界中的水循环也和氮气溶解度有关系。
海水蒸发时,溶解在里面的氮气就会重获自由,欢快地飞向天空。
这些小家伙们可真是自由自在,想进就进,想出就出!实验室里测定氮气溶解度的时候,可得小心翼翼的。
温度计要准确,压力要控制好,就像是在照顾一群挑剔的小宝贝。
稍有不慎,实验数据就会像调皮的小朋友一样到处乱跑。
有趣的是,不同的气体在水里的溶解度是不一样的。
比起氧气和二氧化碳,氮气在水里显得特别高冷,不怎么爱溶解。
这让我想起班上那个特别害羞的同学,总是独来独往的。
要是把水中氮气溶解度画成曲线图,那简直就像是过山车!随着温度和压力的变化,曲线上上下下,弯弯曲曲,看得人眼花缭乱。


氮氧化物的生成温度氮气和氧气在多少温度下,可以生成氮氧化物如果不通过放电的方式,纯粹升高温度的话,得在3000K以上,氮气和氧气可以自发反应生成NO(N2和O2 1:1的话,转化率高于50%)。
不过在实际中,大约1000度左右,氮气和氧气已经能够生成NO了(量很少,但在大气污染中不可忽视)。
氮氧化物(NOX)种类很多,包括一氧化二氮(N20)、一氧化氮(NO)、二氧化氮(NO2)、三氧化二氮(N203)、四氧化二氮(。
980。
天然气燃烧过程中氮氧化物如何产生的天然气本身不产生氮氧化物,只是燃烧温度很高,高温产生了氮氧化物,如果能够将燃烧点温度控制在800度以下,能够大幅度降低废气排放量,但是燃烧利用的效率也就降低了。
燃料锅炉氮氧化物排放控制技术目前控制氮氧化物应用最多的就是加药法,无论是在煤中混合还是利用除尘器都是采取“扑捉”技术,而没有抑制氮氧化物的生成。
在燃煤燃烧时,氮氧化物的生成温度一般大于900摄氏度,所以,近些年有人在研究低温燃烧技术,也就是“富氧燃烧”。
这样可以将燃烧温度会低于800摄氏度,有效的抑制氮氧化物的生成。
目前有的汽车发动机采用“均值稀薄燃烧技术”其目的之一也是为了降低氮氧化物的生成。
由于燃煤富氧燃烧的制氧成本较高、技术不算成熟,所以很少应用。
但这的确是发展方向。
暂时应用富氧燃烧技术的富氧量也只能控制在26-30%之间,再高就有些得不偿失了,也就是锅炉的净效率会下降。
燃煤锅炉炉温低于1000°有没有氮氧化物的产生有的,不过相对来说会少一些,这个你可以查相关的论文。
有个最鲜活的例子,循环流化床锅炉也就800多度温度,但是也有氮氧化物,只是相对煤粉炉要少一些,少一半吧。
焚烧处理如何控制氮氧化物的产生一、氮氧化物控制1降低焚烧区域的温度。
在1400度以上,空气中的N2即与O2反应生成。
氮氧化物是怎样形成的大气中闪电可以使氮气被氧化工厂里人工合成氨气,进而进行氧化形成氮氧化物和硝酸土壤中铵盐(可能来自于固氮菌或自然/人工的施肥)被微生物(一般是硝化细菌)氧化成硝酸盐,不过其中应该没有氮氧化物生成。

水中氮的转化水中氮的转化是自然界中非常重要的化学过程,它是生态系统中氮循环的一个重要组成部分。
氮是构成生命体的主要元素,但氮气对于大多数生物体而言并没有利用价值,只能靠一些特殊的细菌通过固氮将氮气转化为氨来供给生物体使用。
此外,水中也存在较多的有机和无机氮,这些氮化合物的转化和循环对于维护海洋生态系统的平衡也非常重要。
通过对水中氮的转化的深入探究,可以进一步认识氮的循环机制以及其在生态系统中的重要作用,从而更好地保护人类赖以生存的地球环境。
水中氮的主要形态在水中存在多种不同形式的氮化合物,一般来说,水中氮的主要形态包括无机氮和有机氮两类。
(1)无机氮:无机氮主要包括氨氮(NH3)、游离氮(N2)、硝态氮(NO3-)和亚硝态氮(NO2-)四种形式。
不同形式的无机氮对生物生长和海洋生态系统的影响各异。
氨氮:一般来说,水体中氨氮的来源多为生物体的代谢产物以及废水排放等。
氨氮对水体生态系统的影响较大,高浓度的氨氮会使水体酸化,增加植物和动物的毒性;低浓度的氨氮有利于植物的生长和繁殖,但过多过高的氨氮也会对水生生态造成不同程度的破坏。
亚硝态氮和硝态氮:亚硝态氮和硝态氮主要来源于氨氮和有机氮在水体中的氧化过程。
它们是生物体中常见的营养物质,对于植物和动物的生长和代谢起着重要的作用。
但在过度富营养化水体中,亚硝态氮和硝态氮含量过高,会催生藻类和水生植物大量繁殖,导致产生大量腐败物质,最终造成水体富营养化和缺氧等问题。
(2)有机氮:有机氮是指与碳形成复合结构的氮化合物,主要包括蛋白质、核酸、胆固醇等有机大分子化合物。
水中的有机氮来源比较复杂,包括动植物的尸体、废水排放、沉积物降解等。
有机氮是一种典型的有机肥料,可被细菌和蠕虫等分解为无机氮,从而为水中植物和动物的生长提供营养物质。
水中氮的转化水中氮的转化主要分为固氮、硝化和反硝化三个过程。
(1)固氮:固氮是指将氮气转化成有机氮的过程,是水体中氮的主要来源之一。
在自然条件下,大气中的氮气通过闪电、紫外线辐射等作用都可以进行氮气固氮反应。

氮循环的简单过程
氮循环是一项重要的生物过程,它指的是氮的在大气、植物、动物及其环境介质转移、转化的过程。
它把大气中的氮气转变成其它有机物,这是生物活动的必要组成部分。
在整个氮循环过程中,参与各氮迁移组分变化,如氮容量、氮富集率、氮物种类等,以及它们之间的条件转化。
氮循环的简单过程主要分为四个步骤:
1、大气氮氧化:大气中的氮气,主要是由电雷射技术利用氧化物将氮气氧化成氮氧化物。
2、氮磷关系:氮氧化物空气,又被称为磷氮关系,是通过植物、微生物、土壤等吸收,将氮氧化物转化为有机物或者无机物,同时空气中更多的磷也被吸收。
3、有机氮和无机氮转化:有机氮是指微生物利用光和碳水化合物制造氮化合物。
无机氮是指无机氮化合物在氧化过程中制成的化合物,诸如氮二氧化物等。
4、解毒:氮离子及其化合物参与植物合成,并被动植物所吸收,有助于植物的生长。
但是长期吸收会伤害植物,所以空气的脱氮及解毒技术是很重要的,以降低植物的污染。
氮循环是一项重要的生态过程,在环境生物学研究中占有重要地位,它不仅为生态系统的氮的生产和重组提供重要的参照,也为~~~大气环境污染的防治提供了有效策略。
通过不断对氮循环过程进行研究,可以有效促进环境治理工作,更好地维护环境质量。

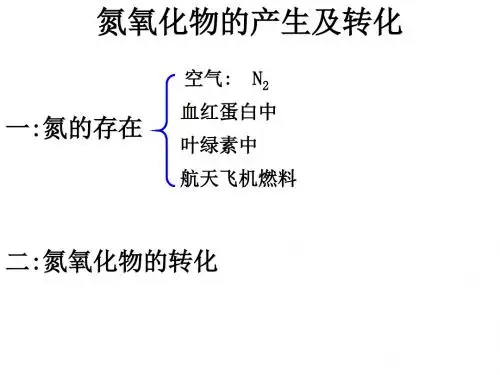
3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。
n2转化为nh3n2转化为NH3是氮循环的重要环节,在全球氮循环中占有重要地位,能够有效地促进环境的健康发展。
本文将对n2转化为nh3的原理、反应过程以及其在全球氮循环中的重要作用进行全面介绍。
N2转化为NH3是氮循环的一个环节,它的原理可以归结为表面的无机还原反应和生物的氨氧化反应。
无机还原反应是指N2分子表面在还原剂(如过氧化氢)的作用下发生一系列反应,不断减少N2分子表面的结合强度,形成NH3分子,从而实现N2子的还原;生物氨氧化反应则是指,细菌将氮气通过氨氧化反应转化为氨(NH2),经过酶活化氨和水的反应,最终形成NH3。
这两种反应合作来达到n2转化为nh3的目的。
在n2转化为nh3的反应过程中,有两个重要的步骤要进行。
首先,在氮气氧化过程中,需要用到氮气氧化酶,其主要作用是将氮气氧化为氨,从而制备氨氧化环境和氧气;之后,就是利用氨氧化反应将氨转化为氨水和水,以及通过氨水反应将其转化为NH3。
在这个过程中,还可以添加一些助剂,如铁,谷氨酸或硫脲来改善反应条件,从而有效提高n2转化的效率。
N2转化为NH3的重要作用在于它在氮循环中的重要作用。
在全球氮循环中,N2转化为NH3是将高层次的氮元素(N2)转化为低层次的氮元素(NH3)的过程,从而形成循环系统。
N2转化为NH3形成有机氮,在全球氮循环中促进环境的健康发展。
例如,有机氮可以作为土壤中植物的营养物质,可以改善植物的生长状况,更有利于植物和动物的发展;此外,它还可以扩大水域范围,增加土壤水分,从而提高土壤的肥力,使环境变得更加健康。
总之,N2转化为NH3是氮循环的一个重要环节,它的原理可以归结为表面的无机还原反应和生物的氨氧化反应。
它有助于将高层次的氮元素(N2)转化为低层次的氮元素(NH3),可以改善植物和动物的生长状况,同时还可以扩大水域范围,增加土壤水分,从而有助于环境的健康发展。
因此,氮循环的研究的继续发展,对可持续发展至关重要。
氮的循环一、氮气及氮的氧化物1.氮气(1)氮的固定使空气中的氮转化为的过程(2)氮气的性质①物理性质:无色无味的气体,难溶于水,在空气中约占总体积的78%①化学性质:N2化学性质很稳定,只在放电、催化剂等条件下才能发生化学反应。
a.人工固氮:(反应)b.高能固氮:①氮的氧化物有:【拓展补充】工业制法:工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气。
2.一氧化氮无色无味有毒气体,难溶于水,能与血红蛋白结合使人中毒,可以转化成NO2方程式:3. 二氧化氮(1)物理性质: 色有刺激性气味的有毒气体,能溶于水,(2)化学性质具有较强的氧化性,NO2能使湿润的淀粉KI试纸变蓝。
NO2+H2O=== 2NO2N2O44.雷雨肥庄稼原理:5.将充满NO2和O2试管倒置在水槽中恰好完全反应将充满NO和O2试管倒置在水槽中恰好完全反应6.氮的氧化物对环境的污染①形成,污染空气。
①形成酸雨。
①破坏臭氧层。
【拓展补充】空气中NO、NO2主要来源于煤和石油的燃烧(汽车发动机内温度很高,N2+O2=====2NO)、硝酸工厂等、细菌对含氮有机物的分解以及雷电。
实验室或工业上用NaOH 吸收NO、NO2:要求NO2、NO之比≥12NO2 +2NaOH = NaNO2 + NaNO3 + H2O NO+NO2 +2NaOH = 2NaNO2 + H2O;也可以用NH3来处理NO、NO2:8NH3 +6NO2 =7N2+12H2O 4NH3 +6NO=5N2+6H2O二、氨的性质1.物理性质氨气是色气味的气体,易液化可作制冷剂,常温、常压下,1体积的水可溶解体积氨气,可由实验证明。
2.氨的化学性质(1)与水的反应NH3+H2O NH3·H2O NH+4+OH-,氨气溶于水得氨水,氨水为可溶性一元弱碱,易挥发,不稳定,易分解:(2)氨气与酸反应①蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,有白烟生成,将浓盐酸改为__________,也会出现相同的现象,若改为硫酸不行,原因是硫酸①与CO2等酸性氧化物反应:NH3+CO2+H2O===NH4HCO3或2NH3+CO2+H 2O===(NH 4)2CO 3(3) NH 3的还原性——NH 3中氮元素的化合价为 ,是氮元素的最低价态, 只具有 氨的催化氧化3.实验室制取干燥NH 3的物质:实验室制取少量氨气的2种简易方法(如右图)图甲:加热浓氨水法反应原理:图乙的方法:4. 喷泉实验(1)成败的关键:①烧瓶要干燥。
物理性质氮在常况下是一种无色无味无嗅的气体,且通常无毒。
氮气占大气总量的78.12%(体积分数),在标准情况下的气体密度是1.25g·dm-3,氮气在标准大气压下,冷却至-195.8℃时,变成没有颜色的液体,冷却至-209.86℃时,液态氮变成雪状的固体。
氮气在水里溶解度很小,在常温常压下,1体积水中大约只溶解0.02体积的氮气。
它是个难于液化的气体。
在水中的溶解度很小,在283K时,一体积水约可溶解0.02体积的N2,氮气在极低温下会液化成白色液体,进一步降低温度时,更会形成白色晶状固体。
在生产中,通常采用灰色钢瓶盛放氮气。
化学性质氮分子结构式氮气的化学性质很稳定,常温下很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
氮气分子的分子轨道式为,对成键有贡献的是三对电子,即形成两个π键和一个σ键。
对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。
由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。
N2分子是已知的双原子分子中最稳定的,氮气的相对分子质量是28。
氮气结构式检验方法:将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧提取出燃烧剩下的灰烬(白色粉末Mg3N2),加入少量水,产生使湿润的红色石蕊试纸变蓝的气体(氨气)反应方程式:3Mg+N2=点燃=Mg3N2(氮化镁);Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑由氮元素的氧化态-吉布斯自由能图也可以看出,除了NH4离子外,氧化数为0的N2分子在图中曲线的最低点,这表明相对于其它氧化数的氮的化合物来讲,N2是热力学稳定状态。
氧化数为0到+5之间的各种氮的化合物的值都位于HNO3和N2两点的连线(图中的虚线)的上方,因此,这些化合物在热力学上是不稳定的,容易发生歧化反应。
在图中唯一的一个比N2分子值低的是NH4+离子。
氮气溶解度与温度的关系
氮气是一种常见的气体,在许多工业和实验室场合中被广泛使用。
氮气的溶解度是指氮气在水或其他溶液中的溶解程度。
溶解度受许多因素的影响,其中最重要的因素之一是温度。
一般来说,气体在液体中的溶解度随温度的升高而降低。
这也适用于氮气的溶解度。
当温度升高时,液体中的分子间距增加,液体中的气体分子的运动速度增加,从而使气体分子从液体中逃逸的速度增加。
因此,氮气的溶解度随温度升高而降低。
实际上,氮气的溶解度与温度之间的关系是非常复杂的。
在不同的压力下,氮气在水中的溶解度与温度的关系也不同。
此外,不同的溶液中氮气的溶解度与温度之间的关系也不同。
总的来说,氮气的溶解度与温度之间存在着一定的关系。
在实际应用中,我们需要根据具体情况进行测量和分析,以确保对氮气的使用和处理达到最佳效果。
- 1 -。
氮气转变为氮氧化物的条件以及各种气体在水中的溶解度
1 氮气转变为氮氧化物的条件
高温或者放电,都可以使氮气和氧气化合为NOx。
关于热力NOx的生成机理是高温下空气的N2氧化形成NO,其主成速度与燃烧温度有很大关系,当燃烧温度低于1400℃时热力NOx生成速度较慢,当温度高于1400℃反应明显加快,根据阿累尼乌斯定律,反应速度按指数规律增加。
这说明,在实际炉内温度分别不均匀的情况下,局部高温的地方会生成很多的NOx;并会对整个炉内的NOx生成量起决定性影响。
热力NOx的生成量则与空气过剩系数有很大关系,氧浓度增加,NOx生成量也增加。
当出现15%的过量空气时,NOx生成量达到最大:当过量空气超过15%时。
由于NOx被稀释,燃烧温度下降,反而会导致NOx生成减少。
热力NOx的生成还与烟气在高温区的停留时间有关,停留时间越长,NOx越多。
温度在1000~1200℃时,得到的产物主要是NO,高于1200℃时后,NO2产物才会出现。
2 各种气体在水中的溶解度详见下表
请注意:当温度在80~100℃下,CO在水中只有微量的溶解,而CO2已经没有溶解度,亦即在稍高温度CO2在水中已经不溶解。
表中的符号意义如下。
α——吸收系数,指在气体分压等于101.325 kPa时,被一体积水所吸收的该气体体积(已折合成标准状况);
l——是指气体在总压力(气体及水气)等于101.325 kPa时溶解于1体积水中的该气体体积;q——是指气体在总压力(气体及水气)等于101.325 kPa时溶解于100 g水中的气体质量(单位:g)。
气体在水中的溶解度
The Aquatic Solubilities of Gases。