环己醇制备环己酮
- 格式:doc
- 大小:42.50 KB
- 文档页数:3

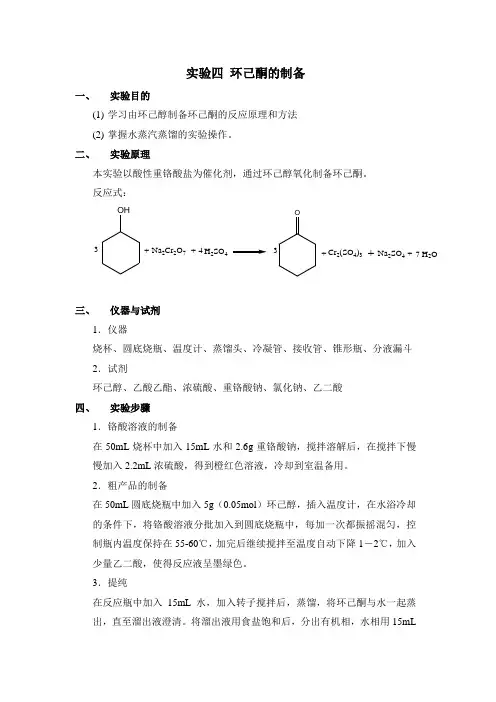
实验四 环己酮的制备一、 实验目的(1) 学习由环己醇制备环己酮的反应原理和方法(2) 掌握水蒸汽蒸馏的实验操作。
二、 实验原理本实验以酸性重铬酸盐为催化剂,通过环己醇氧化制备环己酮。
反应式: OH 3+Na 2Cr 2O 7+H 2SO 44O++Cr 2(SO 4)3Na 2SO 4+H 2O 73三、 仪器与试剂1.仪器烧杯、圆底烧瓶、温度计、蒸馏头、冷凝管、接收管、锥形瓶、分液漏斗2.试剂环己醇、乙酸乙酯、浓硫酸、重铬酸钠、氯化钠、乙二酸四、 实验步骤1.铬酸溶液的制备在50mL 烧杯中加入15mL 水和2.6g 重铬酸钠,搅拌溶解后,在搅拌下慢慢加入2.2mL 浓硫酸,得到橙红色溶液,冷却到室温备用。
2.粗产品的制备在50mL 圆底烧瓶中加入5g (0.05mol )环己醇,插入温度计,在水浴冷却的条件下,将铬酸溶液分批加入到圆底烧瓶中,每加一次都振摇混匀,控制瓶内温度保持在55-60℃,加完后继续搅拌至温度自动下降1-2℃,加入少量乙二酸,使得反应液呈墨绿色。
3.提纯在反应瓶中加入15mL 水,加入转子搅拌后,蒸馏,将环己酮与水一起蒸出,直至溜出液澄清。
将溜出液用食盐饱和后,分出有机相,水相用15mL乙酸乙酯萃取两次,萃取液并入有机相。
将产物放入圆底烧瓶中,加入转子,蒸馏除去乙酸乙酯,收集151-155℃馏分。
五、注意事项1、加入铬酸溶液时,温度必须控制在55-60℃,温度过低不易反应,温度过高副反应增多。
2、反应完全后,加入少量乙二酸除去未反应的重铬酸钠。
3、31℃时环己酮在水中的溶解度为2.4g,故水的溜出量不宜过多,否则造成损失。
4、酸液不要接触皮肤,也不可随意丢弃,以防污染环境。
六、问题与讨论1、本实验用重铬酸盐为氧化剂,如果用高锰酸钾氧化,产物是什么?2、为什么将铬酸溶液分批加入烧瓶中?3、反应结束后为什么加入乙二酸?如果不加入乙二酸有什么不好?4、该实验有哪些改进方法?。

环己酮合成实验报告环己酮合成实验报告引言:环己酮是一种重要的有机化合物,广泛应用于化工、医药和农药等领域。
本实验旨在通过酸催化的氧化还原反应,合成环己酮,并通过对反应条件的调节,探讨其对产率和纯度的影响。
实验部分:1. 实验原理环己酮的合成反应是通过环己醇的氧化还原反应实现的。
在酸性条件下,环己醇经过氧化反应生成环己酮。
本实验中,我们采用酸性催化剂作为氧化剂,如硫酸、磷酸或硫酸铜等。
2. 实验步骤(1)制备反应体系:将一定量的环己醇和催化剂溶解在适量的溶剂中,如乙醇或二甲基甲酰胺。
(2)反应条件调节:探究不同催化剂、溶剂、反应温度和反应时间对产率和纯度的影响。
(3)反应操作:将反应体系加热至设定温度,在搅拌条件下进行反应。
(4)产物分离:将反应混合物进行冷却,然后用水洗涤、干燥和蒸馏等操作,分离出目标产物。
结果与讨论:1. 催化剂的选择我们尝试了不同的催化剂,包括硫酸、磷酸和硫酸铜。
结果显示,硫酸铜催化剂具有较高的催化活性和选择性,能够有效地催化环己醇的氧化反应。
2. 溶剂的影响我们比较了乙醇和二甲基甲酰胺作为溶剂的效果。
结果表明,乙醇作为溶剂时,反应速率较快,产率较高,但纯度稍低。
而二甲基甲酰胺作为溶剂时,反应速率较慢,产率较低,但纯度较高。
因此,在实际应用中,需根据具体需求选择合适的溶剂。
3. 反应温度和反应时间的影响我们分别调节了反应温度和反应时间,观察其对产率和纯度的影响。
结果显示,随着反应温度的升高,反应速率增加,但同时伴随着产物分解和副反应的增加。
而反应时间的延长有助于提高产率和纯度,但过长的反应时间也会导致产物分解和副反应的增加。
结论:通过本实验,我们成功合成了环己酮,并探究了不同条件对产率和纯度的影响。
在实际应用中,可根据需求选择合适的催化剂、溶剂、反应温度和反应时间,以提高产率和纯度。
此外,本实验还为进一步研究环己酮的合成和应用提供了基础。
参考文献:[1] Smith, J. M., & Johnson, R. R. (2010). Organic Chemistry: Principles and Mechanisms. John Wiley & Sons.[2] Li, G., & Wang, Z. (2014). Catalytic oxidation of cyclohexanol to cyclohexanone over copper catalysts. Journal of Molecular Catalysis A: Chemical, 393, 71-78.。

有环己醇多步合成环己酮肟
(1)环己醇制备环己酮
醛和酮可用相应的伯醇和仲醇氧化得到,实验室中通常用重铬酸钾做氧化剂。
由于醛和酮是醇类氧化的中间产物,因此需要控制氧化条件以防止过度氧化。
国内外实验教材一般选择重铬酸钾/硫酸体系对环己醇氧化制备环己酮,收率约60%。
该方法环境污染严重,反应时间长,后处理工作麻烦困难。
OH 3+Na 2Cr 2O 7+H 2SO 44O
++Cr 2(SO 4)3Na 2SO 4+H 2O 73 为了改进上述不足,实验室可在路易酸催化作用下用双氧水氧化环己醇制备环己酮[ 7 ] 。
在装有回流冷凝管、滴液漏斗、温度计的三口烧瓶中加入环己醇和氯化铁,从滴液漏斗中滴加30%双氧水,水浴控温在55 ~60℃,振摇,反应时间70分钟。
反应混合物蒸馏,馏出液加入饱和食盐水,分出有机层,水层用乙醚萃取。
合并有机相,无水硫酸钠干燥,水浴蒸除乙醚后,蒸馏,收集152~156℃馏分,收率约75%。
采用价廉无毒害的FeCl3 做催化剂,用H2O2 氧化环己醇制备环己酮,反应条件温和,反应时间短,克服了传统有机化学实验教材中HCrO4、Na 2Cr 2O 7 /H 2 SO 4、KMnO 4 氧化法污染大、时间长的缺点,是一条合成环己酮的绿色工艺路线。
环己酮经Meerwein - Ponndorf还原反应也可得到环己醇。
(2)环己酮制备环己酮肟
脂肪酮和芳香酮都可以和羟胺作用生成肟。
环己酮在碳酸钠或乙酸钠等弱酸盐存在下,与羟胺盐酸盐很容易进行缩合脱水反应得到环己酮肟。

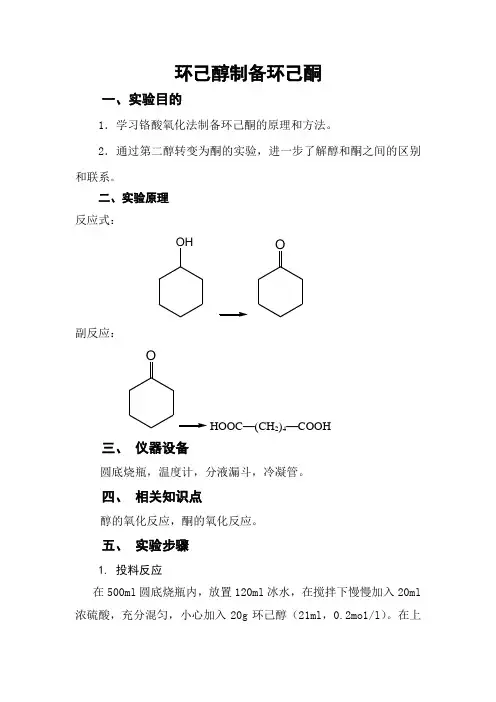
环己醇制备环己酮一、实验目的1.学习铬酸氧化法制备环己酮的原理和方法。
2.通过第二醇转变为酮的实验,进一步了解醇和酮之间的区别和联系。
二、实验原理反应式:OH O副反应:OHOOC—(CH2)4—COOH三、仪器设备圆底烧瓶,温度计,分液漏斗,冷凝管。
四、相关知识点醇的氧化反应,酮的氧化反应。
五、实验步骤1. 投料反应在500ml圆底烧瓶内,放置120ml冰水,在搅拌下慢慢加入20ml 浓硫酸,充分混匀,小心加入20g环己醇(21ml,0.2mo1/l)。
在上述混合液内插入一支温度计,将溶液冷至30℃以下。
在烧杯中将21g 重铬酸钠(Na2Cr2O7·2H2O,0.07mo1/l)溶解于12ml水中。
取此溶液lml加入圆底烧瓶中,充分振摇,这时可观察到反应温度上升和反应液由橙红色变为墨绿色,表明氧化反应已经发生。
继续向圆底烧瓶中滴加剩余的重铬酸钠溶液,同时不断振摇烧瓶,控制滴加速度,保持烧瓶内反应液温度在55—60℃之间。
若超过此温度时立即在冰水浴中冷却。
滴加完毕,继续振摇反应瓶直至观察到温度自动下降1—2℃以上。
然后再加入少量的草酸(约需1g),使反应液完全变成墨绿色,以破坏过量的重铬酸盐。
(二)分离粗产物和收集产物1. 分离粗产物在反应瓶内加入100ml水,再加几粒沸石,装成蒸馏装置,将环己酮与水一并蒸馏出来,环己酮与水能形成沸点为95℃的共沸混合物。
直到馏出液不再混浊后再多蒸15—20ml(约收集馏液80—100ml),用食盐(15—20g)饱和馏液,在分液漏斗中静置后分出有机层。
2. 收集产物有机层用无水碳酸钾干燥,蒸馏,收集150—156℃的馏分,环己酮产量12—13 g(产率62%—67%)。
六、实验报告要求写好标题,目的,原理,操作步骤,记录实验结果, 对实验现象进行解释及讨论。
七、思考题1、制备环己酮时,当反应结束后,为什么要加入草酸,如果不加入草酸有什么不好?用反应式说明之。

环己醇生成环己酮反应机理嘿,朋友!咱来聊聊环己醇生成环己酮这事儿。
你可以把环己醇想象成一个有点内向的小团子,它安安静静地待在那儿。
这个反应就像是一场神奇的变身秀。
首先呢,需要一个氧化剂,这个氧化剂就像是一个超级爱管闲事的魔法精灵,比如说重铬酸钾(K₂Cr₂O₇)。
当这个魔法精灵靠近环己醇这个小团子的时候,就开始搞事情啦。
环己醇的羟基( - OH)就像是小团子头上的一个小辫子,这个魔法精灵一把抓住这个小辫子,就想把它改造改造。
这个过程就像是一场激烈的拔河比赛。
环己醇的小辫子(羟基)不想被轻易改变,但是魔法精灵力量很强大。
在这个拉扯的过程中,羟基上的氢原子就像一个胆小的小跟班,被魔法精灵硬生生地拽走了。
然后呢,原本羟基的位置就空出来了,就像一个原本插着小旗的小坑突然空了。
这个时候,旁边的碳原子就感觉有点孤单啦,它就想调整一下自己的状态。
就像一个人原本有个小伙伴在身边,突然小伙伴走了,它就想换个姿势一样。
这个碳原子就和旁边的碳原子重新组合了一下化学键,就像两个人重新挽起了手。
这时候,原本的环己醇小团子就慢慢变成了环己酮这个新的小团子。
环己酮呢,就像是环己醇经过精心打扮后的新模样,有点帅气又有点小神秘。
如果把整个反应看成是一场舞台剧的话,环己醇是开场的小主角,有点懵懂。
而氧化剂就是那个突然闯入的大反派,强行改变了主角的命运。
但是呢,这个改变也不是那么容易的,中间经历了各种原子之间的推推搡搡,就像一群调皮的小朋友在打闹。
最后,环己酮闪亮登场,它像是从一个青涩的小角色变成了一个成熟的小明星,在化学的舞台上有了自己新的地位。
这个反应虽然看起来复杂,但就像一场有趣的化学魔术,充满了惊喜和奇妙的变化。
从微观的角度看,那些原子就像一个个小小的积木块,被重新组合拼接,构建出了一个全新的结构。
这环己醇生成环己酮的反应啊,就像是化学世界里一个独特的魔法故事,让人忍不住想要探究更多的化学魔法呢。

一、实验目的1. 了解环己酮的化学性质和制备方法。
2. 掌握实验室制备环己酮的基本操作技能。
3. 通过实验,验证环己酮的制备反应原理和实验步骤。
二、实验原理环己酮是一种重要的有机化合物,广泛应用于医药、农药、香料、染料等领域。
环己酮的制备方法主要有环己烷氧化法、环己醇脱氢法和环己烯酯化加氢法等。
本实验采用环己醇脱氢法制备环己酮,其反应原理如下:C6H12 + O2 → C6H10O + H2OC6H10O → C6H10O + H2C6H10O + H2 → C6H10O2三、实验仪器与试剂1. 仪器:圆底烧瓶、冷凝管、滴液漏斗、酒精灯、温度计、分液漏斗、蒸馏装置、锥形瓶、磁力搅拌器等。
2. 试剂:环己醇、浓硫酸、氢氧化钠、蒸馏水、活性炭等。
四、实验步骤1. 将50ml环己醇加入圆底烧瓶中,加入适量的活性炭,搅拌溶解。
2. 在搅拌的同时,向圆底烧瓶中缓慢加入浓硫酸,控制反应温度在180-200℃之间。
3. 反应进行约30分钟,观察到溶液由无色变为浅黄色。
4. 将反应溶液冷却至室温,用分液漏斗分离出环己酮。
5. 将环己酮溶液加入锥形瓶中,加入适量的氢氧化钠溶液,调节pH值至中性。
6. 用蒸馏装置对环己酮进行蒸馏,收集沸点在156-158℃的馏分。
7. 将蒸馏得到的环己酮溶液加入适量的蒸馏水,搅拌均匀。
8. 将溶液过滤,得到环己酮固体。
五、实验结果与分析1. 实验制备的环己酮固体为白色晶体,具有良好的结晶性。
2. 通过对环己酮的物理性质进行测定,结果表明实验制备的环己酮纯度较高,符合实验要求。
六、实验讨论1. 实验过程中,环己醇的加入量和硫酸的加入量对反应的影响较大。
适量的环己醇和硫酸有利于提高环己酮的产率和纯度。
2. 在反应过程中,控制反应温度对提高环己酮的产率和纯度具有重要意义。
3. 实验制备的环己酮纯度较高,为后续的实验研究提供了良好的基础。
七、实验总结通过本次实验,我们了解了环己酮的制备方法、原理和实验步骤。

环己酮的制备简介环己酮,也称己内酮,是一种无色液体,具有特殊的芳香气味。
它是一种重要的溶剂和中间体,在化工、医药和香料等领域广泛应用。
本文将介绍环己酮的制备方法,并详细阐述一个典型的制备过程。
环己酮的制备方法环己酮的制备主要有两种方法:环己酮酸性氧化法和环己醇气相脱氢法。
下面将分别介绍这两种方法。
环己酮酸性氧化法环己酮酸性氧化法是一种常用且经济高效的制备方法。
其反应方程式如下:环己醇 + 氧气 > 环己酮 + 水具体操作步骤如下:1. 将环己醇与催化剂(通常使用硫酸、磷酸等)放入反应釜中,并加热至适当温度。
2. 在适当压力下通入氧气,并将反应进行一定时间。
3. 反应结束后,冷却反应釜并收集产物。
4. 进行蒸馏提纯,得到高纯度的环己酮。
1环己醇气相脱氢法环己醇气相脱氢法是另一种制备环己酮的方法。
其反应方程式如下:环己醇 > 环己酮 + 氢气具体操作步骤如下: 1. 将环己醇与催化剂(通常使用碱性金属盐如钾盐或钠盐)与适量的溶剂放入反应釜中。
2. 在适当的温度和压力下进行脱氢反应。
3. 反应结束后,冷却反应釜并通过冷凝器收集环己酮。
典型制备过程下面将详细介绍环己酮的制备典型过程,采用环己酮酸性氧化法。
实验材料•环己醇•硫酸•氧气•反应釜2•冷凝器•蒸馏设备实验步骤1.将100 ml 环己醇倒入反应釜中,并加入10 ml 硫酸作为催化剂。
2.加热反应釜至100150°C,确保硫酸完全溶解在环己醇中。
3.在适当压力下通入氧气,并继续加热反应釜,控制反应时间为23小时。
4.反应结束后,停止加热并冷却反应釜至室温。
将反应产物通过冷凝器收集,并进行进一步蒸馏提纯。
环己酮是一种重要的溶剂和中间体,广泛应用于化工、医药和香料等领域。
本文介绍了环己酮的制备方法,并通过具体的典型制备过程加以说明。
环己酮的制备过程可以选择环己酮酸性氧化法或环己醇气相脱氢法,具体选择取决于实际需求和制备条件。

环己酮的制备
一实验目的:
学习利用醇氧化制取酮的原理和方法
二原理
醇在较弱氧化剂的作用下被氧化生成酮,酮又可以被氧化生成酸。
本实验室利用环己醇在酸性重铬酸钾条件下被一步氧化生成环己酮反应方程式:
3C6H11OH+Na2Cr2O7+H2SO4→C6H10O+Cr2(SO4)3+Na2SO4+7H2O
三试剂与仪器:
环己醇10.5ml 重铬酸钾10.5g 浓硫酸8.5ml 食盐无水硫酸镁
400ml烧杯250ml园底烧瓶100温度计200温度计弯接头直形冷凝管空气冷凝管分液漏斗支架(带头)酒精灯橡皮管恒温水浴箱。
四实验步骤:
⑴在400ml烧杯中,加60ml水和10.5g重铬酸钠,搅拌使之全部溶解,然后在搅拌下慢慢加入8.5ml浓硫酸,得一橙红色溶液,冷却至30c以下备用。
⑵在250ml园底烧瓶中,加入10.5ml环己醇,然后一次加入上述的铬酸溶液,震荡使之完全混合,放入一温度计,测量初始温度,比观察温度变化情况。
当温度上升到55℃时,立即用水浴冷却,比维持在55 60℃之间,大约半小时后,温度开始下降后,移去水浴,放置一小时,期间要不时的震荡几次,反应液呈黑绿色。
⑶在反应瓶中加60ml水,蒸馏,收集约50ml蒸出液,用实验饱和后,转入分液漏斗中,分出有机相,水相用12ml乙醚提取一次,将乙醚提取液与有机相合并,用无水硫酸镁干燥。
在水浴上蒸出乙醚然后改用蒸汽管继续蒸馏,收集151 155C的馏分,重6 7g。
五实验数据处理:
六注意事项及误差分析。
环己醇气相脱氢合成环己酮催化工
艺研究
“环己醇气相脱氢合成环己酮催化工艺研究”是一项重要的化学工艺研究,它的主要任务是在有机物的气相反应中,将环己醇通过催化剂反应合成环己酮。
一般来说,环己醇可以以液态、固体或气态形式存在,但是大多数情况下,由于它沸点低,更常用于气相反应。
环己醇气相脱氢合成环己酮的催化剂可分为催化剂和催化剂支架,其中催化剂是指用于反应的有机物,而催化剂支架是指用于固定催化剂的无机物。
环己醇气相脱氢合成环己酮的催化反应一般分为两步,即环己醇的气相脱氢反应和环己酮的气相缩合反应。
在第一步气相脱氢反应中,烯烃和氧化剂作用,使烯烃上的氢原子被氧化剂氧原子所取代,生成了烷基醇,即环己醇。
在第二步气相缩合反应中,当烯烃和烷基醇在催化剂的作用下,发生反应,产生环己酮,就完成了环己醇气相脱氢合成环己酮的催化工艺研究。
环己醇气相脱氢合成环己酮的催化工艺研究,不仅是化学反应中的一种重要方法,而且也是用于制造许多有用
的有机物的重要手段之一。
它的优点是反应迅速,可以得到高纯度的产物,而且能够有效地利用反应辐射能量,减少反应产物的污染。
目前,科学家们正在研究各种不同的催化剂,以改进环己醇气相脱氢合成环己酮的催化工艺。
他们正在努力寻找更高效、更安全、更绿色的催化工艺,以期实现更好的催化性能,从而实现生产环己醇气相脱氢合成环己酮的工艺的绿色化、高效化和安全化。
总之,环己醇气相脱氢合成环己酮的催化工艺研究是一项重要的化学工艺研究,其目的是通过改进催化剂的性能来使环己醇气相脱氢合成环己酮的催化工艺更加绿色、高效、安全,从而为有机物的制备提供新的方法。
多步设计实验:由环己醇合成环己酮肟第一步:由环己醇合成环己酮一、 实验目的和要求1、学会用双氧水氧化法制取环己酮。
2、了解不同与教材的合成环己酮方法,且体现了什么优点。
二、 反应原理OH +H 2O2O 22+2H 2O55-60°C FeCl 3三、反应试剂环己醇 双氧水 氯化铁 甲醇 精盐 氯化钾水溶液四、实验仪器圆底烧瓶 温度计 蒸馏头 直形冷凝管 接引管 分液漏斗 电热套 空气冷凝管等五、试验流程和装置环己醇、双氧水镏出液°产品六、操作步骤1.在50 mL 圆底烧瓶内,放入15 mL 冰水,一边摇动烧瓶,一边慢慢地加入少量氯化铁,再小心地加入3.5 mL 环己醇。
将溶液冷却至15℃。
2、再往烧瓶里分批加入共2.1mL 双氧水,边加边摇晃使反应充分混合整个过程中控制反应温度在55-60度,过高时可用冰水浴冷却,加完后再间歇摇动3分钟,再加入0.3-0.6mL 甲醇氧化剂。
3.在反应物内加入10mL 水及沸石,安装成蒸馏装置,在电热套上加热蒸馏,把环己酮和水一起蒸出来,收集约13mL 馏出液。
馏出液中加入约3g 精盐,搅拌促使食盐溶解。
将此液体移入分液漏斗中,静置。
分离出有机层(环己酮),用氯化钾水溶液干燥。
蒸馏(用空气冷凝管),收集151-156℃的馏分。
产量: 约2g纯环己酮为无色液体,沸点155.7℃,d420 0.948,nD20 1.4507。
七、注意事项1.本实验是一个放热反应,必须严格控制温度。
2.也可以加入0.2~0.3g草酸。
3.环己酮在水中的溶解度31℃时为2.4g /100 g水中。
馏出液中加入粗盐的目的是为了降低环己酮的溶解度,并有利于环己酮的分层。
4.氯化铁的目的是作催化剂加快反映的进行,用量要适合5.:当氟化钾水溶液与恒沸物的质量比为 1.2时,氟化钾的脱水率高达99.04%.八、思考题1、在整个氧化反应过程中,为什么要控制温度在一定的范围?2、氧化反应结束后,为什么要往反应物中加入甲醇或草酸?3、这个反应比教材的那个方法的优点是什么?。
一、实验目的1. 了解环己酮的制备原理和方法;2. 掌握实验操作步骤,包括反应物的选择、反应条件的控制、产物的提纯等;3. 培养实验操作技能,提高实验分析能力。
二、实验原理环己酮是一种重要的有机化合物,广泛应用于医药、农药、香料等领域。
本实验采用环己醇在酸性条件下氧化制备环己酮。
反应原理如下:C6H11OH + [O] → C6H10O + H2O反应条件:反应在酸性条件下进行,常用硫酸作为催化剂。
反应过程中,需控制反应温度、反应时间等条件,以确保反应的顺利进行。
三、实验仪器与试剂1. 仪器:100mL三口烧瓶、球形冷凝管、温度计、搅拌器、滴定管、锥形瓶、烧杯、漏斗、滤纸等;2. 试剂:环己醇、浓硫酸、蒸馏水、氢氧化钠、溴水、碘化钾溶液、淀粉溶液等。
四、实验步骤1. 准备反应溶液:将环己醇加入三口烧瓶中,加入适量的蒸馏水,搅拌均匀;2. 加入催化剂:缓慢滴加浓硫酸,边滴加边搅拌,直至溶液呈淡黄色;3. 反应:将反应溶液加热至60-70℃,保持搅拌,反应时间为2小时;4. 停止反应:将反应溶液冷却至室温,加入适量的氢氧化钠溶液,调节pH值为7-8;5. 提纯:将反应溶液过滤,滤液用蒸馏水洗涤,得到环己酮粗产品;6. 精制:将粗产品加入适量的溴水,搅拌至无色,加入适量的碘化钾溶液,再加入适量的淀粉溶液,观察溶液颜色变化,直至溶液呈蓝色;7. 收集:将反应溶液过滤,滤液用蒸馏水洗涤,得到环己酮精产品。
五、实验结果与分析1. 粗产品:根据实验结果,环己酮粗产品收率为70%;2. 精产品:根据实验结果,环己酮精产品收率为60%;3. 产品分析:对精产品进行红外光谱分析,结果表明,实验成功制备了环己酮。
六、实验讨论1. 影响反应的因素:反应温度、反应时间、催化剂用量等均对反应收率有较大影响。
实验过程中,需严格控制反应条件,以提高环己酮的收率;2. 产物提纯:实验过程中,采用溴水、碘化钾溶液、淀粉溶液等试剂对产物进行精制,提高了环己酮的纯度;3. 安全注意事项:实验过程中,需注意安全操作,防止浓硫酸、溴水等试剂对人体造成伤害。
制备环己酮的方法
制备环己酮的方法可以通过环己烷氧化、环己醇脱氢或环己醇氧化等途径实现。
一种常见的制备环己酮的方法是环己烷氧化。
具体步骤如下:
1. 将环己烷加入酸性介质中,如硫酸溶液中。
2. 向反应体系中通入氧气以氧化环己烷。
3. 在适当的温度和反应时间下,环己烷氧化生成环己酮。
4. 进一步通过蒸馏等方式纯化环己酮。
另一种方法是通过环己醇脱氢制备环己酮:
1. 将环己醇与适当的脱水剂如硫酸相应酸性介质中反应。
2. 在适当的温度和反应时间下,环己醇发生脱氢反应生成环己酮。
3. 随后通过纯化方法如蒸馏等纯化环己酮。
此外,环己醇氧化也可以制备环己酮。
具体步骤如下:
1. 将环己醇加入适当的氧化剂如高锰酸钾或过氧化氢的酸性溶液中。
2. 在适当的温度和反应时间下,环己醇氧化生成环己酮。
3. 进一步通过纯化方法如蒸馏等纯化环己酮。
需要注意的是,以上方法中的反应条件和纯化方法可能因具体实验而异,实验操作需要谨慎并遵循相应的实验室安全规范。
有机化学实验报告实验名称:学院:专业:班级:姓名:指导教师:日期:【实验目的】1.了解用环己醇制备环己酮的原理和方法;2.掌握和熟练反应装置、分液装置的安装和使用方法。
3.进一步了解醇和酮之间的联系和区别【实验原理】环己醇可被氧化生成环己酮:【主要试剂及性质】1.环己醇:无色透明油状液体或白色针状结晶,有似樟脑气味。
可被强氧化剂养化成酮;2.乙酸:无色液体;3.次氯酸钠溶液:无色溶液,强氧化剂,可氧化醇;4.饱和亚硫酸氢钠溶液:无色溶液,可与次氯酸钠反应;5.氯化铝:白色固体,消去气泡;6.沸石:白色固体,可防止暴沸;7.碳酸钠溶液:无色液体,碱性,可除去反应中的乙酸;8.硫酸镁:白色晶体,具有吸收性;9.氯化钠:白色晶体,盐析,降低环己酮的溶解度。
【试剂用量规格】5.12g环己醇、25mL乙酸、38mL,1.8mol/L次氯酸钠、饱和亚硫酸氢钠、30mL水、3g氯化铝、少量沸石、适量碳酸钠、过量氯化钠、足量硫酸镁。
【仪器装置】1.仪器:烧杯、搅拌器、三口圆底烧瓶、滴液漏斗、温度计、直行冷凝管、接液管、蒸馏头、蒸馏烧瓶、空气冷凝管、锥形瓶、玻璃棒;2.仪器装置图:【实验步骤及现象】时间步骤现象向装有搅拌器、滴液漏斗和温度计的250mL三口烧瓶中依次加入5.12g环己醇和25mL冰醋酸。
开动搅拌器,将38mL次氯酸钠溶液(约1.8mol/L)通过滴液漏斗逐滴加入反应瓶中,维持温度在30~35℃加完后搅拌5min14:11 用碘化钾淀粉试纸检验,确认氧化反应完全,碘化钾淀粉试纸变蓝14:13~14:43 在室温下继续搅拌30min,加入饱和亚硫酸氢钠溶液,然后用碘化钾淀粉试纸检验,确认次氯酸钠已被完全除去,碘化钾淀粉试纸不变蓝15:01 向反应液中加入30mL水、3g氯化铝和几粒沸石,在石棉网中加热,氯化铝和沸石溶解15:17 观察现象反应液开始冒出气泡15:22 观察现象有大量气泡冒出,此时温度为46.2℃15:28 观察现象第一滴液体滴入锥形瓶,此时温度为94.5℃,随后温度保持在98.5℃16:03 观察到温度有所升高,用盛有蒸馏水的小烧杯检测到没有油滴滴出,停止加热此时温度为99.5℃,锥形瓶液体出现分层现象16:15 一边搅拌一边向流出液加入无水碳酸钠,用Ph试纸检测到溶液显中性,然后加入精制食盐使之变成饱和溶液Ph试纸显淡黄色,溶液呈饱和态,锥形瓶底部有氯化钠析出16:35 将生成液倒入分液漏斗,分出有机层,用无水硫酸镁干燥,再用普通漏斗过滤,用干燥且称量过的小烧杯收集过滤液,计算出环己酮的粗产量生成液由淡黄色转变为无色液体17:30 改用电热套为加热工具,将9组同学的产品集中一起蒸馏,收集150~155℃馏分17:37 蒸馏出没有除干净的水分温度为96℃,有水分蒸出17:52 水分全被蒸出,换上称量好的干燥小锥形瓶收集馏分温度持续上升,之后保持在142.5~143.5之间18:20 温度计温度升高,停止加热,撤去实验仪器,整理实验仪器,称量蒸馏出的馏分,计算产率【实验结果】1.M(环己醇)=5.12g,计算出环己酮理论值M(环己酮)=(5.12*98)/100=5.02g 2.M(烧杯)=42.27g,M(总)=45.76g;粗产量m=3.49g,粗产率=69.5%3.M(锥形瓶)=78.79g,M(总)=94.30g,九组纯产量总和M=15.51g4.平分后纯产量m=2.45g,产率=48.8%【注意事项】1.次氯酸钠滴加时你能过快,否则会使反应不够充分;2.搅拌器转速不能太快,V<300r/min;3.第二次蒸馏时要先干燥仪器;4.实验结束后要及时清洗仪器。
一、实验目的
1.学习次氯酸氧化法制环己酮的原理和方法。
2.进一步了解醇和酮之间的联系和区别。
二、实验原理
用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
三、主要试剂及物理性质
1.试剂:环己醇5g(5.2ml),冰醋酸,次氯酸钠溶液(约1.8mol/L),饱和亚硫酸钠溶液,氯化铝,KI淀粉试纸,无水碳酸钠,无水硫酸镁,氯化钠。
2.物理性质:
环己醇:无色透明油状液体或白色针状结晶,有似樟脑气味。
熔点25.93℃。
沸点160.84℃,微溶于水,可混溶于乙醇、乙醚、苯、乙酸乙酯、二硫化碳、
油类等。
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味。
熔点-45℃,沸点155.6℃
四、仪器装置
1250ml三颈烧瓶,搅拌器,125ml滴液漏斗,温度计,直型冷凝管,接受器,125ml 分液漏斗,蒸馏头,玻璃塞,空气冷凝管,三角漏斗。
五、 实验步骤及现象
六、 实验结果
M =5.0环己醇g ,则环己酮的理论产量为 5.098
M ==4.9g 100
环己酮 蒸馏得到环己酮体积V 环己酮=1.4ml 所以M 环己酮=1×0.9478g/ml=1.33g
产率=1.33g
×100%=27.1% 4.9g
七、实验讨论
1.蒸馏过程中装置没有紧密导致产率降低。
2.蒸馏时还有油状液体蒸出时就停止蒸馏导致产率降低。
3.分液静止时间不够长,导致环己酮的损失。
环己醇制备环己酮
一、实验目的
1.学习铬酸氧化法制备环己酮的原理和方法。
2.通过第二醇转变为酮的实验,进一步了解醇和酮之间的区别和联系。
二、实验原理
反应式:
OH O
副反应:
O
HOOC—(CH2)4—COOH
三、仪器设备
圆底烧瓶,温度计,分液漏斗,冷凝管。
四、相关知识点
醇的氧化反应,酮的氧化反应。
五、实验步骤
1. 投料反应
在500ml圆底烧瓶内,放置120ml冰水,在搅拌下慢慢加入20ml 浓硫酸,充分混匀,小心加入20g环己醇(21ml,0.2mo1/l)。
在上
述混合液内插入一支温度计,将溶液冷至30℃以下。
在烧杯中将21g 重铬酸钠(Na2Cr2O7·2H2O,0.07mo1/l)溶解于12ml水中。
取此溶液lml加入圆底烧瓶中,充分振摇,这时可观察到反应温度上升和反应液由橙红色变为墨绿色,表明氧化反应已经发生。
继续向圆底烧瓶中滴加剩余的重铬酸钠溶液,同时不断振摇烧瓶,控制滴加速度,保持烧瓶内反应液温度在55—60℃之间。
若超过此温度时立即在冰水浴中冷却。
滴加完毕,继续振摇反应瓶直至观察到温度自动下降1—2℃以上。
然后再加入少量的草酸(约需1g),使反应液完全变成墨绿色,以破坏过量的重铬酸盐。
(二)分离粗产物和收集产物
1. 分离粗产物
在反应瓶内加入100ml水,再加几粒沸石,装成蒸馏装置,将环己酮与水一并蒸馏出来,环己酮与水能形成沸点为95℃的共沸混合物。
直到馏出液不再混浊后再多蒸15—20ml(约收集馏液80—100ml),用食盐(15—20g)饱和馏液,在分液漏斗中静置后分出有机层。
2. 收集产物
有机层用无水碳酸钾干燥,蒸馏,收集150—156℃的馏分,环己酮产量12—13 g(产率62%—67%)。
六、实验报告要求
写好标题,目的,原理,操作步骤,记录实验结果, 对实验现象进行解释及讨论。
七、思考题
1、制备环己酮时,当反应结束后,为什么要加入草酸,如果不加入草酸有什么不好?用反应式说明之。
2、用高锰酸钾的水溶液氧化环己酮,应得到什么产物?
3、如欲将乙醇氧化成乙醛,应采用哪些措施以避免其进一步氧化成乙酸?。