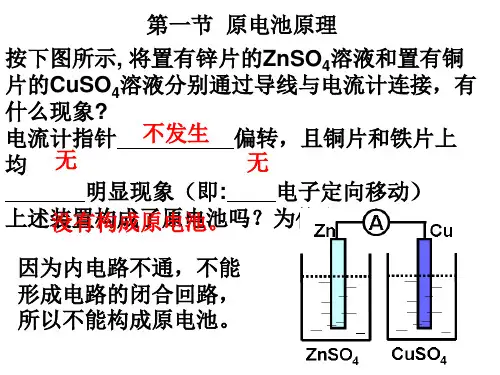
人 教 版 高 二 化学选 修四: 原电池 PPT
4、原电池电极的判断
特性 负极 电子流出 相对活泼 失电子 发生氧化反应 正极 电子流入 相对不活泼 得电子 发生还原反应
1、根据定义来判断:电子流出的一极是负极;电子 流入的一极是正极。 2、根据反应类型来判断:发生氧化反应的一极是负 极;发生还原反应的一极是正极。 3、根据电极活泼性来判断:一般来说,较活泼的一 极是负极;较不活泼的一极是正极。 4、根据离子流向来判断:阴离子移向的一极是负极; 阳离子移向的一极是正极。
人 教 版 高 二 化学选 修四: 原电池 PPT
例5:在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为 0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为 0.015 mol,溶液 的pH值为__4_-_lg_3__.7_5_?(溶液体积变化忽略不计)
示意图
联系
通常两种腐蚀同时存在,但以后者更普遍。
(3)钢铁腐蚀的防护
1、改变金属的内部组织结构:如将Cr、Ni等金属加 进钢里制成合金钢。
2、金属表面覆盖保护层:如油漆、油脂等,电镀 (Zn,Cr等易氧化形成致密的氧化物薄膜)作保护层。 原理:隔绝金属与外界空气、电解质溶液的接触。
3、电化学保护法——牺牲阳极的阴极保护法 原理:形成原电池反应 时,让被保护金属做正 极,不反应,起到保护 作用;而活泼金属反应 受到腐蚀。
人 教 版 高 二 化学选 修四: 原电池 PPT
人 教 版 高 二 化学选 修四: 原电池 PPT
例1:下列叙述中,可以说明金属甲比乙活泼性强的是( C )
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出 B.在氧化还原反应中,甲比乙失去的电子多 C.将甲乙作电极组成原电池时甲是负极 D.同价态的阳离子,甲比乙的氧化性强