18年春高中化学第1章原子结构与元素周期律1.3.2预测同主族元素的性质课时训练鲁科版必修2
- 格式:doc
- 大小:92.04 KB
- 文档页数:5


2021-4-29 20XX年复习资料教学复习资料班级:科目:第2课时 预测同主族元素的性质[学习目标] 1.能根据学习过的一些典型元素的性质预测同主族其他元素的性质。
2.学会运用元素周期表学习元素化合物知识的方法。
一、卤族元素性质的相似性与递变性[自主学习]1.第ⅦA 族元素原子结构和性质的相似性(1)原子的最外电子层都有□017个电子。
(2)最高正价除F 外均显□02+7价,最低负价为□03-1价。
(3)气态氢化物的通式为□04HX(X 表示卤素)。
(4)最高价氧化物对应的水化物的通式为□05HXO 4(F 除外),且都具有很强的□06酸性。
(5)在氧化还原反应中,它们的单质常做□07氧化剂。
2.性质的递变性写出证明卤族元素单质的氧化性由上到下逐渐减弱的离子方程式。
提示:Cl 2+2Br -===Br 2+2Cl -,Cl 2+2I -===I 2+2Cl -,Br 2+2I -===I 2+2Br -。
[点拨提升]1.卤素单质性质的相似性(1)与H 2反应:X 2+H 2==============一定条件2HX(I 2与H 2的反应为可逆反应)。
(2)与活泼金属(如Na)反应:2Na +X 2=====点燃2NaX 。
(3)与H 2O 反应①X 2+H 2O HX +HXO(X =Cl 、Br 、I);②2F 2+2H 2O===4HF +O 2。
2.卤素单质性质的递变性(1)氧化性与还原性随着原子序数的递增:卤素单质的氧化性逐渐减弱,卤素阴离子的还原性逐渐增强。
①单质间的置换反应Cl 2+2Br -===Br 2+2Cl -,Cl 2+2I -===I 2+2Cl -,Br 2+2I -===I 2+2Br -。
②卤素单质与变价金属(如Fe)反应时,F 2、Cl 2、Br 2生成高价卤化物(如FeX 3),而I 2只能生成低价卤化物(如FeI 2)。
(2)与H 2反应的难易及氢化物稳定性随着原子序数的递增,与H 2反应越来越难,生成的氢化物的稳定性逐渐减弱。







鲁科版高一化学必修2第一章第三节元素周期表的应用第2课时预测同主族元素的性质§1-3 元素周期表的应用(第2课时)预测同主族元素的性质一、【教材分析】(一)知识脉络在学过原子结构、元素周期律和元素周期表之后,结合《化学1(必修)》中学习的大量元素化合物知识,通过对第3周期元素原子得失电子能力强弱的探究,整合ⅧA族元素及其化合物的性质,以及对金属钾性质的预测等一系列活动,归纳得出同周期、同主族元素的性质递变规律,体会元素在周期表中的位置、元素的原子结构、元素性质(以下简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习、科学研究和生产实践。
(二)知识框架本节教学知识内容主要包括三个部分,即三个课时完成。
一是认识同周期元素性质递变外规律;二是预测同主族元素的性质递变规律分两个课时完成学习任务;三是“位、构、性”关系规律及应用。
本课时的是第二课时。
(三)与其它版本教材区别人教版教材是在元素周期表基础上,根据第ⅠA族和第ⅦA族元素性质的递变通过归纳得出元素周期律;而鲁科版教材则是在学过元素周期律和元素周期表之后,让学生根据原子结构理论预测第3周期、第ⅠA族和第ⅦA族元素原子得失电子能力的递变规律和金属钾性质,再通过自己设计实验去验证。
教材这样处理旨在培养学生的探究能力,引导学生学会运用元素周期律和元素周期表来指导化学学习和科学研究。
我认为这一点更符合学生认知规律。
(四)本课时地位和作用第二课时更是利用第一课时掌握的研究问题的方式方法的基础上,进一步探究同主族的规律,从而进一步完善元素周期表元素性质的相似性和递变性规律。
为第三课时研究“位、构、性”打下坚实基础。
二、【学情分析】本节是鲁科版《化学2(必修)》第一章《原子结构和元素周期律》第三节,元素周期表的应用。
本章第一节和第二节的内容主要介绍了原子结构、元素周期律和元素周期表的知识,学生已经掌握原子核外电子排布的规律和元素周期律的知识,认识了元素周期律是原子核外电子排布周期性变化的必然结果,元素周期表是周期律的具体表现形式,初步了解了元素周期表的意义和重要用途,知道了元素周期表是今后学习化学和进行科学研究的重要工具。




[核心素养发展目标] 1.宏观辨识与微观探析:能从原子结构的角度理解原子半径、元素第一电离能之间的递变规律,能利用递变规律比较原子(离子)半径、元素第一电离能的相对大小。
2.证据推理与模型认知:通过原子半径、元素第一电离能递变规律的学习,建立“结构决定性质”的认知模型,并能利用该认知模型解释元素性质的规律性和特殊性。
一、原子半径1.原子半径的影响因素及递变规律(1)影响因素(2)递变规律1同周期:从左到右,核电荷数越大,半径越小(稀有气体除外)。
2同主族:从上到下,电子层数越多,半径越大。
2.离子半径的大小比较(1)电子层结构相同的离子,核电荷数越大,半径越小。
例如:r(O2—)>r(F—)>r(Na+)>r(Mg 2+)>r(Al3+)。
(2)带相同电荷的离子,电子层数越多,半径越大。
例如:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2—)<r(S2—)<r(Se2—)<r(Te2—)。
(3)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。
例如:r (Cl—)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
(4)核电荷数、电子层数均不相同的离子可选一种离子参照比较。
例如,比较r(K+)与r(Mg2+)可选r(Na+)为参照,r(K+)>r(Na+)>r(Mg2+)。
例1(2018·聊城二中高二月考)下列对原子半径的理解不正确的是()A.同周期元素(除稀有气体元素外)从左到右,原子半径依次减小B.对于第三周期元素,从钠到氯,原子半径依次减小C.各元素的原子半径总比其离子半径大D.阴离子的半径大于其原子半径,阳离子的半径小于其原子半径【考点】微粒半径的大小与比较【题点】微粒半径的大小与比较的综合答案C解析同周期元素(除稀有气体元素外),随原子序数增大,原子核对核外电子吸引增大,原子半径减小,A、B项正确;原子形成阳离子时,核外电子数减少,核外电子的排斥作用减小,故阳离子半径小于其原子半径;而原子形成阴离子时,核外电子的排斥作用增大,阴离子半径大于其原子半径,C项错误,D项正确。

第2课时预测同主族元素的性质[学习目标定位] 1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.能根据学习过的一些典型元素的性质预测同主族其他元素的性质。
4.了解元素周期表的应用。
一、卤族元素原子结构与性质的相似性和递变性1.卤族元素原子结构和性质的相似性2.卤族元素性质的递变性(1)卤族元素单质的物理性质及递变性(2)卤素单质与H2的反应(3)卤素单质间的置换反应归纳总结卤族元素性质的递变性关键提醒(1)42易和水发生反应)。
(2)卤素元素气态氢化物的酸性从上到下逐渐增强。
氢氟酸为弱酸,其余为强酸。
1.下列关于ⅦA族元素的说法中不符合递变规律的是( )A.F2、Cl2、Br2、I2的氧化性逐渐减弱B.F-、Cl-、Br-、I-的还原性逐渐增强C.HF、HCl、HBr、HI的热稳定性逐渐减弱D.HF、HCl、HBr、HI水溶液的酸性逐渐减弱2.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )A.与H2化合能力:At2>I2B.砹在常温下为白色固体C.砹原子的最外电子层上有7个电子D.砹能从NaCl溶液中置换出氯单质二、碱金属元素原子结构与性质的相似性与递变性1.碱金属元素原子结构和性质的相似性原子的最外电子层都有____个电子,最高化合价均为____价,都是活泼的金属元素,单质都能与氧气、水等物质发生反应,在自然界中以________形式存在,最高价氧化物对应的水化物一般具有很强的________。
2.碱金属元素性质的递变性(1)已知 1.4 g锂在空气中加热充分反应,可生成 3.0 g氧化物,该反应的化学方程式是________________________________________________________________________。
(2)将一坩埚加热,同时取一小块金属钾擦干表面的煤油后,迅速投到热坩埚中,观察到的现象是____________,若与钠在空气中燃烧现象相比较,其结论是_________________________ ________________________________________________________________________。



第二节原子结构与元素的性质一、元素周期律、元素周期系和元素周期表1.元素周期律:元素性质随着原子核电荷数递增发生周期性的递变。
2.元素周期系:按其原子核电荷数递增排列的序列称为元素周期系。
这个序列中的元素性质随着核电荷数递增发生周期性重复。
3.元素周期表:呈现元素周期系的表格。
【注】元素周期系只有一个,元素周期表多种多样。
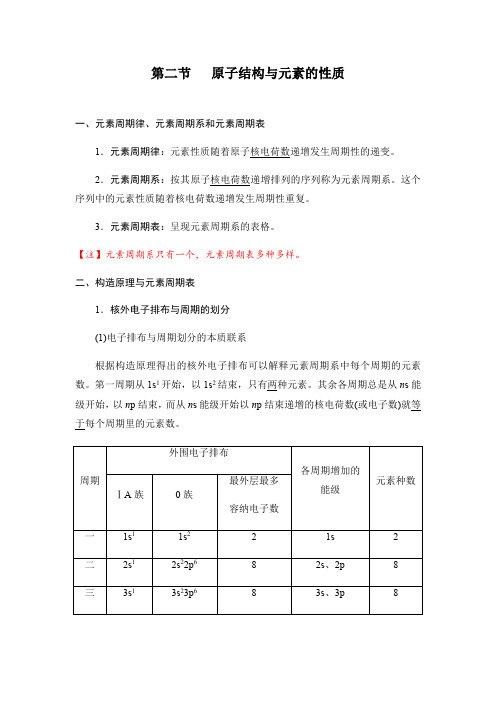
二、构造原理与元素周期表1.核外电子排布与周期的划分(1)电子排布与周期划分的本质联系根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。
第一周期从1s1开始,以1s2结束,只有两种元素。
其余各周期总是从n s能级开始,以n p结束,而从n s能级开始以n p结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
(2)规律:①周期序数=电子层数。
②本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分(1)划分依据:取决于原子的价电子数目和价层电子排布。
(2)特点:同族元素的价电子数目和价层电子排布相同。
(3)规律①对主族元素,同主族元素原子的价层电子排布完全相同,价层电子全部排布在n s 或n s 、n p 轨道上(见下表)。
价层电子数 = 族序数。
③稀有气体元素:价电子排布为n s2n p6(He除外)。
三、元素周期表1.元素周期表的结构2.元素周期表的分区(1)根据核外电子排布根据核外电子排布式中最后填入电子的能级符号可把周期表里的元素划分成4个区:s区、p区、d区和f区(除ΙB、ⅡB族外。
)(2)根据元素金属性与非金属性①金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
②处于d区、ds区和f区的元素全部是金属元素。
s区的元素除氢外,也全部是金属元素。
【注】p区元素价电子不都是n s2n p1~6,如He元素的价电子为2s2。
第2课时预测同主族元素的性质课时训练7 预测同主族元素的性质基础夯实1.下列关于同主族元素的说法中错误的是( )A.同主族元素原子序数递增,元素原子失电子能力逐渐增强B.同主族元素原子序数递增,单质氧化性逐渐增强C.同主族元素原子最外层电子数都相同D.同主族元素的原子半径,随原子序数增大而逐渐增大答案:B2.已知钾在空气中燃烧生成KO2。
自然界中仅存在极微量的金属钫(Fr),它的已知同位素都有放射性,它是碱金属元素中密度最大的元素。
根据它在周期表中的位置预言其性质,其中不正确的是( )A.在已知元素中(稀有气体除外),它具有最大的原子半径B.在空气中燃烧时,生成氧化物Fr2OC.氧化物的水化物是极强的碱D.单质的失电子能力比钠强答案:B解析:根据同主族和同周期元素性质递变规律可知,原子半径最大的元素位于周期表的左下角,即钫,A正确;碱金属元素从上到下,失电子能力逐渐增强,D正确;由于Na在氧气中燃烧生成Na2O2,K在氧气中燃烧生成KO2,据此可知,Fr在空气中燃烧应生成比Fr2O更复杂的氧化物,B错误。
3.我国在砷化镓太阳能电池研究方面处于国际领先地位。
砷(As)和镓(Ga)都是第4周期元素,分别属于ⅤA和ⅢA族。
下列说法中,不正确的是( )A.原子半径:Ga>As>PB.热稳定性:NH3>PH3>AsH3C.酸性:H3AsO4>H2SO4>H3PO4D.Ga(OH)3可能是两性氢氧化物答案:C解析:元素的非金属性越强,其相应的最高价含氧酸的酸性越强,所以酸性:H2SO4>H3PO4>H3AsO4,故C项错误。
4.X、Y是元素周期表ⅦA族中的两种元素。
下列叙述中能说明X的得电子能力比Y强的是( )A.X原子的电子层数比Y原子的电子层数多B.与H2化合的能力X<YC.X的气态氢化物比Y的气态氢化物稳定D.Y的单质能将X从NaX的溶液中置换出来答案:C解析:ⅦA族元素,原子的电子层数越大,得电子能力越弱,越难与H2化合,所以选项A、B错误;气态氢化物的稳定性、非金属单质之间的置换关系,是判断非金属性强弱的依据,选项D错误。
5.导学号52140073下列叙述中正确的是( )A.同周期元素的原子半径ⅦA族的为最大B.在周期表中0族元素的单质全部是气体C.ⅠA、ⅡA族元素的原子,其半径越大越难失去电子D.所有主族元素的原子形成单核离子时的最高价数都和它的族序数相等答案:B解析:本题可根据同周期、同主族元素的性质递变规律来分析判断,同周期元素从左到右元素的原子半径逐渐减小,则同周期元素的原子半径以ⅦA族的为最小;ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子;所有主族元素的原子形成单核离子时的最高价数不一定和它的族序数相等,如氧、氟无正价。
6.下列叙述不正确的是( )A.H2S、H2O、HF的稳定性依次增强B.RbOH、KOH、Mg(OH)2的碱性依次减弱C.Na+、Mg2+、Al3+的氧化性依次减弱D.H2SiO3、H2CO3、H2SO4酸性依次增强答案:C解析:Na+、Mg2+、Al3+的核外电子排布完全相同,因核电荷数依次增大,故原子核对外层电子的吸引能力依次增大,得电子能力增强,氧化性逐渐增强,只有C项错误。
7.下列事实正确,且能说明氟元素的非金属性比氯元素强的是( )①HF比HCl稳定②F2能与NaCl溶液反应生成Cl2③HF的酸性比HCl的强④F2的氧化性比Cl2的强⑤F2与氢气化合比Cl2与氢气化合容易⑥HF的还原性比HCl的弱A.①③⑤B.②④⑥C.①②③D.①④⑤⑥答案:D解析:元素的单质与氢气越容易化合,元素的氢化物越稳定,其非金属性越强,①⑤符合题意;氢化物的酸性强弱不能作为判断元素非金属性强弱的依据,且氢氟酸为弱酸,盐酸为强酸,③不符合题意;非金属单质间的置换反应可以说明非金属性的强弱,但F2通入NaCl溶液中与水反应生成氧气,不能生成氯气,②不符合题意;对应阴离子或氢化物的还原性越强,其非金属单质的氧化性越强,对应非金属性越强,④⑥符合题意。
8.短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示。
M元素原子的最外层电子数为其次外层电子数的2倍。
X、Y、Z三种元素原子质子数之和为32。
则下列说法正确的是( )A.M元素无负化合价B.原子半径:M>X>Y>ZC.Y的最高价氧化物的化学式为YO2D.Z元素无正化合价答案:D解析:M元素原子的核外电子排布为,则M为碳。
设在X、Z中间的元素的原子序数为m,则X、Z、Y的原子序数分别为m-1、m+1、m+8,由题意可得(m-1)+(m+1)+(m+8)=32,解得m=8,即X为N、Y为S、Z为F。
C元素在化合物中有-4价,如CH4中,A错;原子半径:S>C>N>F,B错;S 的最高价氧化物的化学式为SO3,C错;F只有负价没有正价,D对。
9.导学号52140074W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。
下列说法正确的是( )A.单质的沸点:W>XB.阴离子的还原性:W>ZC.氧化物的水化物的酸性:Y<ZD.X与Y不能存在于同一离子化合物中答案:B解析:因为W、X、Y、Z均为短周期主族元素,由原子核外L电子层电子数分别为0、5、8、8可知,W为氢元素,X为氮元素,又因为它们的最外层电子数之和为18可知,Y与Z的最外层电子数之和为12,Z的原子序数大于Y,所以Y是磷元素,Z是氯元素。
氢气和氮气均为分子晶体,相对分子质量大的沸点高,故A项错误;氢元素的非金属性弱于氯元素,所以阴离子的还原性W>Z,B项正确;未指明最高价氧化物的水化物,不能判断酸性的强弱,C项错误;氮与磷可以存在于同一离子化合物中,如磷酸铵,D项错误。
10.元素周期表对化学研究和生产实践具有十分重要的意义,请将下表中A、B两栏的内容用各自的序号对应起来。
答案:②⑤⑥④③①解析:根据教材“元素周期表在指导生产实践中的作用”的介绍,即可作答。
能力提升11.导学号52140075现有部分短周期元素的性质或原子结构如下表:(1)元素X的一种同位素可用于测定文物年代,这种同位素的符号是。
(2)元素Y与氢元素形成一种离子Y,写出某溶液中含该微粒的检验方法:。
(3)元素Z与元素T相比,得电子能力较强的是(用元素符号表示),下列表述中能证明这一事实的是。
①常温下Z的单质和T的单质状态不同②Z的氢化物比T的氢化物稳定③一定条件下Z和T的单质都能与氢氧化钠溶液反应(4)探寻物质的性质差异性是学习的重要方法之一。
T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是,理由是。
答案:(1 C (2)在溶液中加入NaOH溶液然后加热,用湿润的红色石蕊试纸检验产生的气体,如果试纸变蓝,证明溶液中含N(3)Cl ②(4)H2CO3H2CO3是弱酸解析:(1)由题意知T为硫,X为碳,Y为氮,Z为氯。
碳元素的一种核素C可用于测定文物年代。
(2)常利用铵盐与碱共热产生碱性气体NH3的方法检验N的存在。
(3)元素Cl与S相比,非金属性较强的应为Cl,可用对应的氢化物的稳定性进行比较。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物依次是H2SO4、H2CO3、HNO3、HClO4,其中H2CO3是弱酸。
12.(1)在短周期元素中,与水反应最剧烈的金属单质是(请用化学式填写,下同);元素的气态氢化物最稳定的是;元素的最高价氧化物对应的水化物中碱性最强的是;元素的最高价氧化物对应的水化物中酸性最强的是。
(2)短周期元素中,原子半径最大的非金属元素的原子是(填元素符号)。
答案:(1)Na HF NaOH HClO4(2)Si13.下表是元素周期表的一部分,回答下列有关问题:(1)在①~元素中,金属性最强的元素是,非金属性最强的元素是,最不活泼的元素是。
(均填元素符号)(2)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a.常温下⑦的单质和⑧的单质状态不同b.⑧的氢化物比⑦的氢化物稳定c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应(3)第3周期中原子半径最大的元素是(填元素符号),跟它同周期的原子半径最小的元素是(填元素符号),它们可以形成的化合物的化学式为。
答案:(1)K F Ar (2)Cl b (3)Na ClNaCl解析:由题目给出的各元素在元素周期表中的位置,可以判断①~元素分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br。
(1)在元素周期表中同一周期从左到右元素的金属性逐渐减弱,非金属性逐渐增强;同一主族从上到下元素的金属性逐渐增强,非金属性逐渐减弱。
因此在①~元素中最活泼的金属元素为⑩号元素K,最活泼的非金属元素为②号元素F,最不活泼的元素为⑨号元素Ar。
(2)元素⑦为S,元素⑧为Cl,其非金属性强弱为Cl>S,可以通过其气态氢化物的稳定性或最高价含氧酸的酸性强弱来判断。
(3)第3周期元素原子半径从左到右依次减小(除稀有气体元素外),因此原子半径最大的为Na,最小的为Cl,它们可形成NaCl。