新版化工热力学课后题答案马沛生-新版.pdf
- 格式:pdf
- 大小:1.46 MB
- 文档页数:94

习 题 七 及 答 案一、问答题7-1. Rankine 循环与卡诺循环有何区别与联系? 实际动力循环为什么不采用卡诺循环?答:两种循环都是由四步组成,二个等压过程和二个等熵(可逆绝热)过程完成一个循环。
但卡诺循环的二个等压过程是等温的,全过程完全可逆;Rankine 循环的二个等压过程变温,全过程只有二个等熵过程可逆。
卡诺循环中压缩机压缩的是湿蒸汽,因气蚀损坏压缩机;且绝热可逆过程难于实现。
因此,实际动力循环不采用卡诺循环。
7-2. Rankine 循环的缺点是什么? 如何对其进行改进?答:Rankine 循环的吸热温度比高温燃气温度低很多,热效率低下,传热损失极大。
可通过:提高蒸汽的平均吸热温度、提高蒸汽的平均压力及降低乏汽的压力等方法进行改进。
7-3.影响循环热效率的因素有哪些?如何分析?答:影响循环热效率的因素有工质的温度、压力等。
具体可利用下式1L HT T η=- 分析确定哪些因素会改变L H T T 或,从而得到进一步工作的方案。
7-4.蒸汽动力循环中,若将膨胀做功后的乏气直接送人锅炉中使之吸热变为新蒸汽,从而避免在冷凝器中放热,不是可大大提高热效率吗? 这种想法对否? 为什么?答:不合理。
蒸汽动力循环以水为工质,只有在高压下才能提高水温;乏汽的压力过低,不能直接变成高压蒸汽。
与压缩水相比较,压缩蒸汽消耗的工太大,不仅不会提高热效率,反而会大大降低热效率。
7-5.蒸气压缩制冷循环与逆向卡诺循环有何区别与联系? 实际制冷循环为什么不采用逆向卡诺循环?答:两种循环都是由四步组成,二个等压过程和二个等熵(可逆绝热)过程完成一次循环。
但逆向卡诺循环的二个等压过程是等温的,全过程完全可逆;蒸气压缩制冷循环的二个等压过程变温,全过程只有二个等熵过程可逆。
Carnot 制冷循环在实际应用中是有困难的,因为在湿蒸汽区域压缩和膨胀会在压缩机和膨胀机汽缸中形成液滴,造成“汽蚀”现象,容易损坏机器;同时压缩机汽缸里液滴的迅速蒸发会使压缩机的容积效率降低。

思考题:6-1 空气被压缩机绝热压缩后温度是否上升,为什么? 6-2 为什么节流装置通常用于制冷和空调场合? 6-3 请指出下列说法的不妥之处:① 不可逆过程中系统的熵只能增大不能减少。
② 系统经历一个不可逆循环后,系统的熵值必定增大。
③ 在相同的始末态之间经历不可逆过程的熵变必定大于可逆过程的熵变。
④ 如果始末态的熵值相等,则必定是绝热过程;如果熵值增加,则必定是吸热过程。
6-4 某封闭体系经历一可逆过程。
体系所做的功和排出的热量分别为15kJ 和5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-5 某封闭体系经历一不可逆过程。
体系所做的功为15kJ ,排出的热量为5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-6 某流体在稳流装置内经历一不可逆过程。
加给装置的功为25kJ ,从装置带走的热(即流体吸热)是10kJ 。
试问流体的熵变:(a )是正?(b )是负?(c )可正可负?6-7 某流体在稳流装置内经历一个不可逆绝热过程,加给装置的功是24kJ ,从装置带走的热量(即流体吸热)是10kJ 。
试问流体的熵变: (a )是正?(b )是负?(c )可正可负?6-8 热力学第二定律的各种表述都是等效的,试证明:违反了克劳休斯说法,则必定违反开尔文说法。
6-9 理想功和可逆功有什么区别?6-10 对没有熵产生的过程,其有效能损失是否必定为零? 6-11 总结典型化工过程热力学分析。
习题6-1 压力为1.5MPa ,温度为320℃的水蒸气通过一根内径为75㎜的管子,以-13m s ⋅的速度进入透平机。
由透平机出来的乏气用内径为25㎜的管子引出,其压力为35kPa ,温度为80℃。
假定过程无热损失,试问透平机输出的功率为多少?【解】:查593K 和353K 过热水蒸气焓值,-113255.8kJ kg h =⋅,-122645.6kJ kg h =⋅ 由 3-13-11176.5cm g 0.1765m kg V =⋅=⋅313-124625 4.625m kg V cm g -=⋅=⋅进口截面积 ()22210.0750.00442m 44A D ππ==⨯=-11130.004420.0751kg s 0.1756u A m V ⨯===⋅、 m V A u V A u ==111222-122220.0751 4.6257.08m s0.254m V u A π⋅⨯===⋅⨯ -1212645.63255.8610.2kJ kg h h h ∆=-=-=-⋅忽略位能变化,则 0z ∆=()2223-1117.0831020.563kJ kg 22u -∆=-⨯=⋅212s q w m h u ⎛⎫+=∆+∆ ⎪⎝⎭()-10.0751610.220.56347.37kJ s 47.37kW s w =-+=-⋅=-6-2 有一水泵每小时从水井抽出1892kg 的水并泵入储水槽中,水井深61m ,储水槽的水位离地面18.3m ,水泵用功率为3.7KW 的电机驱动,在泵送水过程中,只耗用该电机功率的45%。

习题四一、是否题M M。
4-1 对于理想溶液的某一容量性质M,则 i i解:否4-2 在常温、常压下,将10cm3的液体水与20 cm3的液体甲醇混合后,其总体积为30 cm3。
解:否4-3温度和压力相同的两种纯物质混合成理想溶液,则混合过程的温度、压力、焓、Gibbs自由能的值不变。
解:否4-4 对于二元混合物系统,当在某浓度范围内组分2符合Henry规则,则在相同的浓度范围内组分1符合Lewis-Randall规则。
解:是4-5在一定温度和压力下的理想溶液的组分逸度与其摩尔分数成正比。
解:是4-6理想气体混合物就是一种理想溶液。
解:是4-7对于理想溶液,所有的混合过程性质变化均为零。
解:否4-8对于理想溶液所有的超额性质均为零。
解:否4-9理想溶液中所有组分的活度系数为零。
解:否4-10 系统混合过程的性质变化与该系统相应的超额性质是相同的。
解:否4-11理想溶液在全浓度范围内,每个组分均遵守Lewis-Randall 定则。
解:否4-12 对理想溶液具有负偏差的系统中,各组分活度系数i γ均 大于1。
解:否4-13 Wilson 方程是工程设计中应用最广泛的描述活度系数的方程。
但它不适用于液液部分互溶系统。
解:是二、计算题4-14 在一定T 、p 下,二元混合物的焓为 2121x cx bx ax H ++= 其中,a =15000,b =20000,c = - 20000 单位均为-1J mol ⋅,求 (1) 组分1与组分2在纯态时的焓值1H 、2H ;(2) 组分1与组分2在溶液中的偏摩尔焓1H 、2H 和无限稀释时的偏摩尔焓1∞H 、2∞H 。
解:(1)1111lim 15000J mol -→===⋅x H H a2121lim 20000J mol -→===⋅x H H b(2)按截距法公式计算组分1与组分2的偏摩尔焓,先求导:()()()12121111111d dd d d11d H ax bx cx x x x ax b x cx x x =++=+-+-⎡⎤⎣⎦12=-+-a b c cx将1d d Hx 代入到偏摩尔焓计算公式中,得()()()()()()11112121111111112122d 1d (1)211221H H H x x ax bx cx x x a b c cx ax b x cx x a b c cx x a b c cx a c x a cx =+-=+++--+-=+-+-+-+---+-=+-=+()()()()21121211111111121d 2d 112HH H x ax bx cx x x a b c cx x ax b x cx x x a b c cx b cx =-=++--+-=+-+---+-=+无限稀释时的偏摩尔焓1∞H 、2∞H 为:()()2-1112012-122111221lim lim 150002000035000J mol lim lim 200002000040000J molx x x x H H a cx H H b cx∞→→∞→→==+=+=⋅==+=+=⋅4-15 在25℃,1atm 以下,含组分1与组分2的二元溶液的焓可以由下式表示:121212905069H x x x x x x =++⋅+()式中H 单位为-1cal mol ⋅,1x 、2x 分别为组分1、2的摩尔分数,求 (1) 用1x 表示的偏摩尔焓1H 和2H 的表达式; (2) 组分1与2在纯状态时的1H 、2H ;(3) 组分1与2在无限稀释溶液的偏摩尔焓1∞H 、2∞H ;(4) ΔH 的表达式;(5)1x =0.5 的溶液中的1H 和2H 值及溶液的H ∆值。

化工热力学第二版答案马沛生【篇一:马沛生主编化工热力学第四章习题解答】是否题4-1 对于理想溶液的某一容量性质m,则mi?mi。
解:否4-2 在常温、常压下,将10cm3的液体水与20 cm3的液体甲醇混合后,其总体积为 30 cm3。
解:否4-3 温度和压力相同的两种纯物质混合成理想溶液,则混合过程的温度、压力、焓、gibbs自由能的值不变。
解:否4-4 对于二元混合物系统,当在某浓度范围内组分2符合hey规则,则在相同的浓度范围内组分1符合lewis-randall规则。
解:是4-5 在一定温度和压力下的理想溶液的组分逸度与其摩尔分数成正比。
解:是4-6 理想气体混合物就是一种理想溶液。
解:是4-7 对于理想溶液,所有的混合过程性质变化均为零。
解:否4-8 对于理想溶液所有的超额性质均为零。
解:否4-9 理想溶液中所有组分的活度系数为零。
解:否4-10 系统混合过程的性质变化与该系统相应的超额性质是相同的。
解:否4-11理想溶液在全浓度范围内,每个组分均遵守lewis-randall定则。
解:否4-12 对理想溶液具有负偏差的系统中,各组分活度系数?i均大于1。
解:否4-13 wilson方程是工程设计中应用最广泛的描述活度系数的方程。
但它不适用于液液部分互溶系统。
解:是二、计算题4-14 在一定t、p下,二元混合物的焓为h?ax1?bx2?cx1x2其中,a=15000,b=20000,c = - 20000 单位均为j?mol-1,求 (1) 组分1与组分2在纯态时的焓值h1、h2;(2) 组分1与组分2在溶液中的偏摩尔焓h1、h2和无限稀释时的偏摩尔焓h1?、h2?。
j?molj?mol?1解:(1)h1?limh?a?15000x1?1h2?limh?b?20000x2?1?1(2)按截距法公式计算组分1与组分2的偏摩尔焓,先求导: dhdx1??ddx1ddx1?ax1?bx2?cx1x2???ax1?b?1?x1??cx1?1?x1????a?b?c?2cx1将dh代入到偏摩尔焓计算公式中,得dx1h1?h??1?x1?dhdx1?ax1?bx2?cx1x2?(1?x1)?a?b?c?2cx1??ax1?b?1?x1??cx1?1?x1??a?b?c?2cx1?x1?a?b?c?2cx1? ?a?c?1?x1??a?cx2h2?h?x122dhdx1?ax1?bx2?cx1x2?x1?a?b?c?2cx1??ax1?b?1?x1??cx1?1?x1??x1?a?b?c?2cx1??b?cx12无限稀释时的偏摩尔焓h1?、h2?为:h1?limh1?lim?a?cx2??15000?20000?35000?2x1?0x2?1j?molj?mol-1h??limh2?lim?b?cxx2?0x1?121??20000?20000?40000-14-15 在25℃,1atm以下,含组分1与组分2的二元溶液的焓可以由下式表示:h?90x1?50x2?x1x2(?6x1?9x2)式中h 单位为cal?mol-1,x1、x2分别为组分1、2的摩尔分数,求 (1) 用x1表示的偏摩尔焓h1和h2的表达式; (2) 组分1与2在纯状态时的h1、h2;(3) 组分1与2在无限稀释溶液的偏摩尔焓h1?、h2?;(5) x1=0.5 的溶液中的h1和h2值及溶液的?h值。

习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,cs s r p p p = 对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
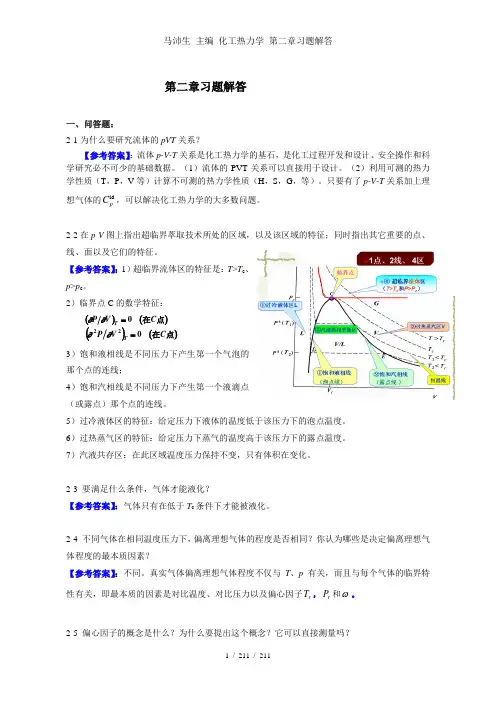
第二章习题解答一、问答题:2-1为什么要研究流体的pVT 关系?【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。
(1)流体的PVT 关系可以直接用于设计。
(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。
只要有了p-V-T 关系加上理想气体的id p C ,可以解决化工热力学的大多数问题。
2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。
【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。
2)临界点C 的数学特征:3)饱和液相线是不同压力下产生第一个气泡的那个点的连线;4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。
5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。
6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。
7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。
2-3 要满足什么条件,气体才能液化?【参考答案】:气体只有在低于T c 条件下才能被液化。
2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素?【参考答案】:不同。
真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。
2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?()()()()点在点在C V P C V PTT 0022==∂∂∂【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。
其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。
为了提高计算复杂分子压缩因子的准确度。

思考题:6-1 空气被压缩机绝热压缩后温度是否上升,为什么? 6-2 为什么节流装置通常用于制冷和空调场合? 6-3 请指出下列说法的不妥之处:① 不可逆过程中系统的熵只能增大不能减少。
② 系统经历一个不可逆循环后,系统的熵值必定增大。
③ 在相同的始末态之间经历不可逆过程的熵变必定大于可逆过程的熵变。
④ 如果始末态的熵值相等,则必定是绝热过程;如果熵值增加,则必定是吸热过程。
6-4 某封闭体系经历一可逆过程。
体系所做的功和排出的热量分别为15kJ 和5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-5 某封闭体系经历一不可逆过程。
体系所做的功为15kJ ,排出的热量为5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-6 某流体在稳流装置内经历一不可逆过程。
加给装置的功为25kJ ,从装置带走的热(即流体吸热)是10kJ 。
试问流体的熵变:(a )是正?(b )是负?(c )可正可负?6-7 某流体在稳流装置内经历一个不可逆绝热过程,加给装置的功是24kJ ,从装置带走的热量(即流体吸热)是10kJ 。
试问流体的熵变: (a )是正?(b )是负?(c )可正可负?6-8 热力学第二定律的各种表述都是等效的,试证明:违反了克劳休斯说法,则必定违反开尔文说法。
6-9 理想功和可逆功有什么区别?6-10 对没有熵产生的过程,其有效能损失是否必定为零? 6-11 总结典型化工过程热力学分析。
习题6-1 压力为1.5MPa ,温度为320℃的水蒸气通过一根内径为75㎜的管子,以-13m s ⋅的速度进入透平机。
由透平机出来的乏气用内径为25㎜的管子引出,其压力为35kPa ,温度为80℃。
假定过程无热损失,试问透平机输出的功率为多少?【解】:查593K 和353K 过热水蒸气焓值,-113255.8kJ kg h =⋅,-122645.6kJ kg h =⋅ 由 3-13-11176.5cm g 0.1765m kg V =⋅=⋅313-124625 4.625m kg V cm g -=⋅=⋅进口截面积 ()22210.0750.00442m 44A D ππ==⨯=-11130.004420.0751kg s 0.1756u A m V ⨯===⋅、 m V A u V A u ==111222-122220.0751 4.6257.08m s0.254m V u A π⋅⨯===⋅⨯ -1212645.63255.8610.2kJ kg h h h ∆=-=-=-⋅忽略位能变化,则 0z ∆=()2223-1117.0831020.563kJ kg 22u -∆=-⨯=⋅212s q w m h u ⎛⎫+=∆+∆ ⎪⎝⎭()-10.0751610.220.56347.37kJ s 47.37kW s w =-+=-⋅=-6-2 有一水泵每小时从水井抽出1892kg 的水并泵入储水槽中,水井深61m ,储水槽的水位离地面18.3m ,水泵用功率为3.7KW 的电机驱动,在泵送水过程中,只耗用该电机功率的45%。

第三章 纯流体的热力学性质计算思考题3-1气体热容,热力学能和焓与哪些因素有关?由热力学能和温度两个状态参数能否确定气体的状态?答:气体热容,热力学能和焓与温度压力有关,由热力学能和温度两个状态参数能够确定气体的状态。
3-2 理想气体的内能的基准点是以压力还是温度或是两者同时为基准规定的? 答:理想气体的内能的基准点是以温度为基准规定的。
3-3 理想气体热容差R p v c c -=是否也适用于理想气体混合物?答:理想气体热容差R p v c c -=不适用于理想气体混合物,因为混合物的组成对此有关。
3-4 热力学基本关系式d d d H T S V p =+是否只适用于可逆过程? 答:否。
热力学基本关系式d d d H T S V p =+不受过程是否可逆的限制3-5 有人说:“由于剩余函数是两个等温状态的性质之差,故不能用剩余函数来计算性质随着温度的变化”,这种说法是否正确?答:不正确。
剩余函数是针对于状态点而言的;性质变化是指一个过程的变化,对应有两个状态。
3-6 水蒸气定温过程中,热力学内能和焓的变化是否为零?答:不是。
只有理想气体在定温过程中的热力学内能和焓的变化为零。
3-7 用不同来源的某纯物质的蒸气表或图查得的焓值或熵值有时相差很多,为什么?能否交叉使用这些图表求解蒸气的热力过程?答:因为做表或图时选择的基准可能不一样,所以用不同来源的某纯物质的蒸气表或图查得的焓值或熵值有时相差很多。
不能够交叉使用这些图表求解蒸气的热力过程。
3-8 氨蒸气在进入绝热透平机前,压力为2.0 MPa ,温度为150℃,今要求绝热透平膨胀机出口液氨不得大于5%,某人提出只要控制出口压力就可以了。
你认为这意见对吗?为什么?请画出T -S 图示意说明。
答:可以。
因为出口状态是湿蒸汽,确定了出口的压力或温度,其状态点也就确定了。
3-9 很纯的液态水,在大气压力下,可以过冷到比0℃低得多的温度。
假设1kg 已被冷至-5℃的液体。

习题四一、是否题4-1 对于理想溶液的某一容量性质M,则M M。
i i解:否4-2 在常温、常压下,将10cm3的液体水与20 cm3的液体甲醇混合后,其总体积为30 cm3。
解:否4-3温度和压力相同的两种纯物质混合成理想溶液,则混合过程的温度、压力、焓、Gibbs自由能的值不变。
解:否4-4对于二元混合物系统,当在某浓度范围内组分2符合Henry规则,则在相同的浓度范围内组分1符合Lewis-Randall规则。
解:是4-5在一定温度和压力下的理想溶液的组分逸度与其摩尔分数成正比。
解:是4-6理想气体混合物就是一种理想溶液。
解:是4-7对于理想溶液,所有的混合过程性质变化均为零。
解:否4-8对于理想溶液所有的超额性质均为零。
解:否4-9理想溶液中所有组分的活度系数为零。
解:否4-10 系统混合过程的性质变化与该系统相应的超额性质是相同的。
解:否4-11理想溶液在全浓度范围内,每个组分均遵守Lewis-Randall定则。
解:否4-12 对理想溶液具有负偏差的系统中,各组分活度系数均大于1。
i解:否4-13 Wilson方程是工程设计中应用最广泛的描述活度系数的方程。
但它不适用于液液部分互溶系统。
解:是二、计算题4-14 在一定T 、p 下,二元混合物的焓为 2121x cx bx ax H ++= 其中,a =15000,b =20000,c = - 20000 单位均为-1J mol ⋅,求 (1) 组分1与组分2在纯态时的焓值1H 、2H ;(2) 组分1与组分2在溶液中的偏摩尔焓1H 、2H 和无限稀释时的偏摩尔焓1∞H 、2∞H 。
解:(1)1111lim 15000J mol -→===⋅x H H a2121lim 20000J mol -→===⋅x H H b(2)按截距法公式计算组分1与组分2的偏摩尔焓,先求导:()()()12121111111d dd d d11d H ax bx cx x x x ax b x cx x x =++=+-+-⎡⎤⎣⎦12=-+-a b c cx将1d d H x 代入到偏摩尔焓计算公式中,得()()()()()()11112121111111112122d 1d (1)211221H H H x x ax bx cx x x a b c cx ax b x cx x a b c cx x a b c cx a c x a cx =+-=+++--+-=+-+-+-+---+-=+-=+()()()()21121211111111121d 2d 112HH H x ax bx cx x x a b c cx x ax b x cx x x a b c cx b cx =-=++--+-=+-+---+-=+无限稀释时的偏摩尔焓1∞H 、2∞H 为:()()2-1112012-122111221lim lim 150002000035000J mol lim lim 200002000040000J molx x x x H H a cx H H b cx∞→→∞→→==+=+=⋅==+=+=⋅4-15 在25℃,1atm 以下,含组分1与组分2的二元溶液的焓可以由下式表示:121212905069H x x x x x x =++⋅+()式中H 单位为-1cal mol ⋅,1x 、2x 分别为组分1、2的摩尔分数,求 (1) 用1x 表示的偏摩尔焓1H 和2H 的表达式; (2) 组分1与2在纯状态时的1H 、2H ;(3) 组分1与2在无限稀释溶液的偏摩尔焓1∞H 、2∞H ; (4) ΔH 的表达式;(5) 1x =0.5 的溶液中的1H 和2H 值及溶液的H ∆值。

习题:2 - 1.为什么要研究流体的pVT关系?答:在化工过程的分析、研究与设计中,流体的压力P、体积V和温度T是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U、熵S、Gibbs 自由能G等都不方便直接测量,它们需要利用流体的P -/ -r数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过P -/ -■数据和热力学基本关系式进行计算。
因此,流体的P --关系的研究是一项重要的基础工作。
2-2 .理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:P V =RT2-3 •偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子©是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:log " GI T r丿s 其中,p,’P c对于不同的流体,a具有不同的值。
但Pitzer发现,简单流体(氩、氟、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过T r=0.7 , log pS = -1这一点。
对于给定流体对比蒸气压曲线的位置,能够用在T r =0.7的流体与氩、氟、氙(简单球形分子)的log p s值之差来表征。
Pitzer把这一差值定义为偏心因子«,即尬=-log p r s -1.00 仃r =0.7)任何流体的O值都不是直接测量的,均由该流体的临界温度T c、临界压力P c值及T r =0.7时的饱和蒸气压p S来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,升高而减小吗?饱和蒸气的摩尔体积随着温度的答:正确。

习 题 五一 是否题5-1 汽液平衡关系ˆˆV L i i f f =的适用的条件是理想气体和理想溶液。
解:否。
5-2 汽液平衡关系s i i i i py p x γ=的适用的条件是低压条件下的非理想液相。
解:是。
5-3 在(1)-(2)二元系统的汽液平衡中,若(1)是轻组分,(2)是重组分, 则11y x >, 22y x <。
解:错,若系统存在共沸点,就可以出现相反的情况。
5-4 混合物汽液相图中的泡点曲线表示的是饱和汽相,而露点曲线表示的是饱和液相。
解:错。
5-5 对于负偏差系统,液相的活度系数总是小于1。
解:是。
5-6 在一定压力下,组成相同的混合物的露点温度和泡点温度不可能相同。
解:错,在共沸点时相同。
5-7 在组分(1)-组分(2)二元系统的汽液平衡中,若(1)是轻组分,(2)是重组分,若温度一定,则系统的压力,随着1x 的增大而增大。
解:错,若系统存在共沸点,就可以出现相反的情况。
5-8 理想系统的汽液平衡 K i 等于1。
解:错,理想系统即汽相为理想气体,液相为理想溶液。
5-9 对于理想系统,汽液平衡常数K i ,只与 T 、p 有关,而与组成无关。
解:对,可以从理想体系的汽液平衡关系证明。
5-10能满足热力学一致性的汽液平衡数据就是高质量的数据。
解:错。
5-11当潜水员深海作业时,若以高压空气作为呼吸介质,由于氮气溶入血液的浓度过大,会给人体带来致命影响(类似氮气麻醉现象)。
根据习题5-11表1中25℃下溶解在水中的各种气体的Henry 常数H,认为以二氧化碳和氧气的混和气体为呼吸介质比较适合。
习题5-11表1 几种气体的Henry 常数气体 H /MPa 气体 H / MPa 气体 H / MPa 气体 H / Pa 乙炔135一氧化碳540氦气12660甲烷4185空气7295乙烷 3060 氢气 7160 氮气 8765 二氧化碳 167 乙烯1155硫化氢55氧气4438解:对。
思考题:6-1 空气被压缩机绝热压缩后温度是否上升,为什么? 6-2 为什么节流装置通常用于制冷和空调场合? 6-3 请指出下列说法的不妥之处:① 不可逆过程中系统的熵只能增大不能减少。
② 系统经历一个不可逆循环后,系统的熵值必定增大。
③ 在相同的始末态之间经历不可逆过程的熵变必定大于可逆过程的熵变。
④ 如果始末态的熵值相等,则必定是绝热过程;如果熵值增加,则必定是吸热过程。
6-4 某封闭体系经历一可逆过程。
体系所做的功和排出的热量分别为15kJ 和5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-5 某封闭体系经历一不可逆过程。
体系所做的功为15kJ ,排出的热量为5kJ 。
试问体系的熵变: (a )是正?(b )是负?(c )可正可负?6-6 某流体在稳流装置内经历一不可逆过程。
加给装置的功为25kJ ,从装置带走的热(即流体吸热)是10kJ 。
试问流体的熵变:(a )是正?(b )是负?(c )可正可负?6-7 某流体在稳流装置内经历一个不可逆绝热过程,加给装置的功是24kJ ,从装置带走的热量(即流体吸热)是10kJ 。
试问流体的熵变: (a )是正?(b )是负?(c )可正可负?6-8 热力学第二定律的各种表述都是等效的,试证明:违反了克劳休斯说法,则必定违反开尔文说法。
6-9 理想功和可逆功有什么区别?6-10 对没有熵产生的过程,其有效能损失是否必定为零? 6-11 总结典型化工过程热力学分析。
习题6-1 压力为1.5M P a ,温度为320℃的水蒸气通过一根内径为75㎜的管子,以-13m s ⋅的速度进入透平机。
由透平机出来的乏气用内径为25㎜的管子引出,其压力为35kPa ,温度为80℃。
假定过程无热损失,试问透平机输出的功率为多少?【解】:查593K 和353K 过热水蒸气焓值,-113255.8kJ kg h =⋅,-122645.6kJ kg h =⋅ 由 3-13-11176.5cm g 0.1765m kg V =⋅=⋅313-124625 4.625m kgV cm g-=⋅=⋅进口截面积 ()22210.0750.00442m 44A D ππ==⨯=-11130.004420.0751kg s0.1756u A m V ⨯===⋅、m V A u V A u ==111222-122220.0751 4.6257.08m s 0.254m V u A π⋅⨯===⋅⨯-1212645.63255.8610.2kJ kgh h h ∆=-=-=-⋅忽略位能变化,则 0z ∆=()2223-1117.0831020.563kJ kg22u -∆=-⨯=⋅212s q w m h u ⎛⎫+=∆+∆ ⎪⎝⎭()-10.0751610.220.56347.37kJ s 47.37kW s w =-+=-⋅=-6-2 有一水泵每小时从水井抽出1892kg 的水并泵入储水槽中,水井深61m ,储水槽的水位离地面18.3m ,水泵用功率为3.7K W 的电机驱动,在泵送水过程中,只耗用该电机功率的45%。
3-1思考下列说法是否正确:(1) 当压力趋于零时,M (R,P )-M ig ((T,P)3-3 试证明(a)以T 、V 为自变量时焓变为V V p V T p T T T p V C H T VV V d d d ⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+=证明:以T 、V 为自变量时焓变为V V H T T H H TV d d d ⎪⎭⎫⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂= (A )又由p V S T H d d d += (B )将(B )式两边在恒定的温度V 下同除以的d T 得:VV V T p V T S T T H ⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂ 因,T C T S V V=⎪⎭⎫⎝⎛∂∂ 则,VV V T p V C T H ⎪⎭⎫⎝⎛∂∂+=⎪⎭⎫⎝⎛∂∂ (C ) 将(B )式两边在恒定的温度T 下同除以的d V 得:TT T V p V V S T V H ⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂ 将Maxwell 关系式VT T p V S ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂代入得:TV T V p V T p T V H ⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂ (D ) 将(C )式和(D )式代人(A )式得:V V p V T p T T T p V C H T VV V d d d ⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+=即:原式得证3-7. 试使用下列水蒸汽的第二维里系数计算在573.2K 和506.63kPa 下蒸汽的Z 、RH 及R S 。
解:T =573.2K ,B=-119-13mol cm ⋅,且p = 506.63kPa 由式(2-10b )得:9871.02.563314.81063.506101191136=⨯⨯⨯⨯-+=+=-RT Bp Z由式(3—64)得:TR T B T B p H ⎥⎦⎤⎢⎣⎡-⋅=d d 式中:()[]()()11376K mol m 100.62.5632.58310125113d d ----⋅⋅⨯=-⨯---=∆∆≈TB T B()()1763mol J 53.234100.62.573101191063.506d d -=-=⋅-⨯⨯⨯-⨯⨯⎥⎦⎤⎢⎣⎡-⋅=--TR T B T B p H 由式(3-65)得:()1-173K mol J 304.0100.61063.506d d --⋅⋅⨯⨯⨯-⋅-===TBp S R 3-8. 利用合适的普遍化关联式,计算1kmol 的1,3-丁二烯,从2.53MPa 、400K 压缩至12.67MPa 、550K 时的U V S H ∆∆∆∆,,,。