高中化学新教材必修二课件讲义 (1)
- 格式:pdf
- 大小:1.34 MB
- 文档页数:11
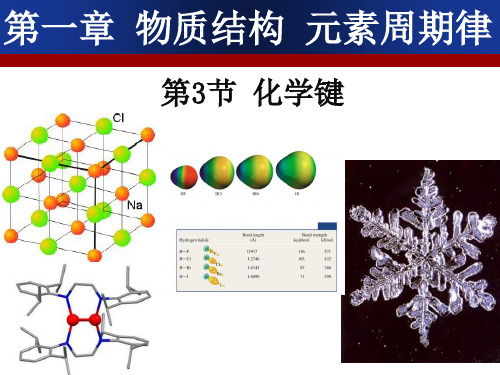




化学必修二讲义普通高中课程标准实验教科书化学必修2第一章物质结构元素周期律第一节元素周期表第二节元素周期律第三节化学键归纳与整理第二章化学反应与能量第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度归纳与整理第三章有机化合物第一节最简单的有机化合物--------- 甲烷第二节来自石油和煤的两种基本化工原料第三节生活中两种常见的有机物归纳与整理第四章化学与可持续发展第一节开发利用金属矿物和海水资源第二节化学与资源综合利用、环境保护归纳与整理结束语附录I 相对原子质量表附录n 部分酸、碱和盐的溶解性表(20 C)附录川一些常见元素中英文名称对照表第一章物质结构元素周期律第一节元素周期表(一)核素1、原子结构:原子由原子核和核外电子构成,原子核在原子的中心,由带正电的质子与不带电的中子构成,带负电的电子绕核作高速运动。
也就是说,质子、中子和电子是构成原子的三种微粒。
在原子中,原子核带正电荷,其正电荷数由所含质子数决定。
•电予制个卑位负电荷(1) 原子的电性关系:核电荷数 =质子数=核外电子数(2) 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,质量数(A )=质子数(Z ) +中子数(N )(3) 离子指的是带电的原子或原子团。
带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。
当质子数(核电荷数)>核外电子数时,该粒子是阳离子,带正电荷;当质子数(核电核数v 核外电子数时,该粒子是阴离子,带负电荷。
(4) 原子组成的表示方法质量数元素符号核电荷数- (核内质子数)2、核素和同位素(1)核素:具有一定数目的质子和一定数目的中子的原子叫核素。
如如氢元素有不同核素。
(2)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
① 同位素中“同位”的含义:指在元素周期表中占据同一个位置的意思。
如氕、氘、氚,即同一 元素的不同核素之间互称为同位素。
② 同位素的性质:在天然存在的某种元素中,各种同位素原子个数百分含量一般是不变的;同一 种元素的各种不同的同位素化学性质几乎完全相同,因为各同位素原子结构几乎相同(除中子数)。
章末检测试卷(一)(时间:90分钟满分:100分)一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)1.光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是()A.钛合金B.二氧化硅C.晶体硅D.氧化铝答案B解析制造光导纤维的主要原料是二氧化硅。
2.(2015·全国卷Ⅰ,7)我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。
”这里的“强水”是指()A.氨水B.硝酸C.醋D.卤水答案B解析根据所给四种物质的氧化性的强弱可判断,硝酸具有强氧化性,可溶解大部分金属,“强水”为硝酸。
3.德国科学家曾利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图。
从科学家绘制的二氧化氮分布图来看,欧洲和北美洲的一些经济比较发达,注重环保的大城市上空二氧化氮密度很高。
其原因是这些地区的()A.硝酸工业发达B.雷雨天气较多C.机动车辆过多D.燃料以煤为主答案C解析二氧化氮的产生主要原因是硝酸工业发达、雷雨天气较多、机动车辆过多,燃料以煤为主的后果是二氧化碳导致温室效应加剧、生成的二氧化硫导致酸雨,结合题给信息欧洲与北美洲的经济比较发达,注重环保,可知原因是机动车辆过多。
4.氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。
下列叙述与氮元素的循环无关的是()A.工业合成氨的过程是固氮的过程B.自然界中,氨是动物体特别是蛋白质腐败后的产物C.为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气D.在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收答案C解析将游离态氮转化为化合态氮的过程称为氮的固定,工业上合成氨的过程是将游离态的氮转化为化合态的氮,属于固氮过程,符合氮的循环;自然界中,蛋白质腐败后生成氨,符合氮的循环;用氮气做保护气,讲的是氮气的用途,而不是氮的循环过程,所以不符合氮的循环;在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收,符合氮的循环。
5.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。
引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是()A.高温下N2遇空气生成NO2B.NO遇空气反应生成NO2C.CO2与NO反应生成NO2D.NO与H2O反应生成NO2答案B解析根据原高温气体均为无色,但现场却能看到红烟可推知,是因为发生反应:2NO+O2===2NO2。
6.(2019·南京高一下学期开学考试)下列有关硅的说法不正确的是()A.硅是人类将太阳能转换为电能的常用材料B.硅的导电性介于金属和绝缘体之间,是良好的半导体材料C.硅的化学性质不活泼,常温下不与任何物质反应D.加热到一定程度时,硅能与氯气、氧气等非金属反应答案C解析A项,晶体硅常用作制造太阳能电池的材料,实现太阳能转化成电能,正确;B项,硅的导电性介于金属和绝缘体之间,是良好的半导体材料,正确;C项,硅的化学性质不活泼,在常温下能与F2、HF等物质发生反应,错误;D项,在加热条件下,硅单质能与氯气、氧气等物质发生反应,正确。
7.早在古代,我国人民就积累了不少对化学物质变化的认识。
例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。
这句话中的丹砂指的是HgS,下列有关说法正确的是()A.这个过程只涉及物理变化△Hg+SB.“积变又还成丹砂”过程中发生反应:HgS=====C.实验室中不慎洒落的水银不能用硫黄处理D.“丹砂烧之成水银”过程中还可能产生SO2答案D解析A项,题述过程中涉及HgS的分解和生成,为化学变化,错误;B项,“积变又还成丹砂”过程中发生反应:Hg +S===HgS ,错误;C 项,由反应Hg +S===HgS 可知,实验室中不慎洒落的水银可用硫黄处理,错误;D 项,“丹砂烧之成水银”过程中发生反应:HgS=====△Hg +S ,分解生成的S 可能燃烧生成SO 2,正确。
8.(2019·黑龙江双鸭山第一中学月考)下列说法不正确的是()A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO 3)2固体,铜粉仍不溶解B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性C.铜与稀硝酸反应的离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2OD.HNO 3―→NO ―→NO 2,以上各步变化均能通过一步实验完成答案A解析在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO 3)2固体,铜粉溶解,离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ,故A 错误;能使湿润的红色石蕊试纸变蓝的气体一定是氨气,故B 正确;铜与稀硝酸反应的离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ,故C 正确;HNO 3――→Cu NO ――→O 2NO 2,故D 正确。
9.(2018·玉溪市红塔区高一期末)下列推断正确的是()A.Na 2O 、Na 2O 2组成元素相同,与CO 2反应产物也相同B.SiO 2、SO 2均是酸性氧化物,都能与NaOH 溶液反应C.NO 2、CO 、NO 都是大气污染气体,在空气中都能稳定存在D.氢氧化钠溶液、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中答案B解析Na 2O 和Na 2O 2组成元素相同,与CO 2反应产物不同,后者产生氧气前者没有,选项A错误;SiO 2和CO 2都能够与NaOH 溶液反应,且都只生成盐和水,选项B 正确;CO 、NO 、NO 2都是大气污染气体,一氧化氮易与氧气反应生成二氧化氮,在空气中不能稳定存在,选项C 错误;氢氧化钠、纯碱溶液都属于碱性溶液,能够与二氧化硅反应,保存时不能使用玻璃塞,可以使用橡胶塞,选项D 错误。
10.用下列两种途径制取H 2SO 4(某些反应条件和产物已省略),下列有关说法不正确的是()途径①:S ――→浓硝酸H 2SO 4途径②:S ――→O 2SO 2――→O 2SO 3――→H 2OH 2SO 4A.途径①中反应仅体现了浓硝酸的强氧化性B.途径②中可通过控制反应条件,将S 直接氧化为SO 3C.由途径①和②分别制取1mol H 2SO 4,理论上均消耗1mol S ,均共转移6mol 电子D.途径②相较于途径①更能体现“绿色化学”的理念,因为途径②的污染相对于途径①更小答案B解析途径①中反应的化学方程式为S +6HNO 3(浓)=====△H 2SO 4+6NO 2↑+2H 2O ,属于浓硝酸和非金属单质的反应,产物中无盐生成,因此浓硝酸只表现氧化性而不表现酸性,A 项正确;途径②中无论反应条件如何变化,S 均被O 2先氧化为SO 2,再氧化为SO 3,B 项错误;由关系式S ~H 2SO 4~6e -可知,C 项正确;途径①中有副产物NO 2生成,污染环境,D 项正确。
11.如下为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。
下列关于甲、乙、丙、丁的判断不正确的是()A.甲只具有还原性B.乙、丙均为酸性氧化物C.乙既有氧化性,又有还原性D.丁为黄色或淡黄色固体答案A解析甲、乙、丙、丁分别为H 2S 、SO 2、SO 3、S 。
H 2S 中-2价的S 只有还原性,但其中的H 为+1价,具有氧化性,如H 2S 与活泼金属反应可表现出氧化性,A 项错误;SO 2中的S 为+4价,处于S 的中间价态,C 项正确;单质S 为黄色或淡黄色固体,D 项正确。
12.已知X 、Y 、Z 、W(含同一种元素)之间的转化关系为X ――→O 2Y ――→O 2Z ――→H 2OW ,且X 能与W 发生反应生成一种易溶于水的盐,则X 可能是()A.N 2B.NO 2C.NH 3D.NO答案C解析根据题意可知X 、Y 、Z 、W 均含N 元素,由X 能与W 发生反应生成一种易溶于水的盐,知X 是NH 3,发生反应:4NH 3+5O 2=====催化剂△4NO +6H 2O,2NO +O 2===2NO 2,3NO 2+H 2O===2HNO 3+NO ,HNO 3+NH 3===NH 4NO 3。
13.(2018·江西九江一中期末)氨是一种重要的化工原料,可以制备一系列物质(如图所示)。
下列说法正确的是()A.NH 4Cl 和NaHCO 3都是常用的化肥B.NH 4Cl 、HNO 3和Na 2CO 3受热时都易分解C.NH 3和NO 2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以与Ca(OH)2发生反应答案C解析NH 4Cl 是常用的化肥,而NaHCO 3是小苏打,不用作化肥,A 项错误;Na 2CO 3受热不易分解,B 项错误;图中涉及的盐类NaCl 与Ca(OH)2不反应,D 项错误;NH 3能和NO 2发生氧化还原反应生成N 2和H 2O ,化学方程式为8NH 3+6NO 2=====一定条件7N 2+12H 2O ,C 项正确。
14.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是()A.定性检验SO 2-3,将BaCl 2溶液用稀硝酸酸化B.为提高KMnO 4溶液的氧化能力,用盐酸将KMnO 4溶液酸化C.检验溶液中是否含有Fe 2+时,用稀硝酸酸化D.检验溶液中是否含有SO 2-4时,在无其他阳离子干扰的条件下,先用盐酸酸化,再向所得溶液中加BaCl 2溶液答案D解析A 项中HNO 3能将SO 2-3氧化成SO 2-4;B 项中KMnO 4能将Cl -氧化成Cl 2;C 项中HNO 3能将Fe 2+氧化成Fe 3+。
故A 、B 、C 三项的酸化方法均不正确。
15.将a mL NO 、b mL NO 2、x mL O 2混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则用a 、b 表示的x 的代数式是()A.a +b 2B.2a +b 3C.3a +b 4D.4a +b 5答案C解析氮的氧化物与O 2和H 2O 反应生成HNO 3时,只要满足氮的氧化物中的N 失电子数和O 2中的O 得电子数相等,即可全部转化,没有气体剩余。
即:4x =3a +b ,解得x =3a +b4。
16.硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。
10mL 0.5mol·L -1HNO 3与0.048g Mg 恰好完全反应。