高中阶段常见元素的化合价.
- 格式:doc
- 大小:210.50 KB
- 文档页数:9

常见元素的化合价
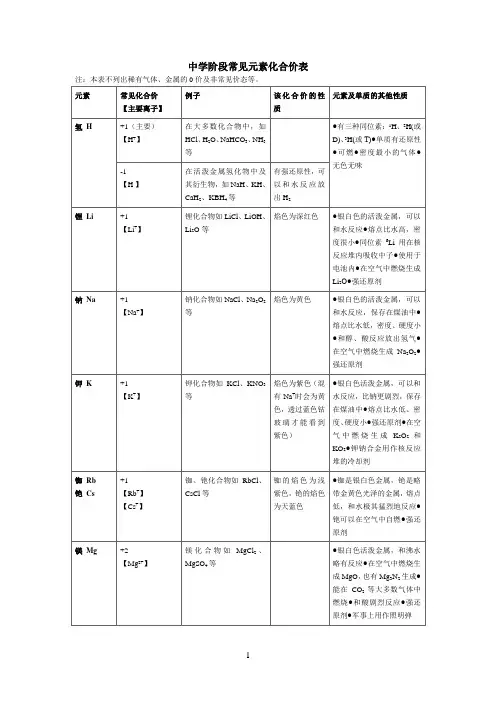
1.氢:
氢以H形式出现在原子态中,它具有一个电子,在一般状态下具有正一价,但在某些特殊情况下也可有-1价。
它的常见化合价为+1。
2.氧:
氧通常以O形式出现,具有六个原子核电子,因此氧具有-2价,氧的常见化合价为-2。
3.氟:
氟是一种无机元素,以F形式出现,具有九个原子核电子,因此氟的价数为-1,氟的常见化合价为-1。
4.氯:
氯以Cl形式出现,具有十个原子核电子,因此氯具有-1价,氯的常见化合价为-1。
5.铁:
铁是一种常见的金属元素,以Fe形式出现,具有十二个原子核电子,因此铁具有2+价,铁的常见化合价为2+。
6.锌:
锌是一种常见的金属元素,以Zn形式出现,具有十二个原子核电子,因此锌具有2+价,锌的常见化合价为2+。
7.铜:
铜是一种常见的金属元素,以Cu形式出现,具有十二个原子核电子,因此铜具有2+价,铜的常见化合价为2+。
8.氨:
氨是一种无机元素,以NH3形式出现,具有五个原子核电子,因此氨具有-3价,氨的常见化合价为-3。
9.硫:
硫是一种无机元素,以S形式出现,具有六个原子核电子,因此硫具有-2价,硫的常见化合价为-2。
10.碱:
碱是一种无机元素,具有一个或多个碱基,因此碱的价数可以为正也可以为负,其常见的化合价有+1,+2,+3,-1,-2,-3,-4等。

常见元素的主要化合价:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
有负二正四六;边记边用就会熟。
常见根价口诀一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;全铜以二价最常见。
化合价口诀:常见元素的主要化合价氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
常见根价口诀:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
化合价口诀一价钾钠氟氢银,二价氧钙钡镁锌,三铝四硅五价磷;二三铁,二四碳。
二四六硫都齐全,铜汞二价最常见。

常见化学元素化合价化学元素的化合价是指在化合物中元素与其他元素结合时的价态。
化合价决定了元素的化学性质,对于理解元素之间的反应和化合物的形成具有重要意义。
下面将介绍一些常见化学元素的化合价。
1.氢(H)的化合价为+1、氢通常以单质形式存在,但在一些化合物中也可以呈现为-1的化合价。
2.氧(O)的化合价为-2、氧通常以氧气(O2)的形式存在,它具有很高的电负性,因此在大多数化合物中它的化合价为-23.碳(C)的化合价为-4、碳是有机化合物的基本组成元素,它通常与氧、氢和其他元素形成共价键。
由于碳的电负性较低,它的化合价通常为-44.氮(N)的化合价为-3、氮通常以气体形式存在,它可以与氢、氧、碳等元素形成共价键。
氮的化合价为-3,是因为它有5个价电子,可以接受3个电子从而实现氢与氮之间的共价键。
5.硫(S)的化合价为-2、硫是常见的非金属元素,它可以形成多个化合价。
在大多数化合物中,硫的化合价为-26.氯(Cl)的化合价为-1、氯是常见的卤素元素,它的化合价通常为-1、氯有7个外层电子,需要接受1个电子来完成其外层的八个电子。
7.钠(Na)的化合价为+1、钠是常见的金属元素,它通常以阳离子的形式存在,其化合价为+18.铁(Fe)的化合价多样化。
铁是过渡金属元素,它可以呈现多种不同的化合态,最常见的是+2和+3的化合价。
9.氧化铁(Fe2O3)是常见的铁的化合物,其中铁的化合价为+3,氧的化合价为-210.铝(Al)的化合价为+3、铝是典型的金属元素,它的化合价通常为+3需要注意的是,虽然上述化合价是常见的,但在一些特定的化合物中,元素的化合价可能会有所变化。
此外,存在一些过渡金属元素和稀土元素,其化合价可以变化得更加复杂。
对于化学元素的化合价,还需要参考具体的化合物和反应条件进行分析和判断。
总结起来,化学元素的化合价决定了它们在化合物中的化学性质和反应行为。
了解常见化学元素的化合价,对于理解化学反应和化学领域的相关知识至关重要。

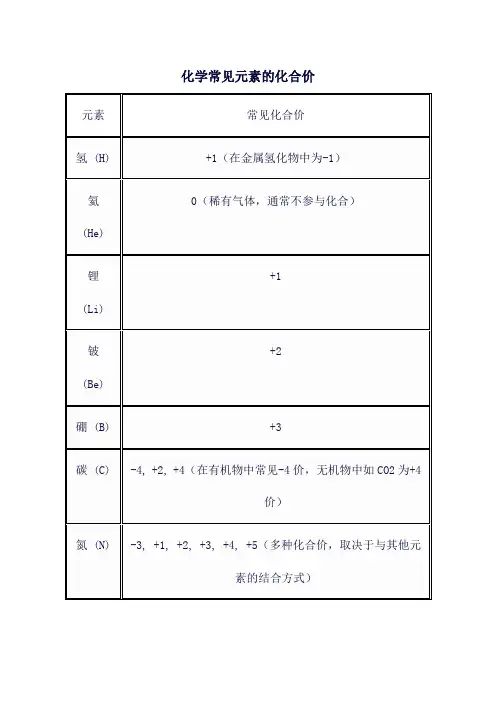
常见的元素化合价化学式常见元素:1.氢(H):化学符号为H,原子序数为1,化合价通常为+12.氦(He):化学符号为He,原子序数为2,化合价通常为0。
3.锂(Li):化学符号为Li,原子序数为3,化合价通常为+14.铍(Be):化学符号为Be,原子序数为4,化合价通常为+25.硼(B):化学符号为B,原子序数为5,化合价通常为+36.碳(C):化学符号为C,原子序数为6,化合价通常为-47.氮(N):化学符号为N,原子序数为7,化合价通常为-38.氧(O):化学符号为O,原子序数为8,化合价通常为-29.氟(F):化学符号为F,原子序数为9,化合价通常为-110.氖(Ne):化学符号为Ne,原子序数为10,化合价通常为0。
化合价:化合价是一个元素与其他元素结合时所能展示的电荷状态。
它描述了一个元素在化合物中的电子数目和位置,并能根据这些电子数目和位置预测化合物的结构和性质。
不同元素的化合价取决于它们的原子结构和电子配置。
常见的化合价如下:1.1+:铷(Rb)、钠(Na)、钾(K)等金属元素在化合物中通常会失去一个电子,在化合物中呈正价。
2.2+:锌(Zn)、镁(Mg)等金属元素在化合物中通常会失去两个电子,在化合物中呈二价。
3.3+:铝(Al)、铁(Fe)等金属元素在化合物中通常会失去三个电子,在化合物中呈三价。
4.4+:锡(Sn)、铅(Pb)等金属元素在化合物中通常会失去四个电子,在化合物中呈四价。
5.5+:五价元素不常见,一些稀有的过渡金属元素可以呈五价,如铋(Bi)。
6.6+:铬(Cr)、硫(S)等元素在化合物中通常会获得两个电子,在化合物中呈六价。
7.7+:氯(Cl)、溴(Br)等元素在化合物中通常会获得一个电子,在化合物中呈负价。
8.8+:氧(O)、硒(Se)等元素在化合物中通常会获得两个电子,在化合物中呈二价。
化学式:化学式是用化学符号和数字表示化合物组成的简单方法。
化学式描述了一个化合物中各种元素的种类和数量关系。

常见元素的所有化合价
K、Na、Ag、H是+1价;Ca、Mg、Ba、Zn、Hg是+2价;Al是+3;O是-2价,Fe是+2或+3,Cl是-1最常见,单质0价永不变。
口诀表
钾钠银氢正一价
钙镁钡锌正二价
二三铁、二四碳、三铝四硅磷五价、铜汞常见正二价
氟氯溴碘负一价
氧硫元素负二价
单质零价需记清
一价氢钾钠银与氟氯
还有氢氧硝酸和铵根
二价钙镁钡锌与氧硫
还有硫酸和碳酸
一二铜汞铁二三
负一硝酸氢氧根
负二硫酸碳酸根
负三记住磷酸根
正一价的是铵根
钾钠银氢正一价,氟氯溴碘负一价;
钙镁钡锌正二价,通常氧是负二价;
二三铁,二四碳,三铝四硅五价磷;
一三五七正价氯,二四六硫锰四七;
铜汞二价最常见,单质化合价为零。
一价钾钠银氢
二价钙镁钡锌
三价铝,四价硅
一二铜,二三铁
化合价:是元素的一种重要性质,这种性质只有跟其他元素相化合时才表现出来。
就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,该元素是不表现其化合价的,因此单质中元素的化合价为“0”。
例如Zn、C、H2等。
非金属元素的化合价:由于金属元素的原子最外层电子数少于4个,故在化学反应中易失去最外层电子而表现出正价,即金属元素的化合价一定为正。
非金属元素跟金属元素相化合时,通常得电子,化合价为负。
但是,当非金属元素跟氧元素结合时,氧元素一定为负价,另一种非金属元素就表现正价了。

常见化学元素化合价一、氢(H)的化合价为+1、氢元素只含有一个电子,因此其电子结构为1s1,容易失去一个电子,使其成为带正电的离子。
二、氧(O)的化合价为-2、氧是一种非金属元素,其原子轨道中的四个2p轨道上有六个电子,每个轨道最多容纳两个电子。
氧通常能够接受两个电子形成氧阴离子(O2-)。
三、氮(N)的化合价为-3、氮是一种主族元素,其原子轨道中的2p轨道上有五个电子。
氮通常能够接受三个电子形成氮阴离子(N3-)。
四、氯(Cl)的化合价为-1、氯是一种主族元素,其原子轨道中的3p轨道上有七个电子。
氯通常能够接受一个电子形成氯阴离子(Cl-)。
五、钠(Na)的化合价为+1、钠是一种主族元素,其原子轨道中的3s轨道上有一个电子。
钠通常能够失去一个电子形成钠阳离子(Na+)。
六、铁(Fe)的化合价为+2和+3、铁是一种过渡金属元素,其电子结构为[Ar]3d64s2、当铁失去两个电子时,其化合价为+2,而失去三个电子时,其化合价为+3、这取决于所形成的化合物的性质。
七、氧化铁(Fe2O3)中的铁的化合价为+3、在氧化铁中,铁原子失去了三个电子形成Fe3+离子,而氧原子接受了两个电子形成O2-离子。
八、硫(S)的化合价为-2、硫是一种非金属元素,其原子轨道中的3p轨道上有六个电子。
硫通常能够接受两个电子形成硫阴离子(S2-)。
九、碳(C)的化合价为+4和-4、碳是一种非金属元素,其原子轨道中的2s和2p轨道上有四个电子。
碳能够与其他元素共用电子形成共价化合物,共用四对电子时,其化合价为+4,共用四个电子对时,其化合价为-4。
上述仅为常见化学元素的部分化合价介绍,还有其他化学元素的化合价因其原子结构和化合物性质的差异而有所不同。
这些化合价的了解有助于我们理解元素之间的化学反应和化合物的性质。

化学常识:常见元素的化合价
一、化学常识:高中化学知识点整理:常见元素的化合价
常见元素的化合价。
熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价; 氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;
碳有正二和正四,硫有负二正四六。
二、高考化学必备知识点:高中化学知识点整理:常见元素的化合价
常见的原子团:SO42-CO32-NO3-OH-MnO4-MnO42-ClO3-PO43-HCO3-NH4+碳酸氢根(HCO3-)硫酸氢根(HSO4-)磷酸氢根(HPO42-)磷酸二氢根(H2PO4-)阳离子:Na+Mg2+Al3+、H+NH4+、Fe2+Fe3+Ca2+阴离子:O2-OH-S2-F2-
Cl-SO42-CO32-NO3-MnO4-MnO42-ClO3背诵化合价口诀:+1价钾钠银铵氢,+2价钡钙镁铜汞锌二三铁、二四碳,三铝四硅五价磷,氟、氯、溴、碘-1价氧硫-2要记清。
氢氧根、硝酸根(OH、NO3)-1价,硫酸根、碳酸根(SO4、CO3)-2价,化合物各元素化合价代数和为零,单质元素化合价是零。
注:铵是NH4原子团;+2价的铁叫“亚铁”;+1价的铜叫“亚铜”无氧时S为-2价,跟氧结合时+4或+6价。
SO32-原子团叫“亚硫酸根”无氧时Cl为-1价氢氦
锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙锰铁。

……………………………………………………………最新资料推荐…………………………………………………
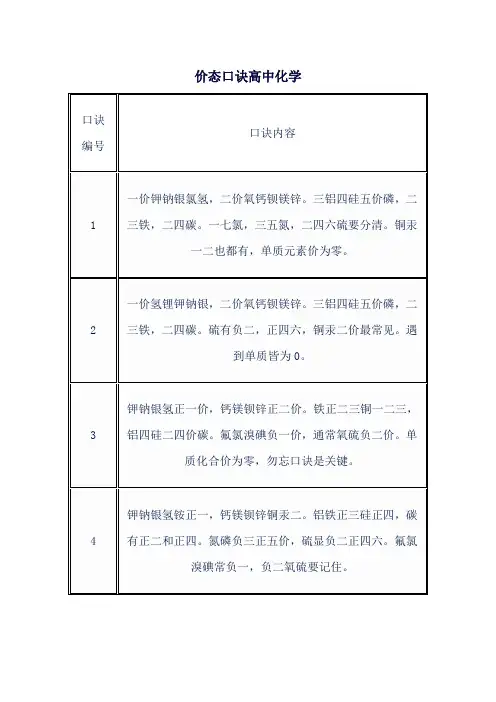
化学元素的化合价助记口诀
一价氢氯钠钾银,
二价氧钙钡镁锌,
三铝四硅五价磷,
二三铁,二四碳,
二四六硫都齐全,
铜汞二价最常见。
正一钾钠银氢铵
正二钙镁钡和锌
三铝四硅氧负二
一二铜二三铁二四碳
氟氯负一磷正五
氢氧根-1
硝酸根-1
硫酸根-2
碳酸根-2
一价氢氯(负)钾钠银
二价氧(负)钡钙镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全(-2、+4、+6)
铜汞二价最常见
莫忘单质价为零
最常见的有:氢正一,氧负二
……………………………………………………………最新资料推荐…………………………………………………
常见元素及原子团的化合价表。
常见元素的主要化合价
正一价:氢,钾,纳,银,铵根离子。
正二价:钙,镁,钡,锌,铜,亚铁。
正三价:铝,铁。
负一价:氯,氢氧根离子,硝酸根离子。
负二价:氧,硫酸根离子,碳酸根离子。
负三价:磷酸根离子。
常见元素的主要化合价氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
常见元素及原子团的化合价常见元素及原子团的化合价:
1. 氢(H)的化合价为1。
2. 氧(O)的化合价通常为2。
3. 氮(N)的化合价可以是3或5。
4. 碳(C)的化合价可以是2或4。
5. 硫(S)的化合价可以是2、4或6。
6. 氯(Cl)的化合价通常为1。
7. 钠(Na)的化合价通常是1。
8. 铁(Fe)的化合价可以是2或3。
9. 铝(Al)的化合价通常为3。
10. 氟(F)的化合价通常为1。
11. 磷(P)的化合价可以是3或5。
12. 铜(Cu)的化合价可以是1或2。
13. 硼(B)的化合价可以是3或4。
14. 氦(He)的化合价通常是0。
15. 锂(Li)的化合价通常是1。
16. 氮气(N2)的化合价是0。
17. 氯气(Cl2)的化合价是0。
18. 二氧化碳(CO2)的化合价是0。
19. 水(H2O)中氧(O)的化合价是2,氢(H)的化合价是1。
20. 硫酸(H2SO4)中氢(H)的化合价是1,氧(O)的化合价是-2,硫(S)的化合价是6。
请注意,以上化合价仅代表常见情况,具体化合价还会受到其他因素的影响,并不是绝对的。
常见化学元素的化合价一、氢(H)氢是最轻的元素,化合价为+1和-1。
在大多数情况下,氢以单负离子的形式存在,如氢离子(H+),它失去了一个电子,具有+1的化合价。
然而,在某些化合物中,氢也可以以共价键的形式与其他元素共享电子,此时氢的化合价为-1。
二、氧(O)氧是常见的非金属元素,化合价为-2。
氧通常以双电负离子的形式存在,如氧离子(O2-),它接受了两个电子,具有-2的化合价。
氧也可以以共价键的形式与其他元素共享电子,此时氧的化合价也为-2。
三、氮(N)氮是一种常见的非金属元素,化合价为-3。
氮通常以三价阴离子的形式存在,如氨离子(NH3-),它接受了三个电子,具有-3的化合价。
氮也可以以共价键的形式与其他元素共享电子,此时氮的化合价也为-3。
四、碳(C)碳是生命的基础,化合价为+4和-4。
在大多数有机化合物中,碳以四价阳离子的形式存在,如甲烷(CH4),它与四个氢原子形成共价键,具有+4的化合价。
然而,在某些化合物中,碳也可以以四价阴离子的形式存在,如甲酸(HCOO-),它与一个氧原子形成共价键,具有-4的化合价。
五、氯(Cl)氯是一种常见的卤素元素,化合价为-1。
氯通常以单负离子的形式存在,如氯离子(Cl-),它接受了一个电子,具有-1的化合价。
氯也可以以共价键的形式与其他元素共享电子,此时氯的化合价也为-1。
六、钠(Na)钠是一种常见的金属元素,化合价为+1。
钠通常以单正离子的形式存在,如钠离子(Na+),它失去了一个电子,具有+1的化合价。
钠在化合物中常与氯形成离子键,形成氯化钠(NaCl)等化合物。
七、铁(Fe)铁是一种常见的过渡金属元素,化合价为+2和+3。
在某些化合物中,铁以二价阳离子的形式存在,如亚铁离子(Fe2+),它失去了两个电子,具有+2的化合价。
在其他化合物中,铁以三价阳离子的形式存在,如铁离子(Fe3+),它失去了三个电子,具有+3的化合价。
八、氟(F)氟是一种常见的卤素元素,化合价为-1。
【高中化学】化学元素化合价记忆口诀完整版化学元素化合价记忆口诀完整版
口诀(一)
一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;
二三铁二四碳,二四六硫都齐;铜汞二价最常见。
口诀(二)
正一氢锂钠钾银铵根,负一氟氯溴碘氢氧根,
二价氧钙镁钡锌,三铝四硅五价氮磷
二三铁、二四碳,二四六硫都齐全,
锰有二四六和七,铜汞二价最常见。
单质为0酸根负,一价硝酸根,
二价硫酸碳酸根,三价就是磷酸根。
口诀(三)
氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
口诀(四)
一价氢氟钾钠银,二价氧钙钡镁锌,
三铝四硅五氮磷,一二铜汞四七锰,
二三铁二四碳,二四六硫三五氮,
一五七氯常常见,单质为零永不变。
钾钠银氢正一价,钙镁钡锌正二价,
铜一二(+),铁二三(+),
铝正三,氢正一,氧负二。
钾钠氢银正一价,钙镁锌钡正二价;
氟氯溴碘负一价,通常氧是负二价;
铜正一正二铝正三,铁有正二和正三;
碳有正二和正四,硫有负二正四和正六。
感谢您的阅读,祝您生活愉快。
部分元素的化合价H:1, -1Li,Na,K,Pb,Cs: 1Cu,Ag: 1,2,3Au: 1,3 Be,Mg,Ca,Zn,Sr,Cd,Ba,Ra: 2Hg: 1,2B,Al,Sc,Ga,Y,La,Pr-Lu, Ac(CH3COO-): 3In,Tl: 1,3C,Si,Ge,Sn,Pb: 2,4Ti,Zr: 2,3,4Ce,Hf,Th: 3,4N: -3,1,2,3,4,5P: -3,1,3,4,5As,Sb: -3,3,5Bi: 3,5V,Nb,Ta: 2,3,4,5Pa: 3,4,5O: -2,-1,2S,Se,Te: -2,2,4,6Po: 2,4,6Cr: 2,3,6Mo,W: 2,3,4,5,6U: 3,4,5,6F: -1Cl: -1,1,3,4,5,6,7Br,I: -1,1,3,5,7Mn: 2,3,4,6,7Tc,Re: 4,5,6,7Np,Pu: 3,4,5,6,7Xe: 1,4,6,8Ru: 2,3,4,5,6,7,8Fe,Os: 2,3,4,5,6,8Co,Ni,Pd: 2,3,4Rh,Ir,Pt: 2,3,4,5,6NH4:+1PO4:-3+1H,Li,Na,K,Rb,Cs,Cu,Ag,Au,Hg,In,Tl,N+2Be,Mg,Ca,Sr,Ba,Ra,Zn,Cd,Hg,Cr,Mn,Fe,Co,Ni,Cu,C,Sn,Pb,N,S,O+3B,Al,Ga,In,Tl ,Sc,Y,La-Lu,N,P,As,Sb,Bi,Cr,Fe,Co,Ni,Au;Ce+4C,Si,Ge,Sn,Pb,Ti,Zr,Hf,Ce,Th,Mn,Tb,N,S+5N,P,As,Sb,Bi,V,Nb,Ta+6S,Se,Te,Cr,Mo,W,U,Mn,Fe+7Cl,Br,I,Mn,Tc,Re+8Xe,Ru,Os-1F,Cl,Br,I,O-2O,S,Se,Te-3N,P,As,Sb特殊原子团化合价硝酸根NO3-:-1价亚硫酸根SO32-:-2价亚硫酸氢根HSO3-:-1价硫酸根SO42-:-2价 O -2,S+6碳酸根CO32-:-2价 O -2,C+4.氯酸根ClO3-:-1 价 O -2,Cl +5.氢氧根OH-:-1价 O -2,H+1.铵根NH4+:+1 价 H +1,N -3.磷酸根PO43-:-3 价 O -2,P +5碳酸氢根HCO3-:-1价锰酸根MnO42-: -2价高锰酸根MnO4-:-1价超氧根O2-:-1价过氧根O22-:-2价(注意:化学式相同,但不是同一个根,锰酸根中锰呈+6价,高锰酸根中锰呈+7价)氟、氯、溴、碘:-1(氢氟酸,盐酸,氢溴酸和氢碘酸的酸根)所以,物质的化合价有的有多种。