2012年全国高中学生化学素质和实验能力竞赛复赛广东省(B组)试题及答案
- 格式:doc
- 大小:215.50 KB
- 文档页数:8

全国高中学生化学素质和实验能力竞( 赛复 ) 赛试题及答案xx年全国高中学生化学素质和实验能力比赛复赛试题说明: 1.本试卷共 4 页,满分 100 分。
2.考试时间: 2 小时3.考生需在答题卷上答题,在本卷上答题无效。
第 I 卷选择题(共 40 分)一、选择题(此题包含10 小题,每题 4 分,共 40 分,每题有 1-2 个选项切合题意,请将答案填在答题卷相应题号的空格内。
)1.“化学,我们的生活,我们的将来”是 xx 年“国际化学年”的主题。
你以为以下行为中,不切合这一主题的是()。
A.控制含磷清洗剂的生产和使用,防备水体富营养化,保护水资源B.研究采煤、采油新技术,尽量提升产量以知足工业生产的迅速发展C.开发太阳能、水能、风能等新能源、减少使用煤、石油等化石燃料D.实现资源的“ 3R”利用,即:减少资源耗费( Reduce)、增添资源的重复使用( Reuse)、提高资源的循环利用( Recycle )2.测定含 I 浓度很小的碘化物溶液时,利用倍增反响进行化学放大,以求出原溶液中的碘离子的浓度。
主要步骤以下:(设放大前后溶液体积相等)①在近中性溶液中,用溴将试样中 I 氧化成 IO3,将过度的溴除去。
②再加入过度的 KI ,在酸性条件下,使 IO3 完整转变为 I2 。
③将②中生成的碘完整萃取后,用肼将其复原为 I ,离子方程式为:+ N2H4+2I2 === 4 I +N2 + 4H ④将生成的 I 反萃到水层后用①法办理。
⑤将④获得的溶液中加入适当的 KI 溶液,并用硫酸酸化。
⑥将⑤反响后的溶液以淀粉作指示剂,用 Na2S2O3标准溶液滴定,化学方程式为:2 Na2S2O3+I2 === Na2S4O6+2NaI经过上述放大后,溶液中I 浓度为原溶液中I 浓度的()。
A .6 倍 B.8 倍 C.18 倍 D.36 倍3.xx 年 10 月 16 日美国与 * 宣告,两国科学家合作成功合成了118 号超重元素。

2012年广东省高中学生化学竞赛试题一、单项选择题I(本题包括30小题,每小题1分,共30分。
每小题只有一个....选项符合题意。
请考生将本题的答案填入以下表格中。
)1.以色列科学家Dan Shechtman 因发现准晶体而荣获2011年诺贝尔化学奖。
准晶体是一种介于晶体和非晶体之间的固体结构,多为金属互化物(intermetallic compound,又称金属间化合物),具有独特性能和重要工业应用,如Al56Cu23Fe12的耐磨性极佳,可用于制作高温电弧喷嘴的镀层。
下列说法中,正确的是()A准晶体中不存在“晶胞”.B.准晶体是多种金属形成的混合物C.Al56Cu23Fe12的硬度比金属Al、Cu与Fe的都小D.Al56Cu23Fe12的熔点一定比金属Al、Cu与Fe的都高2.2011年是第63届联合国大会确定的“国际化学年”,以表彰化学学科所取得的成就以及对人类文明的贡献。
下列说法中,正确的是()A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰B.海水淡化能解决淡水供应危机,向海水中加明矾可以使海水淡化C.现代人的衣食住行都离不开化学,我们生活在“化学世界”里D.发生严重旱情时,可用干冰或溴化银进行人工降雨来缓解旱情3.新闻及广告中经常出现“化学用语”。
从化学学科的角度看,下列叙述中的“化学用语”中,正确的是()A.本产品属天然绿色食品,不含任何“化学元素”B.全球人均年龄排量高达4吨,每人每年种19棵树才能使之“中和”C.某支NBA球队连胜时,记者会说,这得益于队员间的“化学反应”D.某加酶洗衣粉含有生物“催化剂”,可加速衣服上汗渍、奶渍和血污的分解4.2005年1月,美国科学家宣布,发现了铝的“超级原子”结构——Al13和Al14。
已知这类“超级原子”最外层电子数之和为40时处于相对稳定状态。
下列说法中,正确的是()A.Al13与Al14互为同位素B.Al13中Al原子间通过离子键结合C.Al14最外层电子数之和为42,性质与ⅡA族元素原子的相似D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子5.人体内的氧有2%会转化为氧化性极强的“活性氧”,它能加速人体衰老,故被成为“生命杀手”。

1.化学与生活息息相关,下列说法不正确的是()A.用食醋可除去热水壶内壁的水垢B.淀粉、油脂和蛋白质都是高分子化合物C.自行车钢架生锈主要是电化学腐蚀所致D.新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮【答案】B考点:本题考查强酸反应制取弱酸的原理、高分子化合物、电化学腐蚀、复合材料等,难度不大,注意原电池能加快化学反应速率.2.在水溶液中能大量共存的一组离子是()A.Fe2+、Al3+、ClO﹣、Cl﹣B.K+、Cu2+、OH﹣、NO3﹣C.NH4+、Na+、Br﹣、SO42﹣D.Mg2+、H+、SiO32﹣、SO42﹣【答案】C考点:本题考查离子共存问题,明确离子的性质是解答该题的关键,注意常见离子得到氧化性、还原性以及互促水解反应,为易错点,题目难度不大.3.下列实验能达到目的是()A.用溴水鉴别苯和正已烷B.用BaCl2溶液鉴别SO42﹣与SO32﹣C.用浓HNO3与Cu反应制备NO2D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl【答案】C考点:本题考查元素化合物知识,题目难度不大,注意把握物质的性质的异同,鉴别物质时,应能产生不同的反应现象.4.下列应用不涉及氧化还原反应的是()A.Na2O2用作呼吸面具的供氧剂B.工业上电解熔融状态的Al2O3制备AlC.工业上利用合成氨实现人工固氮D.实验室用NH4Cl和Ca(OH)2制备NH3【答案】D考点:本题考查了氧化还原反应的概念应用,本质特征化合价变化的判断,较简单.5.设n A为阿伏加德罗常数的数值,下列说法正确的是()A.常温下,4g CH4含n A个C﹣H共价键B.1 mol Fe与足量稀HNO3反应,转移个2n A个电子C.1L 0.1 mol/L NaHCO3溶液中含有0.1n A个HCO3﹣D.常温常压下,22.4L的NO2和CO2混合气体含有2n A个O原子【答案】A考点:本题考查了阿伏伽德罗常数的应用,主要考查了质量换算物质的量计算微粒数,氧化还原反应的产物分析,盐类水解的应用气体摩尔体积的条件应用,题目难度中等.6.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()选项陈述Ⅰ陈述ⅡA SO2有漂白性SO2可使溴水褪色B SiO2有导电性SiO2可用于制备光导纤维C 浓硫酸有强氧化性浓硫酸可用于干燥H2和COD Fe3+有氧化性FeCl3溶液可用于回收废旧电路板中的铜A.A B.B C.C D.D【答案】D考点:本题考查了二氧化硫、二氧化硅、浓硫酸、三价铁离子的性质应用,熟练掌握基础是解题关键.7.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物是离子化合物D.Y和Z两者最高价氧化物对应的水化物能相互反应【答案】BD考点:本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.8.对于常温下pH为2的盐酸,传述正确的是()A.c(H+)=c(Cl﹣)+c(OH﹣)B.与等体积pH=12的氨水混合后所得溶液显酸性C.由H2O电离出的c(H+)=1.0×10﹣12mol•L﹣1D.与等体积0.01 mol•L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣)【答案】AC【解析】考点:本题考查了溶液中电荷守恒,弱电解质的电离平衡,水溶液中的离子积常数计算应用,溶液中离子浓度比较,题目难度中等.第II卷(非选择题)9.(14分)过渡金属催化的新型碳﹣碳偶联反应是近年来有机合成的研究热点之一,如:反应①化合物Ⅱ可由化合物Ⅲ合成:(1)化合物Ⅰ的分子式(2)化合物Ⅱ与Br2加成的产物的结构简式为(3)化合物Ⅲ的结构简式为(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为(注明反应条件),因此,在碱性条件下,由Ⅳ与CH3CO﹣Cl反应生成Ⅱ,其反应类型为.(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种).【答案】(1)C7H5Obr(2)(3)(4);取代反应(5)考点:本题考查有机物的合成,题目难度不大,解答本题的关键是把握有机物官能团的转化和性质,答题时注意审题,把握题给信息.10.(17分)难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4+2H2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:(1)滤渣主要成分有和以及未溶杂卤石.(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:.(3)“除杂”环节中,先加入溶液,经搅拌等操作后,过滤,再加入溶液调滤液PH至中性.(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①②;(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+⇌CaCO3(s)+已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字).【答案】(1)CaSO4;Mg(OH)2(2)氢氧根与镁离子结合使平衡向右移动,钾离子变多(3)K2CO3;H2SO4(4)在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短(5)1.75×104考点:本题考查了沉淀溶解平衡的影响因素分析判断,流程分析,分离提纯的方法应用,图象分析判断法,平衡常数的计算应用,溶度积的计算分析,沉淀转化的判断,题目难度中等.11.(16分)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L﹣1KI、0.2%淀粉溶液、0.20mol•L﹣1K2S2O8、0.10mol•L﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82﹣+2I﹣=2SO42﹣+I2(慢)I2+2S2O32﹣=2I﹣+S4O62﹣(快)(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣).(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:实验序号体积V/mlK2S2O8溶液水KI溶液Na2S2O3溶液淀粉溶液①10.0 0.0 4.0 4.0 2.0②9.0 1.0 4.0 4.0 2.0③8.0 Vx 4.0 4.0 2.0表中Vx=ml,理由是.(3)已知某条件下,浓度c(S2O82﹣)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82﹣)~反应时间t的变化曲线示意图(进行相应的标注).(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s)△H 已知:4Li(s)+O2(g)=2Li2O(s)△H14LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2则电池反应的△H= ;碘电极作为该电池的极.【答案】(1)Na2S2O3;<2(2)2;理由是保证其他条件不变,只改变反应物K2S2O8浓度,从而才到达对照实验目的(3)(4);正极;考点:本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,难度较大. 12.(17分)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:实验方法:一定量的甲苯和KMnO 4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g 和6.9g ;纯净固体有机物都有固定熔点.(1)操作Ⅰ为 ,操作Ⅱ为 .(2)无色液体A 是 ,定性检验A 的试剂是 ,现象是(3)测定白色固体B 的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B 是苯甲酸与KCl 的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.序号 实验方案 实验现象结论①将白色固体B 加入水中,加热溶解, _________ _________得到白色晶体和无色溶液② 取少量滤液于试管中, _________生成白色沉淀滤液含Cl ﹣③干燥白色晶体,__________________白色晶体是苯甲酸(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10﹣3mol,产品中苯甲酸质量分数的计算表达式为,计算结果为(保留二位有效数字).【答案】(1)分液,蒸馏(2)酸性KMnO4溶液,紫色溶液褪色(3)序号实验方案实验现象结论①将白色固体B加入水中,加热,溶解,冷却、过滤得到白色晶体和无色溶液生成白色沉淀滤液含有Cl﹣②取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液③干燥白色晶体,加热使其融化,测其熔点;熔点为122.4℃白色晶体是苯甲酸(4)×100%;96%故答案为:考点:本题考查了物质性质的实验分析判断,物质分离条件,试剂选择,操作步骤的理解应用,物质成分的实验设计方案、步骤、试剂,样品纯度的计算,题目难度中等111213。
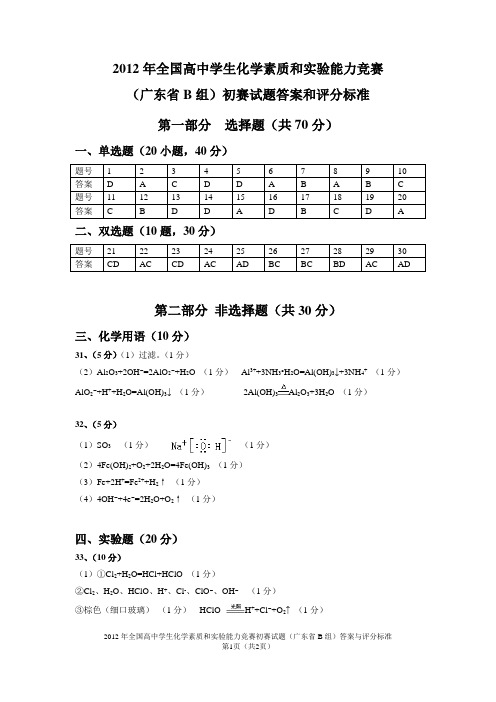
2012年全国高中学生化学素质和实验能力竞赛(广东省B组)初赛试题答案和评分标准第一部分选择题(共70分)一、单选题(20小题,40分)二、双选题(10题,30分)第二部分非选择题(共30分)三、化学用语(10分)31、(5分)(1)过滤。
(1分)(2)Al2O3+2OH-=2AlO2-+H2O(1分)Al3++3NH3•H2O=Al(OH)3↓+3NH4+(1分)AlO2-+H++H2O=Al(OH)3↓(1分)2Al(OH)3Al2O3+3H2O(1分)32、(5分)(1)SO3(1分)(1分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(1分)(3)Fe+2H+=Fe2++H2↑(1分)(4)4OH-+4e-=2H2O+O2↑(1分)四、实验题(20分)33、(10分)(1)①Cl2+H2O=HCl+HClO(1分)②Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(1分)③棕色(细口玻璃)(1分)HClO H++Cl-+O2↑(1分)(2)①取1~2mLNaHCO3于试管中,滴加少量氯水,若有气泡产生(1分),并用澄清石灰水湿润过的烧杯罩在试管口上方,烧杯内壁产生白色物质,证明氯水显酸性。
(其它合理答案都给分)(1分)②将有色布条放入盛有盐酸的小烧杯中,有色布条不褪色;说明水、H+、Cl-没有漂白性。
(1分)将干燥的有色布条放入盛有干燥氯气的集气瓶中,有色布条不褪色;说明Cl2没有漂白性。
(1分)将用水湿润过的有色布条放入盛有干燥氯气的集气瓶中,有色布条褪色。
(1分)综上实验和结论,氯水的漂白性,属次氯酸所致。
(1分)34、(10分)(1)(共3分。
每一横排填对应内容全对,得1分)(2)(1分)(3)(2分)(4)由于锌和盐酸的反应是放热反应,反应开始一段时间内(前4分钟以内),虽然盐酸浓度逐渐减小,但反应放热使温度逐渐升高,且温度影响起决定性作用,加快反应速率。
(2分)反应到一定程度时(4分钟之后),反应温度不再呈增大趋势,盐酸(H+)浓度不断减小,且浓度因素起决定性作用,反应速率减慢。
评分通则:1. 凡要求计算的,没有计算过程,即使结果正确也不得分。
2. 有效数字错误,扣0.5分,但每大题只扣1次。
3. 单位不写或表达错误,扣0.5分,但每大题只扣1次。
4. 方程式不配平不得分。
5. 不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
一、单项选择题I(本题包括30小题,每小题1分,共30分。
每小题只有一个....选项符合题意。
请考生将本题的答案填入答题卷的表格中。
)二、单项选择题II(本题包括5小题,每小题2分,共10分。
每小题只有一个....选项符合题意。
请考生将本题的答案填入答题卷的表格中。
)三、双项选择题(本题包括10小题,每小题2分,共20分。
每小题均有两个..选项符合题意。
只选1个且正确的得1分;选错、多选时,该小题得0分。
请考生将本题的答案填入答题卷的表格中。
)四、(10分) 解答:1.2. PH 4I + NaOHNaI + PH 3↑ + H 2O (1分) 碘化鏻 (1分)3. P 4 + 3KOH + H 2O = PH 3↑ + 3KH 2PO 2 (1分)或 (1分)4. (1)都利用氧化还原反应 (1分) (2)化学镀无需通电,而电镀必须通电 (1分) (3)化学镀对镀件的导电性无特殊要求(或比较节能) (1分)五、(10分) 解答:1. 降低体系熔点 (1分)2. 因为氯化镁是离子晶体,熔融状态下可导电;而氯化铝是共价型化合物,熔融状态下导电性差。
(2分)3. 电解NaCl-KCl-AlCl 3熔体的方法中所需无水AlCl 3可通过两种方法制备:(a) 2Al + 3Cl 22AlCl 3 (0.5分)(b) Al 2O 3 + 3C + 3Cl 22AlCl 3+ 3CO (1分)用方法(a)制无水AlCl 3没有意义。
(0.5分) 方法(b)制无水AlCl 3本身要耗能、且所需氯气也要耗电能来制备。
(1分)4. (1) 222H O 4e O + 4H -+-=↑ 2234A l 3O 2A l O += (1分) (2)通过电路电子的物质的量n (e -) = Q /F = 60It /F (mol) (1分)由4e - ~ O 2 ~ 2/3Al 2O 3得n (Al 2O 3) = n (e -)/6 = 10It /F (mol) (1分) ρ = m (Al 2O 3)/V = M (Al 2O 3)∙n (Al 2O 3) /V = (102×10It /F )/(da 2×10-4) (g/cm 3) = (0.102It /)/( Fda 2) (g/cm 3) (1分)六、(10分)解答:NaHCO3溶液中含有的离子及其浓度情况如下表所示。

2012年全国高中学生化学素质和实验能力竞赛初赛试题(广东省A组)试题说明:1.本试卷共6页,满分l00分。
答案必须写在答题卷上。
复印的答题卷考试无效。
2.可能用到的相对原子质量:H:I C:12 N:14 O:16 F:19 Na:23 Al:27 S:32 Cl:35.5 K:39 Ca:40 Mn:55 Fe:56 Cu:64 Zn:65.Ba:137 1:1273.考试时间:l20分钟一、单项选择题(本题包括l3小题,每小题2分,共26分。
每小题只有一个选项符合题目要求.选对的得2分,选错或不答的得0分)1.下列分离或提纯物质的方法正确的是A.用盐析的方法除去淀粉中的I-B.用加热的方法提纯含有少量碳酸氢钾的碳酸钾C.用渗析的方法从油脂皂化混合物中分离出肥皂D.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡2.维生素参与生物生长发育和新陈代谢所必需的物质,中学生每天需要补充一定量的维生素C。
下列物质中维生素C含量最丰富的是A.鱼B.虾C.牛肉D.橘子3.下列试剂保存或盛放方法正确的是A.浓硝酸盛放在铜质器皿中B.稀硝酸盛放在铁质器皿中C.NaOH溶液保存在带橡胶塞的试剂瓶中D.NaOH溶液保存在带玻璃塞的试剂瓶中4.2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为A.53 B.78 C.131 D.184 5.下列说法正确的是A.淀粉、油脂和蛋白质都是高分子化合物,且它们均为混合物B.煤、石油和天然气都是化石燃料,且它们均不能再生C.果糖、蔗糖和麦芽糖都能发生水解反应,且产物均为葡萄糖D.乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应6.设N A为阿伏加德罗常数的数值,下列说法正确的是A.1 mol苯分子中含有的碳碳双键数为3N AB.0.1 mol FeCl3滴入沸水形成的胶体粒子的数目为0.1N AC.常温常压下,22.4 L氯气与足量铝充分反应,转移电子数为2N AD.一定条件下,1 mol N2和3 mol H2在密闭的容器中充分反应,容器内的分子数大于2N A7.硅及其化合物在日常生活中有重要应用。
广东省2012年普通高中学业水平考试化学注意事项:1.本试卷满分100分,考试时间90分钟。
2.答题前,请考生务必将学校、班级、姓名填写在密封线内。
3.根据老师批改需要,请将选择题的正确答案填写在第3.4页的答题栏中。
可能用到的相对原子质量:H-l C-12 N-14 0-16 Na-23 Al-27Cl-- 35.5 S-32 K-39一、单项选择题I(本大题共30小题,每小题1分,共30分。
在每小题列出的四个选项中,只有一项最符合题意)1.下列名言名句中隐含化学变化的是()A.千里冰封,万里雪飘B.行到水穷处,坐看云起时C.野火烧不尽,春风吹又生D.只要功夫深,铁杵磨成针2.水是人类赖以生存的物质。
H2O的相对分子质量为( )A .16 B.18 C.20 D. 223.碳可以多种形式存在。
金刚石、C60和石墨( )A.互为同位素 B.为同一物质 C.互为同素异形体 D.互为同分异构体4.日常生活中常用到“加碘食盐”“含氟牙膏”等商品,这里的碘和氟应理解为( ) A.单质 B.分子 C.元素 D.氧化物5.下列关于器3416S的叙述正确的是( )A.核电荷数为34B.中子数为16C.核外电子数为18D.原子序数为166.蒸馏不需用到的玻璃仪器是( )A.蒸发皿B.冷凝管C.蒸镏烧瓶D.酒精灯7.下列物质中,硫元素的化合价为+4价的是( )A.Na2 S03 B .SO3 C.Na2S04 D. H2S048.下列物质不属于大气污染物的是( )A. N2 B .NO C .NO2 D. S029.IA族元素具有相似的化学性质,是由于它们的原子具有相同的( )A.原子半径 B电子层数C核外电子数D最外层电子数10.下列正确表示氧的原子结构示意图的是( )A B C D11.合金具有优良的机械性能,用途广泛。
下列物质属于合金的是( )A.铜B.钢C.金刚石D.石英12:下列物质既含有共价键又含有离子键的是( )A.HFB. NaClC. HClD.K2S0413.营养麦片含有多种成分,其中属于无机物是( )A.玉米粉B.大豆粉 C.Na2HPO4 D.白砂糖14.常温下,2 L物质的量浓度为0.5mol·L-l的KOH溶液含有( )A. 0.5 mol的K+B.0.5 mol的H+ C. l.0 mol的H+ D . 1.0 mol的0H-15.已知NaNO2的相对分子质量为69,则500 mL 1.0 mol.L-l NaN02溶液含有的溶质质量为( )A.13.8 g B.69 g C.34.5 g D.138 g16.溶于水后溶液呈碱性的物质是( )A.NO2 B. HCl C.SO2D.Na2O217.可以用碱石灰干燥的气体是( )A.NH3 B. Cl2 C.HCl D.CO218.在下列溶液中加入稀盐酸,加热蒸干后不能观察到固体物质的是( )A .Ca(OH)2溶液B.氨水 C.Na2S03溶液 D.KCl溶液19.分类是学习和研究化学的一种重要方法,下列分类合理的是( )A. K2CO3和K2O都属于盐B.H2 SO4和HNO3都属于酸C. KOH和Na2CO3都属于碱 D.Na2O和Na2SiO3都属于氧化物20.铝可以制造多种建筑型材。
文档供参考,可复制、编制,期待您的好评与关注!1 / 12012年高中学生化学竞赛试卷(参考答案)一、选择题答题卡:(54分) 题号 1 2 3 4 5 6 7 8 9 得分 C C A D D C B D D 题号 10 11 12 13 14 15 16 17 18 得分 A D C B C C B A B 题号 19 20 21 22 23 24 25 26 27 得分BCDCCCABB28、(1)Mg Al Cl C (4分) (2)(2分)(3)第三周期第II A 族 (2分) (4)极性 (2分)(5)[ : Cl : ]-Mg 2+[: Cl :]- (2分)29、(1)纯碱(2分)(2)潜水艇、呼吸面具中氧气的来源(2分) (3)检验二氧化碳气体(2分) (4)漂白粉 (2分)(5) 2 Na 2O 2 + 2H 2O = 4NaOH - + O 2↑;(3分)2 F 2 + 2H 2O = 4HF + O 2↑ (3分)30、(1)氯化铵和熟石灰;(1分) 稀盐酸(1分) (2)NH 3,(1分)CO 2;(1分) CO 2在水中溶解度小,先通NH 3至饱和,有利于NaHCO 3析出(2分)(3)BC 之间缺少止水夹;B 装置应与大气相通;通NH 3的导管不应伸入液面以下(各1分,共2分) (4)49.06%;(2分)NaHCO 3在水中有较大的溶解度,未能全部沉淀出来(1分) (5)NH 4Cl , CO 2 (各1分,共2分)31、已知CO 2和NaOH 反应的产物可能有Na 2CO 3、NaHCO 3或二者的混合物。
题中两次实验产生CO 2的体积关系,可以推知天然碱中含有Na 2CO 3和NaHCO 3成分。
(1分)所以,天然碱的化学式为:2Na 2CO 3·NaHCO 3·2H 2O 。
(1分)‥ ‥ ‥ ‥。
2012年全国高中学生化学素质和实验能力竞赛(B组)复赛试题第Ⅰ卷共35分一、单选择题(本题包括10小题,每小题2分,共20分)1.在呼吸面具和潜水艇里,可作为氧气来源的物质是()A.Na2O2B.KMnO4C.KClO3D.KNO32、海洋是一个巨大的宝藏,期待着人们的开发和利用。
下列物质不经过化学变化就能从海水中获得的是()A.单质溴B.单质镁C.烧碱D.食盐3.下列有关氨和硝酸实验的现象或结果,正确的是()A.浓氨水滴进碱石灰里可制得氨气B.蘸浓氨水和蘸浓硫酸的玻璃棒近会冒白烟C.锌片与稀硝酸反应可制得氢气D.铜片与浓硝酸反应可制得一氧化氮A.汽车行驶时,污染物中CO含量最高B.汽车速率为120 km·h-1时,污染最严重C.从环保角度考虑,最合适的汽车速率为50 km·h-1D.汽车速率增大时,产生的氮的氧化物也随之增多5.设V(正)和V(逆)分别表示可逆反应的正反应速率和逆反应速率。
在一定温度下可逆反应N2 +3H2高温高压2NH3达到平衡时( )催化剂A.V(逆)>V(正) B.V(逆) <V(正)C.V(逆)= V(正),正逆反应停止D.V(逆) =V(正),正逆反应仍进行6.配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是()A.称量时,将Na2CO3固体直接放在托盘天平的右盘上B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线7.下列关于硅单质及其化合物的说法正确的是()①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③高纯度的硅单质广泛用于制作光导纤维④陶瓷是人类应用很早的硅酸盐材料A.①②B.②③C.①④D.③④8.钢铁生锈过程发生如下反应:①2Fe + O2+ 2H2O == 2Fe(OH)2;②4Fe(OH)2+ O2+ 2H2O ==4Fe(OH)3;③2Fe(OH)3==Fe2O3 + 3H2O。
2012年全国高中学生化学素质和实验能力竞赛(B 组)复赛试题第Ⅰ卷 共35分一、单选择题(本题包括10小题,每小题2分,共20分)1.在呼吸面具和潜水艇里,可作为氧气来源的物质是( )A .Na 2O 2B .KMnO 4C .KClO 3D .KNO 32、海洋是一个巨大的宝藏,期待着人们的开发和利用。
下列物质不经过化学变化就能从海水中获得的是( )A .单质溴B .单质镁C .烧碱D .食盐3.下列有关氨和硝酸实验的现象或结果,正确的是( )A .浓氨水滴进碱石灰里可制得氨气B .蘸浓氨水和蘸浓硫酸的玻璃棒近会冒白烟C .锌片与稀硝酸反应可制得氢气D .铜片与浓硝酸反应可制得一氧化氮4.下表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1公里计算) ( )根据上表,下列说法不正确的是( )A .汽车行驶时,污染物中CO 含量最高B .汽车速率为120 km·h -1时,污染最严重C .从环保角度考虑,最合适的汽车速率为50 km·h -1D .汽车速率增大时,产生的氮的氧化物也随之增多5.设V(正)和V(逆)分别表示可逆反应的正反应速率和逆反应速率。
在一定温度下可逆反应N 2 +3H 2高温 高压催化剂2NH 3 达到平衡时 ( )A .V(逆)> V(正)B .V(逆) <V(正)C .V(逆)= V(正),正逆反应停止D .V(逆) =V(正),正逆反应仍进行6.配制一定物质的量浓度的Na 2CO 3溶液,下列操作正确的是( )A.称量时,将Na2CO3固体直接放在托盘天平的右盘上B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线7.下列关于硅单质及其化合物的说法正确的是()①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③高纯度的硅单质广泛用于制作光导纤维④陶瓷是人类应用很早的硅酸盐材料A.①②B.②③C.①④D.③④8.钢铁生锈过程发生如下反应:①2Fe + O2+ 2H2O == 2Fe(OH)2;②4Fe(OH)2+ O2+ 2H2O ==4Fe(OH)3;③2Fe(OH)3==Fe2O3 + 3H2O。
下列说法正确的是()A.反应①②中电子转移数目相等B.反应①中氧化剂是氧气和水C.与铜质水龙头连接处的钢质不管不易发生腐蚀D.钢铁在潮湿的空气中不能发生电化学腐蚀9.设n A代表阿伏加德罗常数(N A)的数值,下列说法正确的是()A.22.4L Cl2中含有n A个Cl2分子B.1L 0.1mol·L-1Na2SO4溶液中有0.1n A个Na+C.1molH2与1molCl2反应生成n A个HCl分子D.1molCa变成Ca2+时失去的电子数为2n A 10.下列反应的离子方程式正确的是()A.钠与水反应:Na + H2O == Na+ + OH- + H2↑B.氯气与水反应:Cl2 + H2O == 2H+ + Cl- + ClO-C.氢氧化铝中和胃酸:Al(OH)3 + 3H+ == Al3+ + 3H2OD.用氯化铁溶液腐蚀电路板:Fe3+ + Cu == Fe2+ + Cu2+二、双选择题(每题3分,共15分。
对1个得1分,全对3分)11.下列关于常见化学物质的应用正确的是()A.干冰能用作冷冻剂B.氯化钠可用作净水剂C.味精可用作食品调味剂D.小苏打是一种膨松剂,可用于制馒头和面色12.某元素位于第三周期第Ⅵ族。
下列叙述不正确的是()A.该元素金属性较强B、该元素原子的核电荷数为16C、该元素原子核外有3个电子层D.该元素原子容易失去最外层电子13.利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。
要得出正确结论,在实验时需要控制的条件是()A.实验时必须向烧杯同时滴加液体B.淀粉—碘溶液的体积和浓度必须相等C.胶头滴管滴出的果汁的滴数必须相等D.胶头滴管滴出的每滴果汁的体积必须相等14.有关溶液中所含禽子的检验,下列判断正确的是()A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中不一定有Fe3+存在B.某溶液做焰色反应实验时火焰为黄色,则溶液中一定有钠元素,可能有钾元素C.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液是不能一次性鉴别开的15.下实验不能达到目的的是()A.往酸性KMnO4溶液中通入SO2验证SO2的还原性C.用二氧化锰和稀盐酸反应制取氯气B.加热氯化铵与氢氧化钙固体混合物制取氨气D.用乙醇萃取碘水中的碘第Ⅱ卷(共50分)三、(本题包括2小题,共25分)16.(14分)根据下图所示装置和操作,回答下列有关问题(1)按图Ⅰ所示装置,用两种不同的操作分别进行实验,观察B管中的现象。
①操作1:先夹紧止水夹a,再使A管开始反应,实验中观察到B管中的现象是。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,在B管中观察到的现象是________。
B管中发生的离子方程式是____________________③请说明造成两者实验现象不同的原因(如两种现象相同,此小题不用回答)_____________。
(2)上述装置实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:①用方程式表示试管甲产生白色沉淀的原因________________________________________________________________________。
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式________________________________________________________________________。
③图Ⅱ中丙装置的作用是__________ ______________。
实验结束时,在装置丙中观察到的现象是_____________________________________。
17.(11分)下面是关于药物“华素片(西地碘片)”使用说明书的部分内容:华素片(西地碘片)的主要活性成分是分子碘。
含量 1.5mg/片,是将碘利用分子分散技术制成分子态西地碘,并加入适量薄荷脑等。
(1)根据上述说明和所学化学知识回答:华素片中含有的活性成分是(写分子式);请推断华素片(“是”或“不是”)白色。
(2)为验证华素片中确定含有上述活性成分,某学生设计了两组实验方案。
依据实验方案,完成实验如下:四、(本题包括2小题,共25分)18.(13分)某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。
可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水.三名同学设计的制备实验方案的反应流程分别如下图.请回答下列问题:(1)请指出甲、乙两方案的主要缺点:19.(12分)已知乙醇的沸点为78.5℃,乙酸的沸点为118℃。
今有乙醇和乙酸的无水混合物,某同学拟通过蒸馏的方法分离开。
仪器和用品:铁架台(含铁圈)、酒精灯、火柴、石棉网、蒸馏烧瓶、单孔塞、温度计、尾接管、锥形瓶方案Ⅰ:直接蒸馏方案Ⅱ:按如下方法蒸馏实验步骤:(1)连接好装置、检验装置的气密性。
(2)将混合物加入到蒸馏烧瓶中,并加入适量的试剂a。
(3)加热到97 ℃,并收集馏分。
(4)冷却后,再向烧瓶中加入试剂b。
(5)加热到118 ℃,并收集馏分。
请回答问题:(1) 关于方案Ⅰ如果直接蒸馏会有什么缺点?__________________________________________。
(2)方案还缺什么仪器。
蒸馏属于加加热操作,所以操作过程中必须注意实验安全,请你列举两项实验安全措施:________________;________________。
(3)试剂a最好选用__________。
A.苯B.CaO粉末C.浓硫酸加试剂a的作用是_______________ _________________________________________。
(4)试剂b最好选用__________。
A.硫酸B.硝酸C.小苏打第Ⅲ卷(共15分)五、(本题包括2小题,共15分)20.(4分)选择题:本题包括2小题,每小题2分。
每小题可能有1或2个选项符合题意,若有2个正确选项,只选1个且正确得2分,多选、错选得0分。
(1)浓HNO3和金属Cu反应实验结束后,同学们发现装置中溶液呈绿色,而不是蓝色。
甲同学认为是该溶液中硝酸铜的质量分数较高,乙同学认炎是该溶液中溶解了生成的气体。
设计以下4个实验来判断甲、乙两种看法是否正确。
其中方案不可行的是:A.加热该绿色溶液,观察颜色变化B.加水稀释绿色溶液,观察颜色变化C.向该绿色溶液中通入氮气,观察颜色变化D.向硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化(2)某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子,现取5份此溶液样品,分别进行了如下实验:①用pH计测得溶液大于7。
②加入盐酸,产生有色刺激性气本。
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量Ba(OH)2溶液,产生白色沉淀,在滤液中滴加KSCN溶液,滴入盐酸酸化后再加入FeCl2溶液显红色。
最终确定在上述六种离子中含有NO2-、CO32-、Cl-三种阴离子。
请分析只需要完成上述哪几个实验,即可得出此结论。
()A .①②④⑤B .②③⑤C .③④⑤D .③④21.(11分)工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:(1)已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示。
若从硫酸亚铁溶液中结晶出FeSO 4·7H 2O ,控制的温度(t )为。
(2)步骤②需加一定量硫酸,其主要目的是 。
(3)生成FeCO 3浊液的离子方程式为 ;FeCO 3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为 。
(4)已知FeSO 4·7H 2O 晶体在加热条件下发生如下反应: 2 FeSO 4·7H 2O Fe 2O 3+SO 2↑+SO 3↑+14H 2O↑;利用下图装置可检验该反应的气体产物。