医疗器械生产企业调查表
- 格式:doc
- 大小:53.00 KB
- 文档页数:2

医疗器械生产企业G M P认证记录表格The latest revision on November 22, 2020质量记录表版次/: A/0依据YY/T0287-2017&ISO13485:2016标准《医疗器械生产质量管理规范》编制:审核:批准:2017 -10-10 发布 2017-10-20实施质量记录目录受控文件清单编号:050-2017 001-2017记录:文件发放回收记录表编号: 050-2017 002-2017文件借阅、复制记录表编号:050-2017 003-2017文件更改申请单编号:050-2017 004-2017质量手册修改、评审记录表编号:050-2017 005-2017文件替换、撤销申请单编号:050-2017 006-2017外来文件清单编号:050-2017 007-2017文件更改、销毁、留用记录表编号:050-2017 008-2017记录人:文件归档登记表编号:050-2017 009-2017记录人:管理评审计划编号:050-2017 010-2017管理评审通知单编号:050-管理评审报告编号:050-2017 013-设备购置申请表编号:050-2017 022-2017设施验收单编号:050-2017 023-2017主要生产设备明细表编号:050-2017 024-2017主要检验设备明细表编号:050-2017 025-2017设备报废单编号:050-2017 026-2017设备使用部门:生产设备记录表编号:050-2017 027-2017编制:日期:批准:日期:检验设备记录表编号:050-2017 028-编制:日期:批准:日期:生产环境检查记录编号:纠正和预防措施处理单编号:050-2017 030-2017风险分析—预期用途/目的的特征表编号:050-2017 031-2017风险分析---已知或可预见的危害表编号:050-2017 032-2017产品要求评审表编号:050-2017 034-2017销售计划通知单编号:050-2017 035-2017销售员:批准:制单:特殊销售合同评审记录表编号:050-2017售后服务记录单编号:050-2017 038-2017(一)报修/委托内容(二)服务记录(三)跟踪记录顾客需求、投诉、报怨处理记录编号:050-2017 039-记录人:顾客投诉调查处理记录编号:050-2017 040-2017纪录人:设计更改通知单编号:050-2017 046-项目变更审批表编号:设计和开发输入清单编号:设计开发输入评审单编号:050-2017 051-2017设计和开发输出清单编号:050-2017 052-编号:050-2017 053-2017设计和开发评审记录表评审类别项目名称项目负责人郑州邦泰生物科技有限公司年月日设计和开发评审记录表编号:050-2017 053-2017(1)编号:050-2017 053-2017(2)设计和开发评审意见表编号:050-2017 053-2017(3)设计和开发评审记录表编号:050-2017 053-2017(4)小批量试产通知单编号:050-2017 054-2017小批试产过程记录表编号:050-2017 055-2017供方调查评价表编号:050-2017 056-2017合格供方名录编号:050-2017拟制:审核:批准:供方业绩评定记录表编号:050-2017 058-2017采购计划表编号:050-2017059-2017年月日第(供货)采购合同合同编号:类别:编号:050-2017 060-2017。

供应商调查表填写说明:此份供应商调查问卷表是我公司认同过程的一部分,也是贵公司成为我公司将来供应商的先决条件.请尽可能完整的填写,并在一周内完成返还给我们。
公司联系人: 电话: 传真:1. (物料)产品名 称:商品名称:注册证号/批准文号:2. 供应商/生产商公司名称:详细地址:主要联系人姓名: 职位:主要联系人电话: 传真:公司所有权性质:3. 公司法人、生产、质量负责人情况表:4.机构和标准贵公司是否已采用质量管理体系? □ Yes □ No贵公司是否已经得到相应管理机构的确认? □Yes □ No如有,标明最近的接受认证的时间和认证号贵公司的质量管理系统是否已经独立机构审计(国家或私人机构)?□ Yes □ No 如果有,请写明机构名称贵公司有多少员工从事生产相关操作?以上产品是否遵循国家标准或行业标准?□ Yes □ No 请写出产品执行标准名称产品放行的决定是由生产部门外的其他部门完成的吗? □ Yes □ No 贵公司是否同意由我公司质量部代表审查贵公司工厂?□ Yes □ No 贵公司是否具有欧洲/美国产品法规文件或适宜证明文件?□ Yes □ No 贵公司是否同意提供产品法规文件的公开部分?□ Yes □ No 5.技术问题5.1生产问题贵公司是否自己生产以上产品?□ Yes □ No 如果不是,请把此问卷的复件传给以上产品的制造商继续填写在最近的1至3年中,贵公司的名称,所有权性质,生产地址产品种类或主要的组织机构人员有过变更吗?□ Yes □ No 如果有,请标明是什么和何时在你们的制造工厂是否生产或加工其他类产品?如果有,请标出产品名称贵公司采取何种手段避免交叉污染、混淆或标致错误?贵公司的产品是否在同一个工厂内生产?□ Yes □ No贵公司的生产是否使用同一主要生产设备线?□ Yes □ No贵公司的产品设备是否专用?□ Yes □ No该产品于何时投入生产?生产过程中是否用到从动物中获取的起始原料?□ Yes □ No如果是,是否采取措施以减少受动物传染病影响的风险?□ Yes □ No是否用到以化学物质/无机物为起始原料?□ Yes □ No是否所有生产用原料都建立了质量标准?□ Yes □ No是否对所有原料都进行质量检验?□ Yes □ No 是否具备原材料的合格供应商清单?□ Yes □ No 是否保留样本?□ Yes □ No 关键的生产和灌装设备是否经过确认?□ Yes □ No 生产工艺是否经过验证?□ Yes □ No 是否建立了设备的清洁程序?□ Yes □ No 关键设施设备是否经过清洁验证?□ Yes □ No 有何设备?关键设备是否建立了预防维修制度?□ Yes □ No 生产用水是什么?水系统是否经过确认?□ Yes □ No 水质是否定期监测?□ Yes □ No 定期监测的周期是多少?5.2厂房:厂房何时建造?是否有对厂房的环境控制情况进行确认?□ Yes □ No 生产区和检测房间是否有清洁SOP?□ Yes □ No 是否有限制进入房间的规定?□ Yes □ No 5.3质量保证:质量控制是否独立于生产?□ Yes □ No 是否定期进行自检并保留相关的记录?□ Yes □ No 是否会执行生产再加工或返工?□ Yes □ No 是否有对最终产品包装/密封系统进行稳定性考察程序?□ Yes □ No 产品是否始终遵循同一经注册的生产工艺/程序生产?□ Yes □ No 若生产工艺有重大变更时贵公司是否会通知我公司?□ Yes □ No 通常一批产品的批量是多少?是否确认了一批产品的均匀性?□ Yes □ No 如果是,如何确认其均匀性的?有原料/包材或产品送工厂外的实验室检验吗?□ Yes □ No 是否每一批产品都按规定的质量标准进行检验?□ Yes □ No在最终产品中是否存在溶剂残留? □ Yes □ No请标明品种名和处于的水平产品是否按程序提交微生物污染检测?□ Yes □ No是否能提供一特定批的检验报告书?□ Yes □ No是否定期对员工进行培训?□ Yes □ No是否有培训记录?□ Yes □ No是否定期对培训进行评估?□ Yes □ No是否建立更改控制程序以确保在生产工艺、分析方法、关键设备中发生变更均得到有效控制和记录?□ Yes □ No是否有偏差处理程序?□ Yes □ No是否有纠正预防程序?□ Yes □ No是否有工业卫生程序?□ Yes □ No是否有产品质量回顾程序?□ Yes □ No如果是,该系统是否经过验证?□ Yes □ No5.4质量控制:原料是否均由合格供应商提供?□ Yes □ No产品检验是否根据规定的质量标准?□ Yes □ No是否建立了书面且经过批准的检验方法?□ Yes □ No是否该检验方法经过验证?□ Yes □ No验证方法是否满足要求?□ Yes □ No如果有重大变化,分析方法是否会重新进行验证?□ Yes □ No如果分析方法有变化,贵公司是否会及时通知到客户?□ Yes □ No是否有样品处理的书面程序?□ Yes □ No分析结果和计算是否经双人复核?□ Yes □ No是否由协议实验室进行分析检验?□ Yes □ No检验报告书是否能提供信息表明所有检验由该测试实验室完成,并且该检验与规定的标准相符合?□ Yes □ No5.6证书及样品:是否能提供每批产品的检验报告书并且包括所有的分析数据?□ Yes □ No是否每批产品均保留存样?□ Yes □ No 如果是,请提供存储期:是否由QC出具体验报告书并且经QA/QC批准?□ Yes □ No 是否进行微生物检查?□ Yes □ No 原料□ Yes □ No 产品□ Yes □ No 空气,墙面,机器/设备□ Yes □ No 生产用水□ Yes □ No 人员□ Yes □ No 5.7试剂:是否进行入场检验?□ Yes □ No 是否有合格的存放条件?(如温度)□ Yes □ No 有效期是否固定?□ Yes □ No 是否对存放环境及有效期进行监控?□ Yes □ No 是否进行有效的标志?□ Yes □ No 5.8分析仪器:是否经过确认?□ Yes □ No是否定期校验?□ Yes □ No是否定期进行维护?□ Yes □ No是否建立运行记录?□ Yes □ No是否建立清洁程序?□ Yes □ No是否有专人管理标准品?□ Yes □ No 6.包装及运输产品运输时的包装(类型和装置)是什么?每单位的净重:产品是否用垫仓板运输?□ Yes □ No 如果是,请写明垫仓板的种类、尺寸和重量产品包装上是否写明以下信息:公司名称,产品名称,批号,净重?□ Yes □ No 请列举一产品批号,并解释其含义?请写明产品的有效期/复验期及贮存条件贵公司是否还遵循其他特定的安全规范?□ Yes □ No 如果有,请写明贵公司是否有特别的运输条件?□ Yes □ No 如果有,请写明公章及签名:日期:年月日。


CUSTOMER SATISFACTION SURVEY医疗器械客户满意度调研问卷(含自动分析评分系统)顾客满意度分析客户满意度调查CUSTOMER SATISFACTION ANALYSIS企业管理资料文集公司名称:所在部门:工作地点:性别:年龄:医疗器械序言客户基础信息填写一、调查目的为了更好的为客户提供服务,了解我司是否能满足客户的需要并对客户满意度进行信息调查回馈,以解决顾客遇到的问题,努力满足顾客的需要,并在此基础上持续改进,从而提升客户对公司的满意度,完善公司的整体形象。
二、调查方法此次调查采用问卷法,通过顾客满意度调查向自己负责片区内的客户发放问卷,客户填好问卷并签字盖章后,回传至指定邮箱,最后由XX公司企管部统一收回。
三、问卷设计此问卷共涉及5个方面的内容,即产品质量、产品价格、交付期限,服务及品牌。
其中,产品质量涉及产品外观、产品含量、产品包装;服务包括售前、售中、售后服务,投诉处理及产品交期。
这份问卷基本上包括了公司产品销售的整个过程以及客户所关心的焦点问题。
四、调查问卷分析此次客户满意度调查为随机抽取,感谢客户对于我公司的产品和服务还是很满意的;客户对于我公司的产品、服务满意。
本次客户满意度调查需填写部分为客户基础信息、整体评价、产品质量、产品价格、交付期限,服务、品牌八个方面。
填写问卷的过程中,选择性问题您只需要评价题目中的描述与您的观点的一致程度(用选择的方式,包括:“完全不同意”,“不同意“,“略有异议”,“基本同意”,“同意”,“超预期”。
)即可。
客户基础信息开放性问题您需要按照要求输入文字填写。
请注意:本次调研为让大家能发表真实想法,让公司更好的为客户服务,公司聘请了专业的第三方公司来进行本次调研。
所有问题的答案没有对或错之分,客户满意度调查将对所有问卷保密,在数据统计结束后,所有问卷将即时删除。
本问卷为不记名填写,请勿在任何单元填写您的姓名,请您完成以后直接将结果发送到指定的问卷收集邮箱,邮箱如下:如果您对该问卷有任何疑问请致电客户满意度调调查热线:您最Wha您成How医疗器械公司性别比例医疗器械公司年龄比例25%28%26%22%100020003000400021-30岁31-40岁41-50岁51岁以上北京6%6%四川5%天津4%4%河北4%辽宁陕西2%吉林2%云南医疗器械公司地区比例医疗器械消费群体薪酬水平区间200400600800100010万以下10-20万20-30万30-50万50-100万100万以上。

附件2医疗器械生产企业调查问卷企业名称:单位地址:联系电话:填报人:请在符合实际情况的选项上打√或填答,多选题可多项选择,如均不相符(或有建议的),请在其他项中说明。
一、基本情况:现有员工人,高级职称人,中级职称人,生产用厂房平方米,洁净区平方米,检验用房平方米,年产值万元人民币。
1.生产许可范围:2.生产的主要产品:)二、仓储基本情况:3.用于仓储的面积是:平方米内平方米平方米以上4.生产的产品是否需要冷藏?如果生产的产品需要冷藏,建立的冷藏库为立方,是否建立了冷链运输:冷链运输的方式及设备有:5.负责仓储管理的人员人,占公司员工的 %6.仓储管理的人员是否进行了上岗前专业培训?7.生产的产品日常仓储量:几乎无仓储以上生产量8.用于产品仓储管理的费用(含人员工资)占到产值的 %三、购销的基本情况:9.是否销售非本企业生产的医疗器械产品?如销售非本企业生产的医疗器械产品是否建立了独立的仓储区域?10.购进的原料材料中是否存在按医疗器械管理的产品?11.销售医疗器械产品的主要模式:销售人员占企业员工总数 %,销售人员具有专业技术职称的占 %,具有大专以上学历的占 %12.是否帮助经营、使用本企业产品的单位建立了产品维护、保养、溯源及不良事件监测制度或措施?13.售后服务的主要方式:14.是否建立了销售产品的档案?15.是否建立并开展了产品不良事件监测及报告制度?公司负责不良事件监测及报告工作的机构或部门是,产品不良事件监测及报告的专(兼)人员名,近五年不良事件发生的年平均数为例,是否发生了严重不良事件:16.是否建立开展了产品上市再评价工作?请说详述产品上市再评价工作开展的具体情况:(可附页)17.是否建立并开展了产品召回管理制度?18.本企业生产的医疗器械产品在流通环节中,可能对产品质量产生重大影响的因素是(并简述原因)简述原因:19.是否开展医疗器械集中免费体验活动?20.开展医疗器械集中免费体验活动,是否会给体验者带来安全隐患?四、对于医疗器械流通监管有何建议?(三方物流、委托仓储、电子商务、转让与捐赠、会展与体验等)盖章:填报日期:附件3医疗器械经营企业调查问卷企业名称:单位地址:联系电话:填报人:请在符合实际情况的选项上打√或填答,多选题可多项选择,如均不相符(或有建议的),请在其他项中说明。

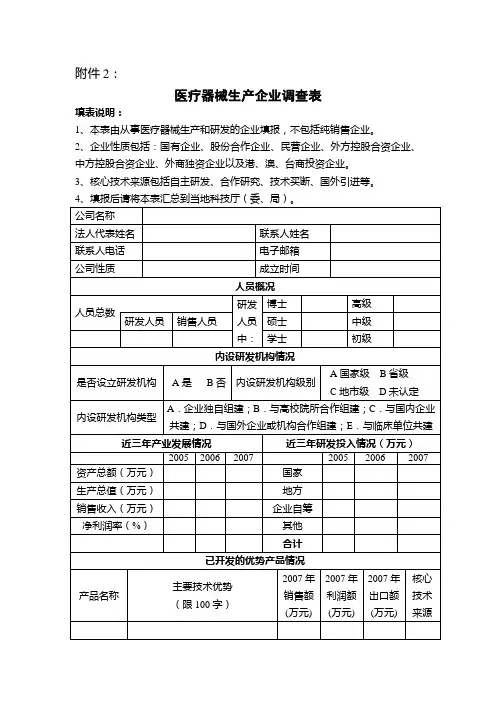
医疗器械生产企业质量管理体系XX 医疗科技有限公司格 表 录 记相关支持性文件-一记录表格受控文件清单编号:KEJQM/C2-4.2.3-02文件借阅登记表文件名称更改后的内容:受此影响引起的其它更改文件名称:申请人:日期: 所在部门意见:签名:日期: 审批部门意见:签名:日期:文件补领申请单文件作废销毁申请单外来文件清单产品相关标准收集登记表质量记录清单编号:KEJQM/C2-5.6-01 评审目的:评审参加部门、人员:评审内容:记录人评审会议时间:评审会议地点:参加人员:评审内容要点:编制: 审核: 批准: 日期: 记录人质量管理体系工作报告会议签到表评审会议时间、地点:评审目的:参加评审人员:评审内容摘要:评审结论:改进、纠正和预防措施摘要及责任部门:编制: 审核: 批准: 日期:年月记录人:管理评审改进措施记录编号:KEJQM/C2-5.6-07培训需求审批表年度培训计划培训记录培训考核表持证上岗人员登记表上岗证人员体检计划人员健康档案设备工装购置申请表编号:KEJQM/C2-6.3-01z o :C A .9C N p w o m x“驴w堞H嫁眼生产设备标识牌编号:KEJQM/C2-6.3-03年度设备大修计划单批准:审核:编制:年度设备大修计划单设备工装检修记录设备封存/启封/报废申请单审批意见:日期:生产设备清单设备验收档案编号:KEJQM/C2-6.3—10工作环境检查记录表编号:KEJQM/C2-6.4—01检查人:日检查日期:年月风险管理计划编号:KEJQM/C2-7.1—011.产品简介2.此次风险管理评审目的和范围3.风险管理评审小组成员及其职责4.风险可接受准则风险管理小组对公司《风险管理控制程序》中制定的风险可接收性准则进行了评价,认为公司完全适用。
8.2.2风险的严重度分级5.风险管理活动计划依据本计划所覆盖的产品生命周期阶段对各阶段风险管理活动做出相应安排,包括验证及评审活动。
附件1:
医疗器械经营企业监督检查表
2
附件2:
医疗器械经营企业自查表
企业名称(公章):
地址:
—3—
4
附件3:
医疗器械质量安全承诺书
为促进医疗器械行业的健康快速发展,营造公平竞争、守法诚信、优质服务的市场环境,本企业向社会承诺六项内容:
一、坚持公众利益至上原则,商业利益服从于公众利益,加强质量管理,不经营无注册证、无合格证明、过期、失效、淘汰的医疗器械;
二、切实恪守“企业是医疗器械质量安全第一责任人”责任,认真执行质量管理制度,严格自律,规范经营行为;
三、严格依法从事医疗器械经营活动,做到:
1.不从无《医疗器械生产企业许可证》、《医疗器械经营企业许可证》的企业购进医疗器械;
2.不擅自变更注册地址、仓库地址;
3.不擅自扩大经营范围、降低经营条件;
4.不涂改、倒卖、出租、出借或者以其他形式非法转让《医疗器械经营企业许可证》;
5.在接受监督检查时不隐瞒有关情况、不提供虚假材料或者拒绝提供反映经营情况的真实材料。
四、严格医疗器械购销存管理,建立健全质量保证体系。
五、拒绝虚假医疗器械广告,不悬挂或发布虚假广告。
六、建立产品质量跟踪制度、不良事件报告制度,做好售后服务,收集用户意见,及时处理投诉。
以上承诺,请社会各界进行监督,若有违法违规行为,愿接受食品药品监督管理部门调查处罚。
企业名称及公章:
法定代表人签字:
年月日
本承诺保证书一式二份,一份由食品药品监督管理部门存档,一份由企业保留。
—5—。
MEDICAL DEVICES QUESTIONNAIRE 医疗器械--问卷调查表 医疗器械 问卷调查表Completion Guidance Notes 填表指引: 1. On receipt of the completed Questionnaire, SGS will prepare and submit a No Obligation proposal detailing the assessment, certification and other costs. 当收到完整的问卷调查表后,SGS 国际认证服务部将当即准备并发出一份详细的 报价建议书,其中包括评审,认证及其它费用。
If you are an existing client applying for additional certification please indicate additions only. For extensions to scope to existing certification please use SGS Notification forms. 如果您已经是 SGS 的客户只需列明现在增加的认证申请。
对于认 证范围的扩展认证请用 SGS 的质量体系变更通报表。
Please return in electronic format or hard copy to your local SGS certification office as shown 请将完成的电子版或硬拷贝 问卷交回 SGS 当地的认证办公室。
or centrally to SGS Hong Kong Ltd 香港通用公证行有限公司 Room 2012-2018 ,20/F,Metrople Square ,2 On Yiu Street, Siu Lek Yuen ,Sha Tin , N.T., Hong Kong 香港新界沙田小沥源安耀街 2 号新都广场二十楼二零一二至二零一八室 Tel: : (852) 27653620, Fax : (852) 23332257, : hk.ssc@ : 2.3.GENERAL INFORMATION 基本信息 Company/Organisation Details 公司/组织的详细信息:Name of Company or Organisation 公司或组织的名称 Division or Trading Name for Certificate 要求公司获取证书的机构或贸易公司 Company VAT (TVA) Number 公司的增值税号 Main Address (Certification Address) 主要地址(认证地址) Invoicing Address (If different) 付款地址(如不同时)If company is part of a group, please specify group 如果公司是集团公司的一部分请说明集团公司的名称 Company Web Site Address 公司网址 Management Representative (Contact) 管理者代表(联络人) Position 职务 E-mail address 电子邮箱 Tel No: 电话 Fax No: 传真MD/Chief Executive (or equivalent) 执行总裁(或相当者)Document:GP4711 MD QuestionnaireIssue n° :2Page n° :1 of 8Number of Employees 员工数量Total number of employees in the organisation 组织总员工数 Total number of employees in the activities to be certified by this proposal包含在此认证范围内的总员工数Do you operate a shift system or conduct any activities outside daytime working hours?是否有轮班或白天工作时间以外的活动?YesNoIf YES, indicate shift patterns.如果有,指明轮班模式Processes 过程Please list the main processes or activities on the main site 请列出审核现场的主要过程或活动(如业务/生产流程)Locations/Multi site Registrations 多地址注册If you wish to include other sites in the same registration, please indicate below:如果同一个注册认证包括其它地址,请说明下列各项Location 2第二场所Number of Employees员工数Address 地址Post Code 邮编 Processes/Activities 过程/活动 Location 3 Address Number of EmployeesPost Code 邮编 Processes/Activities 过程/活动Document:GP4711 MD QuestionnaireIssue n° :2Page n° :2 of 8Continue on separate sheet if required 必要时可使用分页 必要时可使用 使用分页Additional Information (only for new Quality Management Systems)附加信息(只对新的质量管理体系) 附加信息(只对新的质量管理体系)Do you have a Quality System? 是否有质量管理体系 Yes NoIf YES, please indicate with an X and indicate what type of quality system you have? 如果是请用 X 标明管理体系 的形式(注: 在适用的选项处双击就可标记 ) PAPER 纸张的 ELECTRONIC 电子版的 MIXED 二者混合的Please indicate if you have a timescale(s) for the following 如果您有时间安排请填写下列各项 Implementation date of the system? 体系实施日期 Is a pre-assessment audit required? 是否需要预审 Have you completed a management review? 是否完成管理评审 Have you commenced internal auditing? 是否已实施内审格)?Yes YesNo NoWhat is the approximate number of pages in the System excluding forms? 体系大约多少页 (不包括表Background Information 背景信息Has previous contact been made with SGS Personnel? 是否和 SGS 联系过 If YES, please state the name of the person and if applicable the date of meeting/visit etc.如果是,请陈述联系人、会面/访问的日期YesNoWhere did you hear about SGS? 在哪里听说 SGS 公司的 If you currently use any other SGS Services please give details 如果现在享用 SGS 的其它服务,请陈述详细情况If you have used (in the last two years only) or intend to use consultancy services for the activities to be certified please give the name of the consultancy organisation and/or the name of the individual consultant(s) 针对认证范围,是否曾经(在两年内)或打算运用顾问服务,如有,请注明顾问公司的名称和/或顾问的姓名。