第1章 热力学基础3热力学函数关系
- 格式:ppt
- 大小:1002.50 KB
- 文档页数:30







第一章热力学函数及其相互关系(1):热力学状态与气体方程系统与环境、平衡状态、非平衡状态、稳定状态、可逆过程与不可逆过程、局部平衡、部分平衡与介稳平衡、温标的发展、热力学温标、理想气体定律、van der Waals状态方程、virial方程、Redlich-Kwong方程、实际气体的液化与临界现象、对应态理论1.1系统、环境、热力学状态1.1.1 系统与系统的环境热力学把相互联系的客观真实世界区分为系统与系统的环境两部分。
系统(system)是我们要研究的那部分真实世界,即我们要研究的那部分物质或空间。
假如要研究一台运行着的热机汽缸内气体性质的变化,或者要研究一反应器中的全部物质,就分别是两种不同情况下的系统。
又如一氧气缸瓶在不断地向外喷射氧气,我们要研究喷射过程到某阶段时钢瓶中剩余氧气的性质,则该瞬间瓶中残留的氧应当是系统。
以往的书刊中曾用过一些系统的同义词,例如“物系”、“体系”等等。
系统的环境(surroundings)是系统以外与之相联系的真实世界,可以简单称为环境或外界。
需要指出,系统与环境之间可以有实际存在的边界隔开,例如上述汽缸、反应器壁等;也可能在系统与环境间只有假象的边界隔开,例如上述氧气瓶中作为系统的残留氧气与喷射出去的那些氧气本来是存在于同一钢瓶中,它们之间没有任何间隔,而喷射出去的那些氧气实际是环境的一部分。
系统与环境之间的联系包括有能量交换与物质交换两类。
针对二者之间联系情况的差别,可以把系统分成以下三种:(1) 隔离系统(孤立系统, isolated system)隔离系统(孤立系统)与环境之间既无能量交换,又无物质交换,所以环境对隔离系统中发生的任何变化不会有任何影响。
在热力学中,有时我们把所研究的系统及该系统的环境作为一个整体来看待,这个整体就应当是隔离系统。
(2)封闭系统(closed system)封闭系统与环境之间只有能量交换而无物质交换。
在前面提到的几个系统中,物质均被封闭于实有的容器间壁内或假象的边界内,使系统仅能通过界面与环境有热、功等形式的能量交换,故应当属于封闭系统。


第一章热力学基础目的要求:1. 理解热力学的一些基本概念:系统与环境、状态与状态函数、热和功、各种热力学过程。
2. 明确热力学能和焓的定义及状态函数的特征,理解热力学能变与恒容热,焓变与恒压热之间的关系。
3. 理解热力学第一定律的文字表述,掌握热力学第一定律的数学表达式及其应用。
4. 理解可逆过程及其特征。
5. 明确过程量热和功的正、负,理解体积功、热容、显热、潜热、化学反应热、摩尔相变焓、标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念。
6. 能熟练地运用热力学第一定律计算系统在理想气体的纯 P V T 变化、在相变化及化学变化中的应用(计算功、热、热力学能变、焓变)。
7. 能熟练地应用标准摩尔生成焓、标准摩尔燃烧焓求标准摩尔反应焓,能用基尔霍夫公式计算不同温度下化学反应的焓变。
8. 了解自发过程的共同特征。
理解热力学第二定律的文字表达。
9. 了解熵判据的表达式和熵增原理,较熟练地计算单纯P、V、T变化过程、相变和化学反应的熵变。
10. 理解规定摩尔熵、标准摩尔熵,理解标准摩尔反应熵的定义及掌握化学反应熵差的计算。
11. 理解熵的物理意义,了解热力学第三定律、卡诺循环、卡诺定理。
12. 明确亥姆霍兹函数、吉布斯函数的概念,较熟练地计算各种恒温过程的ΔG。
13. 明确熵判据、亥姆霍兹函数判据、吉布斯函数判据应用条件,会用熵判据、吉布斯函数判据判断过程的方向和限度。
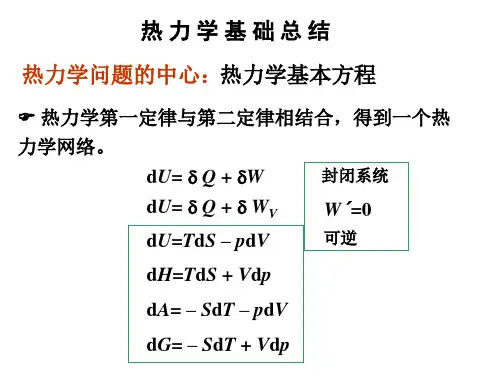
14.了解热力学基本方程及一些重要关系式。
教学重点难点:1.基本概念:系统与环境、状态与状态函数、热和功、各种热力学过程2.热力学的状态函数:热力学能、焓、熵、亥姆霍兹函数、吉布斯函数2过程量:热和功3.基本定律:热力学第一定律、热力学第二定律、热力学第三定律4.热力学第一定律对理想气体的状态变化过程、相变过程及化学变化过程的应用(计算Q、W、ΔU、ΔH)。
5.热力学判据:熵判据、亥姆霍兹函数判据、吉布斯函数判据的具体应用(计算ΔS、ΔG、ΔF)。